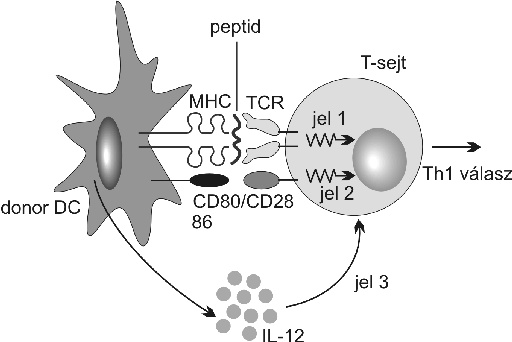
1. ábra. Az 1-es és 2-es jelátvitelben részt vevő membránreceptorok a T- és dentrikus sejtek interakciójában
A transzplantációs immunológia alapvető kérdése, hogyan lehetne beavatkozások és terápia fejlesztésével a recipiensbe a histoinkompatibilis transzplantátummal szemben végleges immunológiai befogadóképességet elérni. Az immunoszupresszív gyógyszerek látványos fejlődése és a biotechnológia segítségével létrehozott biológiai anyagok bevezetése ellenére az ideális állapot még messze van a klinikai realitástól. A kísérletes és klinikai kutatások célja ebben a vonatkozásban a végleges transzplantációs tolerancia létrehozása. Bár az utóbbi évtizedben számos kutatási program zajlott le ebben az irányban, a közölt eredményekből igen nehéz egyértelmű következtetéseket levonni. Mindezek előrebocsátásával ebben a közleményben a történeti háttér bemutatása mellett tisztázzuk a terminológiai kérdéseket, és összefoglaljuk a perifériás tolerancia indukciójához alkalmazott módszereket. Mivel a legtöbb eddigi klinikai tanulmány csak kevés beteget ölel fel, és rövid megfigyelési időre támaszkodik, azok bemutatását nem kísérheti kritikai értékelés.
A kimérizmus és az immunológiai tolerancia felfedezése
Roy Owen 1945-ben közölte a szarvasmarha kétpetéjű ikrekkel kapcsolatos alapvető felismerését, mely szerint a felnőtt ikrek vörösvérsejtjei genetikailag saját, de egyben eltérő tulajdonsággal is rendelkeznek, mely utóbbi az ikertestvértől származtatható. Arra a következtetésre jutott, hogy "valamely mechanizmus felelős a genotípusosan különböző, de fenotípusosan identikus" biológiai tulajdonságért, melynek hátterében Frank Rattray Lillie tíz évvel korábbi megfigyelését feltételezte, miszerint a szarvasmarha ikrek placentái anatómiai érösszeköttetésben állnak egymással. Négy évvel később, 1949-ben Frank Macfarlane Burnet és Frank Fenner a "saját marker" hipotézisükről írt monográfiájukban kiemelték, hogy Owen megfigyelése mint a természetben előforduló egyedi eset, kitűnő bizonyíték az elméletükre. Hipotézisük kísérletes alátámasztására javasolták idegen vörösvérsejtek embrionális korban való beoltását e "toleráns állapot" létrehozására. Ezt a fogalmat E. Traubtól vették át, aki először írta le ezt a jelenséget, amikor egér embriókat lymphocytás choriomeningitis vírussal oltotta be, melynek következtében az egerek a vírus egészséges hordozói lettek, mivel specifikus ellenanyagtermelésre nem voltak képesek a mikroorganizmussal szembeni tolerancia kialakulása matt.
A fentiekben említett kísérletektől függetlenül Peter Medawar a kétpetéjű szarvasmarha ikreket bőrtranszplantációs tesztekkel vizsgálta az egypetéjűség illetve kétpetéjűség megállapítása céljából. A legnagyobb meglepetésére azonban a kétpetéjű ikrek transzplantátuma nem lökődött ki. Miután egyik munkatársa felhívta a figyelmét Burnet monográfiájára, feltételezte, hogy az abban leírtak és az általa megfigyeltek hátterében azonos jelenség állhat. Miután 1951-ben Medawar közölte alapvető bőrtranszplantációs megfigyeléseit, kutatásait Londonban folytatta Leslie Brent és Rupert Billingham társaságában. Kísérleteikben egérembriókat oltottak idegen törzsből származó lépsejtekkel, majd felnőtt korban bőrátültetésekkel tesztelték a transzplantációs immunitás állapotát. Az embrionális sejtoltás következtében az egerek nem lökték ki a sejteket adó donorok bőrtranszplantátumát, bizonyítva a tolerancia sikeres indukcióját. Ezekben a kísérletekben a haematopoietikus őssejtek beadása alkalmával kiméra állapotok kialakulását is leírták. Medawar és Burnet ezekért a felfedezésekért kapta a Nobel-díjat 1960-ban. A következő évtizedekben tovább fejlődött ez a kísérletes irányzat, és kiegészült a kísérletes csontvelő-transzplantáció módszerének bevezetésével, melyhez kapcsolódóan felismerték a graft-versus-host és a host-versus-graft betegséget, valamint a kapcsolatot a kimérizmus és tolerancia között (Jankowski, 1977; Sachs, 1989).
A kimérizmus és a tolerancia terminológiája és alapvető feltételei
Mi a kimérizmus, és milyen különböző formái vannak? A kiméra olyan biológiai szervezet, mely azonos vagy eltérő faj genetikailag különböző egyedeinek sejtjeit vagy szöveteit hordozza. Általánosságban a kiméra állapot két formája különböztethető meg: a komplett vagy teljes (makro) és a kevert (mikro) kimérizmus. A komplett kiméra teljes haematopoietikus rendszere az idegen donortól származik. A kevert kiméra esetében a haematopoietikus rendszer, beleértve az immunrendszert, részben donor-eredetű a recipiensből származó sejtpopulációk mellett. Ez utóbbi esetében a donor és recipiens eredetű sejtek keveréke egy sejtvonalon, illetve sejtpopuláción belül is előfordulhat (például dendritikus sejtek vagy T-sejt-szubpopulációk). Ezt a lehetőséget mozaik- vagy hasított kimérizmusnak is nevezik.
A kimérizmus formáit meghatározó feltételeket az 1. táblázat foglalja össze.
Általánosságban ezek egyrészt a befogadó, vagyis recipiens szervezetével kapcsolatosak, beleértve annak mindennemű kezelését, másrészt a beadott sejtek eredetével illetve manipulációjával állnak összefüggésben. A befogadó illetve recipiens tekintetében két fő szempontnak kell érvényesülnie ahhoz, hogy a kiméra állapot kialakulhasson. Az egyik a befogadó szervezet T-sejtjeinek eltávolítása különböző immunoszuppresszív kezelések segítségével a kilökődés megelőzése céljából, a másik a "meghonosodás" helyének előkészítése a myeloablatív kezelés révén. Ezenkívül még számos fiziológiai és pathológiai feltétel szabja meg a kimerizmus állapotát. Ezek közül csak egyet említünk, a thymust, mely központi és alapvető szerepet játszik a tolerancia egyik formájának kialakításában. A beadott sejtek vonatkozásában azok száma és összetétele lényeges szereppel bír a donorra jellemző immunológiai állapot mellett. A donorsejtek a transzplantált szervvel is átkerülhetnek mint "utas lymphocyták".
Az immunológiai tolerancia fogalma jól definiált, habár szükséges hangsúlyozni, hogy annak speciális formáját képezi a transzplantációs tolerancia. Ebben az esetben az allotranszplantátum immunszuppresszív kezelés nélkül is folyamatosan és jó funkcióval marad életben, szemben a klasszikus tolerancia állapottal, amely specifikus antigén által indukált immunológiai válaszképtelenséget jelent. Más szempontból különböztethető meg a centrális és a perifériás tolerancia. A centrális tolerancia mechanizmusára és jellemző sajátságaira vonatkozóan ezúton csak kiváló összefoglaló tanulmányokra hivatkozunk, melyek elsősorban a thymus szerepét hangsúlyozzák (Sprent, 2001).
Mivel a perifériás tolerancia e közlemény fő témája, a következőkben erről adunk részletesebb információt. A perifériás tolerancia az alloreaktív T-lymphocyták inaktivációját jelenti a periférián a donor antigén folyamatos jelenléte következtében, kialakítva egy immunreguláció-eltérést a különböző funkciók szintjén. A centrális tolerancia esetében - ezzel ellentétben - az alloreaktív T-lymphocyták klonális deléciója történik a thymusban a sejtek differenciációja során lezajló pozitív és negatív szelekció révén. Megjegyzendő azonban, hogy a centrális tolerancia is szerepet játszhat a kevert kimérizmus kialakításában vagy a perifériás tolerancia mechanizmus lezajlása során (Lechler, 2001).
A 2. táblázat foglalja össze a perifériás tolerancia főbb formáit, melyeknek színes nomenklatúrájuk van, mint például aktív, infekciózus és operatív tolerancia vagy szuppresszív immunreguláció. Klinikai és immunológiai szempontból a kevert kimérizmusnak a legnagyobb előnye, hogy megmarad az immunokompetencia, ám csökken a graft-versus-host reakció kialakulása. Ezzel ellentétben a komplett kimérizmus esetében súlyos immundeficiencia alakul ki, és nő a tumorok előfordulása. Csontvelő-átültetés esetében a graft-versus-leukemia effektus az egyéb mellékhatásoknál fontosabb szerepet játszik.
A perifériás tolerancia indukciójának módszertana
Általánosságban elfogadott, hogy a tolerancia együtt jár a kevert kimérizmussal. Ez világosan megnyilvánul a klasszikus csontvelő-transzplantációs kísérletekben, amikor a graft-versus-host reakció szignifikánsan csökkent mértékben fordult elő vagy éppen hiányzik a kevert kimérizmus állapotában. Ezekben az esetekben a donor eredetű bőrtranszplantátumok nem lökődnek ki. Ezzel ellentétben a teljes kiméra állapothoz súlyos és gyakori graft-versus-host reakció társult. Mik az alapvető feltételei a perifériás tolerancia indukciójának?
Az egyik tényező a donorsejtek folyamatos jelenléte (dendritikus-, T-, B-sejtek), a másik a nem professzionális antigén prezentáció, beleértve a sejt-sejt kontaktust valamint a jelátvitel sajátságait. Az 1. ábra vázolja az aktivációs folyamatért felelős, és a "jelátvitel" 1- és 2-ben részt vevő sejtfelszíni determinánsokat, valamint ligandokat. Egy másik fontos feltétel a donor eredetű alloreaktív klónok visszaszorítása, bár a befogadó szervezet egyes sejtpopulációinak közreműködése szintén nélkülözhetetlen. A befogadó szervezet ezen antigénprezentáló sejtjeinek túlsúlya biztosítja az indirekt alloantigén vagy peptid prezentációt, mely összefüggésben áll a tolerancia fennmaradásával (2. a-b ábra). Optimális helyzetben a kevert kiméra állapotban beadott haematopoetikus sejtek a csontvelőben megtapadnak, ahonnan mind a donor, mind a recipiens típusú sejtek a thymusba migrálnak, és részt vesznek a klonális deléció folyamatában. Ezért ebben a fázisban fontos a donorreaktív T-sejtek kiiktatása a thymusból, de egyben e szerv eredeti funkciójának helyreállítása is. A periférián emellett a donor és a recipiens eredetű sejtek toleráns és kevert kiméra állapotban találhatók. Ez a mechanizmus azonban csak az egyik lehetőség, más thymusfüggetlen utak is működnek az anergia vagy szuppresszív reguláció eseteiben (2. táblázat) (Onodera, 1999).

1. ábra. Az 1-es és 2-es jelátvitelben részt vevő membránreceptorok
a T- és dentrikus sejtek interakciójában
A fenti mechanizmusoknak megfelelő protokollok a következő két fő csoportba sorolhatók. A beavatkozások egyik csoportja a gazdaszervezet kondicionáló kezelését, a másik a donor alloantigének vagy sejtek manipulációit foglalja magába. A teljesség igénye nélkül a 3. táblázat foglalja össze mindkét metodológia lehetőségeit. A recipiens kondicionálása tekintetében valamennyi eljárás részleges myeloablációt és immunoszuppressziót kíván elérni, általában e célra alkalmazott gyógyszerek redukált dózisaival vagy biológiailag aktív immunoterápiás anyagokkal. A teljes test irradiatiót szublethális dózisokkal végzik, egy ülésben vagy frakcionáltan (3 Gy). Ezt lehet kombinálni a thymus 7 Gy-vel történő lokális besugárzásával. Ezeket a kezeléseket általában a donorsejt-infúzió napján vagy egy-két nappal azt megelőzően végzik. Alternatív myeloabláció végezhető konvencionális, csontvelő-átültetéseknél használt citosztatikus gyógyszerekkel, például Busulphan, de redukált dózisú protokollokkal egyaránt (Sharabi, 1989; Barta, 2001). A gazdaszervezet haemato- és immunapparátus funkciója blokkolásának új útja a T-lymphocyta-markerek, receptorok, adhéziós és kostimulációs molekuláinak külön, vagy együttes blokkolása aspecifikus monoklonális ellenanyagokkal. A következőkben csak a legszélesebb körben alkalmazott egyes módszereket fogjuk bemutatni.
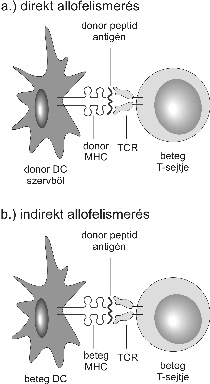
2. ábra. Direkt és indirekt allofelismerés donor DC és recipiens T-sejtek (a),
valamint recipiens DC és recipiens T-sejtek között.
A röntgenbesugárzás és az anti-lymphocyta- illetve anti-thymocyta-globulin kombinált adása mellett a nem depletáló anti-CD4 monoklonális ellenanyag Kathryn Wood (Oxford) által történt bevezetése került az érdeklődés központjába. Ez a jelátvitel 1. út erős blokkolását eredményezte. A kostimulációs 2. jelátviteli út blokkolására olyan anyagokat fejlesztettek, melyek a CD40-CD154 és/vagy CD28-CD80/86 interakcióját érintik (2. a-b ábra). Kísérletes modellekben optimális eredmény volt elérhető, ha mindkét kostimulációs utat együtt blokkolták. A másik fontos tényező, amely az összes fenti beavatkozást megelőzi, a donorspecifikus antigén illetve sejtek beadása. Ezen biológiai aktív anyagok alkalmazása, nem myeloablatív kondicionálással kombinálva, kísérletes szövet- és szervátültetésekben (vese-, szív-, máj- és Langerhans-sejtek átültetése) kevert kimérizmus és tolerancia kialakulásához vezetett. E kombinációk alkalmazása a donorspecifikus klónok aktivációját hozza létre, miáltal azok érzékenyebbé válnak a citosztatikus vagy funkcionális blokkoló kezelésekkel szemben. Mivel a donorspecifikus transzfúzió állatkísérletekben és klinikai szervátültetésekben e területen igen eredményesen volt alkalmazható, a következőkben részletezzük a "jótékony transzfúziós hatás" lényegét és jelenlegi felhasználását (Lechler, 2001; Subbotin, 1998; Bushell, 1994).
A transzfúzió és őssejt-inokuláció szerepe a perifériás tolerancia indukálásában
A 4. táblázat foglalja össze a transzfúzió hatásának mérföldköveit az emberi vesetranszplantáció történetében. A mechanizmusra vonatkozó legtöbb elmélet a perifériás tolerancia valamely típusát vagy a szuppresszív immunreguláció szerepét feltételezi. Ezek a feltételezések alátámaszthatók azokkal a megfigyelésekkel, amikor a párhuzamosan adott immunoszuppresszív kezelés eredményeként in vitro módszerekkel az alloreaktivitás csökkenését lehetett kimutatni (Petrányi, 1997). Annak érdekében, hogy könnyebben lehessen megérteni a transzfúzió szuppresszív hatását, saját kísérletes és klinikai vizsgálatainkból mutatunk be reprezentatív eredményeket a donorspecifikus transzfúzió (DST) élő donoros vesetranszplantációk esetében való alkalmazásáról.
A hatvannégy főt magában foglaló élő rokondonoros vese várakozási listáról tizenhat beteg került a DST programba, akik a prospektív családi donorral szemben (legtöbb esetben szülők) igen magas kevert lymphocyta kultúra (MLC) reakciót képviseltek. Korábbi tanulmányainkban és más vizsgálatokban kiderült, hogy tisztított a vérlemezkepreparátum (csak MHC I osztályú és nem MHC antigéneket kifejezve) szuppresszív immunoregulációt idéz elő szenzitizáció helyett. Ennek megfelelően néhány beoltást követően "blokkoló" antitesttermelés indul meg párhuzamosan in vitro mért T-sejt-alloreaktivitás csökkenésével (MLC, CTLp, CML). A csökkent MLC reaktivitású szövetkultúrákból kiemelt effektor sejtek egy másik MLC reakcióba helyezve erős gátlást fejtenek ki, bizonyítva a szuppresszor T-sejtek jelenlétét és szerepét. A T-lymphocyták aktivációs marker vizsgálata kimutatta az MHC II osztályú molekulák, valamint a CD25 (IL-25R) marker csökkent expresszióját (Padányi, 1998). Ez a megfigyelés adta számunkra az indítékot, hogy hasonló módszerrel indukáljunk a recipiensben vesetranszplantáció előtt szuppresszív regulációt illetve perifériás toleranciát a családi donor vérlemezke preparátum transzfúziójával. A DST hatékonyságát a "blokkoló" (FcgR és MLC) ellenanyag megjelenésével és az MLC-reakció változásával lehetett nyomon követni. Három vérlemezke-transzfúziót követően a tizenegy recipiensben szignifikánsan csökkent az MLC-reaktivitás - gyakorlatilag negatív értékre -, és emelkedett a blokkoló ellenanyagtiter. Ezek az eredmények képezték a vesetranszplantáció indikációját, amely azután a konvencionális immunszuppresszív kezelés kíséretében történt meg. A transzplantációt követő időszakban akut kilökődési reakciót nem lehetett észlelni, és amint azt a 3. ábra demonstrálja, mindegyik vese jó funkcióval élt az első öt évben. Ismert a nagy statisztikai analízisek alapján, hogy a vesetúlélési görbe a kilökődések következtében bizonyos százalékkal évről évre folyamatosan csökken, így a mi esetünkben a transzplantátumok hosszú időn túli folyamatos túlélése a perifériás tolerancia kialakulását igazolja.
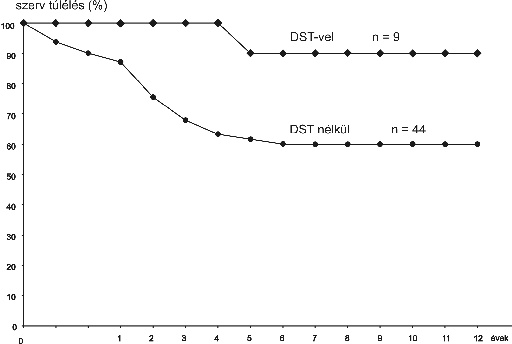
3. ábra. Donorspecifikus transzfúzióval kezelt, valamint kontroll betegek
élő donoros vese túlélése
Jogosan vetődik fel az a kérdés, hogy vajon melyik sejtpopuláció felelős a tolerancia indukciójáért a DST vagy csontvelői sejtek beadásakor. Állatkísérletek sorozatai tisztázták, hogy legnagyobb valószínűség szerint a legfontosabb szerepet e folyamatban a donor-eredetű dendritikus sejtek (DC) játsszák. A dendritikus sejtek kezelése különböző anyagokkal, beleértve a biológiailag aktívakat, az MHC II-, a kostimulációs molekulák, valamint a kemokin receptorok sejtfelszíni kifejeződését csökkentik, és gátolják az IL-12 szekrécióját. Géntranszfekciós technológia alkalmazásával adenovírus vektorba épített IL-10 gén DC-be építésével sikerült az ennek megfelelő citokintermelést és szekréciót növelni. Hasonló genetikai manipulációt lehet elvégezni IL-2, TGFbéta, CTLA4-Ig, FasL stb. génekkel. Egy másik irányzat a dendritikus sejtek érésének gátlásával azok éretlen állapotban tartása. Ezt a prekurzor dendritikus sejtek in vitro, GMC-SF, IL-10, TGFbéta citokineket tartalmazó médiumban történő tenyésztésével lehet elérni (Thomson, 1999; Lu, 2002). A dendritikus sejtek szubpopulációi, azok funkciói, valamint a jellemző sejtfelszíni markereik és az immunogenetikai jelentőségük ma az érdeklődés középpontjában álló kérdés.
A perifériás tolerancia indukciójának immunogenetikai feltételei
A leideni Eurotransplant munkacsoport néhány évvel ezelőtt végzett klinikai kutatásainak eredményei rávilágítottak arra, hogy a "jótékony" transzfúziós hatás a vesetranszplantációkban akkor optimális, ha a transzfúziós donor és a recipiens között csak egy MHC II osztályú alloantigén különbség van. Ezt a megfigyelést támasztotta alá továbbá az, hogy ilyen esetekben a citotoxikus HLA-ellenanyag-termelés és a donorspecifikus MLC-reaktivitás is csökkent volt. Másrészt általánosan ismert, hogy a transzfúziós donor és a recipiens közötti erős HLA-alloantigén-eltérés alloszenzitizációt eredményez, citotoxikus anti-HLA ellenanyag-termeléssel. Az 5. táblázat egy reprezentatív vizsgálatunk eredményét mutatja be, mely szerint a transzfúziós szenzitizáció illetve immunmodulációs hatás a donor és recipiens közötti HLA-fenotípus-egyezés illetve különbség függvénye. A három kiválasztott paraméter (CTLp, citotoxikus HLA ellenanyag és "blokkoló" antitest) jól jelzi a szenzitizáció és immunreguláció mértékét, tükrözve a histokompatibilitás eltérésének mértékét. Más kísérletes megfigyelések is jelzik, hogy jobb hatásfokkal alakítható ki a perifériás tolerancia, ha a donor és recipiens között mérsékeltek az MHC különbségek. Ebben az esetben - mivel a T-sejt-reaktivitás jelentősen alacsonyabb - az alloreaktív "sejtpool" is könnyebben zsugorítható kondicionáló kezeléssel a kontrollálható szintre (Petrányi, 1997; Peugh, 1988).
A fentiekben vázolt immunogenetikai és allogénstimulációs sajátságok mellett egyre növekszik az egyéb tényezők megismerése, melyek szükségesek a specifikus alloreaktív T-sejtek immunszuppresszív kezeléssel való befolyásolásához. A specifikus reaktív sejtek elpusztításának indukciójához a gyógyszeres kezeléshez (Rapamicin, IL-2 szekréciót gátlók, kalcineurin gátlók stb.) társulva a donor antigének különböző formáinak közreműködése (szolubilis alloantigének vagy peptidek, sejtek csökkent MHC expresszióval, alárendelt MHC- és más, nem-MHC polimorf antigének) segíthetik elő a perifériás aktivációt. A másodlagos alloantigén rendszerek aktivációs folyamatban való részvétele tekintetében felismertünk egy polimorfizmust, mely a leukocyták egyes populációin, a vérlemezkéken és a trophoblastokon kifejeződve található meg. Ez a még csak szegényesen felismert rendszer öt allotípussal rendelkezik, melyek az előbbiekben említett sejtpopulációkon mutathatók ki. Tipizált donor/recipiens párok között végzett tervezett transzfúziós vizsgálatainkban kimutattuk, hogy e polimorf rendszerben eltérésnek kell lenni a donor és recipiens között a szupresszív reguláció előidézéséhez. Ez azt jelentette, hogy a HLA-haploidentitás és TLX-allotípus-eltérés együtt járt a blokkoló ellenanyag-termeléssel és a csökkent CTLp gyakorisággal (Petrányi, 1995). Ezek a megfigyelések talán segítenek a perifériás toleranciaindukció komplexitásának megértésében, ami nemcsak a myeloablatív és immunszuppresszív kezeléstől, valamint donorsejt-, illetve antigénbeadás körülményeitől, hanem az immunogenetikai feltételektől is függ.
Tolerancia-indukció lehetőségei a klinikai transzplantációban
Bár igen meggyőző az immunoszuppresszív gyógyszerek fejlődése, hiszen egyre több szelektív hatással rendelkező anyag kerül forgalomba, a toxikus mellékhatások, a fertőzés és daganatos szövődmények indítékot adnak arra, hogy alternatív és fejlettebb beavatkozásokat dolgozzanak ki a transzplantátum különböző kilökődési formáinak megelőzésére. Ezért nemcsak az állatkísérletekben (lásd fent), hanem a klinikai gyakorlatban is különböző eljárásokat vezettek be, hogy specifikus válaszképtelenséget hozzanak létre a transzplantátummal szemben. Annak érdekében, hogy a fejlődést ezen a területen jobban elősegítsék, az NIH (National Institute of Health) közreműködésével Immuntolerancia Hálózatot (Immune Tolerance Network, ITN) hoztak létre 1999-ben Jeffrey Bluestone vezetésével. USA és Európa legjobb transzplantációs központjai különböző munkacsoportok kialakításával csatlakoztak az együttműködéshez, a tapasztalatok kicseréléséhez, mint például szigetsejt-transzplantáció, a tolerancia kialakulásának nyomon követése, vesetranszplantáció, autoimmunitás és allergia. A következőkben az ITN-ből származó legfrissebb adatok alapján összegezzük a humán szervátültetésekkel kapcsolatos eljárásokat és eredményeket.
Hasonlóan a DST eljáráshoz az egyik beavatkozás pre- vagy perioperatív csontvelősejtek beadását jelenti klasszikus immunszuppresszív kezelés mellett. Egy másik módszer kiegészítő anti-T-sejt ellenes immunotherápiát alkalmaz a csontvelősejtek beadása mellett. Szükséges megemlíteni, hogy magas dózisú csontvelősejtek beadása is hatékonynak mutatkozik anélkül, hogy emellett lymphoablációt vagy alloreaktív T-sejt-eltávolítást végeznének. A csontvelői sejteket perioperatív beadáshoz cadaver szervátültetések esetében a csípőlapátból vagy a bordákból nyerik. A csontvelő sejtszuszpenzió tisztítása után, fagyasztás nélkül 2x1010 sejtet adnak be a transzplantációval egy időben egy dózisban vagy két adagban. Élő donoros transzplantációk esetében perifériás őssejteket szeparálnak és adnak be 1x109 dózisban. A kiegészítő citoredukciós immunoterápia OKT3, ATG vagy ALG készítményekkel egyidejűleg történhet a csontvelősejtek infúziójával és a transzplantációval. A klinikai szervátültetések, melyekben tolerancia indukciója céljából a fentiekben vázolt sejtterápia bármelyik formájával próbálkoztak, érintették a legtöbb transzplantációt: mint például vese, máj, szív, tüdő, pancreas és szigetsejtek. A beavatkozások hatékonyságát az immunoszuppressszív gyógyszerek (például szteroidok), megvonási lehetőségével, a donorspecifikus in vitro sejtközvetített immunparaméterek (például MLC, CML) reaktivitásának mérésével, valamint a kevert kimérizmus kimutatásával lehetett megítélni. Általánosságban a tolerancia indukált csoportokban szignifikánsan eltérő értékeket kapunk a kontrolladatokhoz viszonyítva, melyek a szuppresszív reguláció kialakulása irányába mutattak (Rao, 1998).
Az egyik legutolsó közlemény, mely egyben a legnagyobb esetszámmal rendelkezett, és a csontvelői sejteket adott be szervátültetés kíséretében, a Pittsburgi Intézetből származik. Eredményeikből az alábbiakat emeljük ki. Az 1992 és 2000 közötti időszakban 124 vesetranszplantáció esetében csontvelősejteket infundáltak Tacrolimus alapú immunszuppresszív protokoll kísérletében, mellőzve más citoreduktív terápiát. Kimérizmust 92 %-ban értek el, szemben a kontrollok 64 %-ával. A vesetúlélés 76 %/5 év volt a csontvelővel kezelt csoportban, szemben a kontroll 71 %-os értékével. Szignifikáns különbséget kaptak azonban a krónikus allograft nephropthia előfordulási gyakoriságára vonatkozóan. A huszonnyolc szívátültetés esetében a transzplantátum túlélése azonos volt a csontvelőkezelt és a kontrollcsoportban (86-87 %), de az akut kilökődési reakció 3. fokozatának előfordulása szignifikánsan csökkent. A csontvelőkezelt csoportban 64 %-ban nem volt kilökődés, szemben a kontrollok 40%-ával. Hasonló számú tüdőátültetést végeztek, melyek során, bár a transzplantátumok túlélése mindkét csoportban azonos volt, az obliteráló bronchiolitis csak 5 %-ban fordult elő a csontvelősejtekkel kezelt csoportban (Shapiro, 2001).
Az egyik legfontosabb következtetés a fentiekben érintett klinikai tanulmányokból, hogy a csontvelősejtek beadása biztonságos, akár cadaver, akár elő donorból származnak. Az egyik legnagyobb gond etikai vonatkozású, hiszen kérdéses, mennyiben alkalmazható egy új citoreduktív vagy funkcionális blokkoló kezelés a transzplantációk során bevált és konvencionálisan elfogadott terápia helyett vagy mellett. Hasonló kérdéssel nézhetünk szembe, amikor genetikailag manipulált donor dendritikus sejteket alkalmazunk. Jelenleg a klinikai eredmények még messze nem érik el azokat a lelkesítő eredményeket, melyeket a rágcsálókkal és majmokkal végzett kísérletes transzplantációkkal elértek. Remélhető azonban, hogy nemzetközi együttműködés segítségével az emberi szervátültetésekhez kapcsolt, specifikus toleranciaindukciós módszerekkel kapcsolatos nyitott kérdések lépésről lépésre, rövid időn belül megválaszolhatók lesznek.
Konklúzió
Ötven évvel ezelőtt a transzplantációs immunológia Nobel-díjjal kitüntetett úttörői megnyitották a csontvelő- és szervátültetések kutatási lehetőségeit, beleértve a transzplantációs tolerancia és a kimérizmus jelenségének felismerését és leírását. Mindez az állatkísérletek eredményeinek a klinikumban való értékesítését eredményezte, mely a transzplantációkat a rutin egészségügyi ellátás körébe vonhatta.
Donnall Thomas és Joseph Murray Nobel-díjas kutató klinikusok követői új sebészi technikákkal, immunoszuppressziv protokollokkal, nemzetközi kollaborációkkal gyorsan fejlesztették a klinikai transzplantációkat minden területen. Annak ellenére, hogy igen gyorsan lehetett jobb és jobb eredményeket elérni a klinikai transzplantációkban, egyre erősebb lett az igény, hogy csökkentsék az immunoszuppresszív kezelések szövődményeit, elkerüljék az akut és krónikus kilökődéssel járó súlyos tüneteket. Így jutott az érdeklődés központjába a kimérizmus és a toleranciaindukció. Nagy lendületet kaptak azok a kezdeményezések, melyek célja a transzplantátummal szembeni specifikus tolerancia létrehozása volt az immunrendszer pathogénekkel szembeni reaktivitásának érintetlenül hagyása mellett. Az új biotechnológiai és molekuláris genetikai eljárásokra alapítva a megbízható állatkísérletes eredmények rávilágítanak azokra a technikákra és módszerekre, melyek teljesítik majd a klinikai elvárásokat a szervátültetésekkel kapcsolatban.
Kulcsszavak: vesetranszplantáció, donorspecifikus transzfúzió, kimérizmus, immuntolerancia, szuppresszív reguláció, kilökődés, immunszuppresszív kezelés, immunterápia, csontvelői őssejt
Gazda (recipiens) faktorok Immunológiai és hematopoietikus feltételek Anamnesticus transzfúzió Csontvelői dendritikus sejtek túlélése Radio-chemo rezisztens T-sejt klónok Preventív/terápiás protokollok komplikációi Kondicionáló kezelés myeloablativ és toxikus hatásai Teljes testbesugárzás dózisa (TBI) Kondicionáló protokoll myeloablativ cytoreductiv hatása Immunszuppresszív kezelés erőssége Thymus destrukció fokozata Donorral kapcsolatos feltételek A beadott őssejtek eredete és a kísérő egyéb sejtkomponensek Csontvelői vagy perifériás eredetű őssejtek Átültetett őssejt mennyisége A szövet teljes vagy részleges T-sejt-depletiója Szöveti lymphoid sejtek differenciációjának és aktiviációjának állapota A transzplantátumot infiltráló prekurzor dendritikus sejtek aránya és érettségi foka A donor anamnesztikus (történeti) háttere Transzfúzió, terhesség és/vagy virális fertőzés, vakcináció Transzplantáció utáni állapot, komplikációk és terápia Graft-versus-host és host-versus-graft reakció Fertőzések Kondicionáló kezelésből adódó toxikus mellékhatások
1. táblázat * A kimerizmus kialakulásáért felelős tényezők
DELETIO Antigénspecifikus T-sejt-klónok kiesése Korlátozott hisztokompatibilitási eltérés, Csökkent alloreaktív T-sejt receptorok, Thymus vagy perifériás aktiváció útján. ANERGIA T-sejtek funkcionális, specifikus válaszképtelensége A kostimulációs megváltozott ligandok részleges aktivációja Sejt divízió nélküli jelzés, T-sejt antigénprezentáció. SZUPPRESSZIÓ Szuppresszor sejtek fejlődése és differenciálódása T-sejtekkel átvihető, Szabályozó citokinek részvétele (IL-4, IL-10, TGF béta) Sejt-sejt kapcsolat igénye.
2. táblázat * A perifériás tolerancia főbb formáinak jellegzetességei
Kísérletes: Donorspecifikus antitestek Donorspecifikus transzfúzió Donor csontvelő és ALS, ATG Donor antigén és anti-CD4 Donor antigén a thymusban és ALS Donor dendritikus sejtinjekció Teljes test/lymphoid besugárzás Nem myeloablativ kondicionálás Anti-LFA1 és anti-ICAM-1 CD40/CD28 blokkolás Cyclosporin és ALG Donorsejtek genetikai manipulációja Teljes lymphoid besugárzás és ATG Anit-CD3 immunotoxin Nagy mennyiségű őssejt injekció Klinikai: Őssejt és lymphoid besugárzás és ATG Anti-CD25 monoklonális antitest és donor antigén Anti-CD28 monoklonális antitest és donor antigén Anti-CD4 monoklonális antitest és donor antigén "Mini" csontvelő-transzplantáció, Donorspecifikus transzfúzió és Cyclosporin, Csontvelő és OKT3 vagy ATG, Campath 1-3, Nagy mennyiségű őssejt beoltás, Dendritikus sejt kezelés
3. táblázat * Toleranciaindukciót előidéző kísérletes és klinikai lehetőségek
1973 Első beszámoló a transzfúzió és a vesetúlélés összefüggéseiről 1975-1985 Számos, "előnyös" transzfúziós hatást támogató kísérletes és klinikai tanulmány. 1985 A Cyclosporin bevezetése a klinikumban növelte a szerv túlélését, és az "előnyös" transzfúziós hatás elhomályosításához vezetett. 1990 Kísérletes immungenetikai és molekuláris biológiai tanulmányok a perifériás toleranciaindukció transzplantáció előtti "transzfúziószerűdonorsejt kezelésre vonatkozóan. 1997 Prospektív, véletlenszerű tanulmány nagyszámú betegcsoporton újra igazolta a "előnyös" transzfúziós hatást, még a leghatékonyabb, új immunszuppresszív gyógyszerekkel kezelt betegeknél is.
4. táblázat * Az "előnyös" transzfúziós hatás történetének mérföldkövei veseátültetésekben
Recipiens/ Cytolitikus T-sejt gyakoriság antitest-termelés donor párok transzfúzió transzfúzió HLA-eltérés HLA TLX-B . előtt után 10 nappal spec. spec KP - BA 2062:106 ly 362:106 ly 2AB 2DR + - FJ - NJ 3497:106 ly 89:106 ly 1AB 2DR + + MJ - SI 38:106 ly 38:106 ly 1AB 1DR - + CsF - LG 218:106 ly 27:106 ly 2AB 1DR + + HJ - RK 783:106 ly 829:106 ly 3AB 1DR - + RR - RM 246:106 ly 377:106 ly 4AB 1DR - +
5. táblázat * HLA-diszparitáshoz kapcsolódó cytolitikus T-lymphocyta gyakoriság és HLA-antitest-termelés
IRODALOM
Barta Anikó - Dénes R. - Masszi T. - Reményi P. - Bátai A. - Torbágyi E. - Sipos A. - Lengyel L. - Jakab K. - Gyódi E. - Réti M. - Földi J. - Páldi-Haris P. - Avalos, M. - Pálóczi K. - Fekete S. - Török J. - Hoffer I. - Jakab J. - Váradi G. - Kelemen E. - Petrányi G. (2001): Remarkable Reduced Trans-plant Related Complications by Dibromomannitol Non-Myeloablative Conditioning Before Bone Marrow Transplantation in Chronic Myeloid Leu-kemia. Acta Haematologica, 105, 64-70.
Bushell, Andrew - Morris, P. J. - Wood, K. J. (1994): Induction of Operational Tolerance by Random Blood Transfusion Combined with Anti CD4 Antibody Therapy. Protocol with Significant Clinical Potential. Transplantation. 58, 2, 133-139.
Jankowski, Renee A. - Ildstad, Suzanne T. (1997): Chimerism and tolerance. from freemartin cattle and neonatal mice to humans. Human Immunology. 52, 2, 155-161.
Lechler, Robert I. - NG, W. F. - Camara, NO (2001): Infectious Tolerance? Mechanisms and Implications. Transplantation, 72, S29-S31
Lu, Lina - Thomson, Angus W. (2002): Manipulation of Dentritic Cells for Tolerance Induction in Transplantation and Autoimmune Disease. Transplantation, 73, S19-S22
Onodera, Kazuhiko - Chandraker, A. - Volk, H. D. - Ritter, T. - Lehmann, M. - Kato, H. - Sayegh, M. H. - Kupiec-Weglinski, J. W (1999): Distinct Tolerance Pathways in Sensitized Allograft Recipients After Selective Blockade of Activation Signal 1 Or Signal 2. Transplantation, 68, 288-293
Padányi Ágnes - Horuzsko A. - Gyódi E. - Réti M. - Pócsik E. - Kotlán B. - Perner F. - Petrányi G. (1998): Humoral and cell mediated factors involved in the suppressive regulation induced by special blood derivates and their clinical relevance. Transplant Proceedings, 30, 8, 3967-3971.
Petrányi G. - Padányi A. - Szelényi J. - Sármai G. - Gyódi E. - Fülöp V. - Kassai M. - Illés P. - Réti M. - Szigetvári I. - Boros P (1995): The polymorphic human TLX-B/CD46/MCP sytem and its implication in transplantation and reproduction. European Journal of Immunogenetics, 22, 147-161.
Petrányi G. - Réti M. - Harsányi V. - Szabó J (1997): Immunologic Consequences of Blood Transfusion and Their Clinical Manifestition. International Archiv-es of Allergy and Immunology, 114, 4, 303-315.
Peugh, WN. - Wood, KJ. - Morris PJ. Genetic aspects of the blood transfusion effect (1988): Transplantation, 46, 3, 438-443.
Rao, Abdul S. - Shapiro, R. - Corry, R. - Dodson, F. - Abu-Elmagd, K. - Jordan, M. - Gupta, K. - Zeevi, A. - Rastellin,i C. - Keenan, R. - Reyles, J. - Griffith, B. - Fung, J. J. - Starzl, T. E. (1998): Adjuvant Bone Marrow Infusion in Clinical Organ Transplant Recipients. Transplantation Proceedings. 30, 4, 1367-1368.
Sachs, David H. - Sharabi, Y. - Sykes, M (1989): Mixed Chimerism and Transplantation Tolerance. Progress in Immunology, 4, 1171-1176.
Shapiro, Ron - Rao, A. S. - Corry, R. J. - Valenti, M. - Zeevi, A. - Jordan, M. L. - Scantlebury, V. P. - Vivas, C. A. - Jain, A. - McCauley, J. - Randhawa, P. - Gray, E. A. - Dvorchik, I. - McMichael, J. - Fung, J. J. - Starzl, T. E. (2001): Kidney Transplantation with Bone Marrow Augmentation. Five-year outcomes. Transplantation Proceedings. 33, 1-2, 1134-1135.
Sharabi, Yehonatan - Sachs, David H. (1989): Mixed Chimerism and Permanent Specific Transplantation Tolerance Induced by a Nonlethal Preparative Regimen. The Journal of Experimental Medicine. 169, 2, 493-502.
Sprent, Jonathan - Kishimoto, Hidehiro (2001): The Thymus and Central Tolerance. Transplantation, 72, S25-S28.
Subbotin, Vladmir - Sun, H. - Chen, C. - Aitouche, A. - Valdivia, L. - Fung, J. J. - Starzl, T. E. - Rao, A. S (1998): Combined Blockade of CD28/B7 and CD40/CD40L Costimulatory Pathway Prevent the Onset of Chronic Rejection. Transplantation Proceedings. 30, 4, 941-942.
Thomson, Angus W. - Takayama, Takuya (1999): Dentritic Cells and the Outcome of Organ Transplantation. A Contemporary View. Transplantation Proceedings. 31, 7, 2738-2739.