 1. ábra * A búzagének manipulálásának módszerei az évszázadok során
1. ábra * A búzagének manipulálásának módszerei az évszázadok során
Az élő szervezetek fejlődési fájának bonyolult elágazásai ellenére az életet megvalósító molekulák, működési mechanizmusok jelentős konzerváltságot mutatnak a vírusoktól az emberig. Az alapvető életfolyamatok rendező elvének általános érvényesülése gyakran felismerhető rendszertanilag igen távoli élőlények tanulmányozásakor. A számos meggyőző példa között talán kiemelt figyelmet érdemel az öröklődés mikéntjének problémája, hiszen minden sejt, élőlény utódként szülői tulajdonságokkal is rendelkezik. A nemzedékeket összekötő öröklődési folyamat törvényszerűségeinek keresése Gregor Mendel borsókísérleteit követően vezetett el a gének mint a tulajdonságok öröklődéséért felelős funkcionális egységek meghatározásához. Bár a gének szerepét, működését széleskörűen bizonyították a kutatások is, az Ivan Micsurin és Trofim Liszenko nevéhez fűződő irányzat képviselői mégis előszeretettel használták a növényeket az öröklődés génelméletének megsemmisítését célzó, gyakran politikai indíttatású háborújukban. Magyarországon is virágzott ez a szemlélet 1953-ban és az azt követő évtizedben, annak ellenére, hogy már korábban transzformációs kísérletek (Avery et al., 1944) igazolták a DNS mint örökítésért felelős molekula jelentőségét, és a Watson-Crick-modell rávilágított az alapvető strukturális és funkcionális jellemzőkre (Watson - Crick, 1953). Természetesen az évtizedek múlásával a tévutak elvesztik jelentőségüket. Különösen a rekombináns DNS módszerek bevezetése járult nagyban hozzá ahhoz, hogy a gének misztikus világa kémcsőben kezelhető anyagi valósággá szelídült. Így kerülhetett sor a nyolcvanas évek elején növényi gének izolálására, funkcionálisan működőképes génkonstrukciók létrehozására és azok növényekbe történő beépítésére. Új fejezet kezdődött a növényi világ kutatásában, és természetesen a növények nemesítésében. A Watson-Crick-modell hiányában nem jutottunk volna el a genomika korszakába, amikor számos élő szervezet, így a lúdfű (Arabidopsis), rizs, kukorica teljes DNS-állományának megszekvenálása utat nyitott a genomszintű megközelítések számára.
A láthatatlan gének és több évszázad növénynemesítési gyakorlata
A növények emberi érdekek, célok szerinti alakítása, nemesítése a génmanipuláció művészete. A fajta-előállítás mindennapi gyakorlatában a kívánt génkombinációk létrehozása és megtalálása azért bonyolult művelet, és azért igényel intuitív képességeket, mert a felszínen megjelenő tulajdonságok fenotípusos vizsgálatával csak közvetve tájékozódhatunk a gének jelenlétéről, működésének mikéntjéről. Mint az 1. ábra szemlélteti, ez a folyamat a búza esetében évezredekkel ezelőtt az alakor formák termesztésbe vételével elkezdődött. Spontán kereszteződések és a poliploidizáció vezettek a kenyerünket adó gabona mai változatainak kialakulásához. A XIX. század közepétől a természetes evolúciós folyamatok még inkább háttérbe szorultak, hiszen a tudatos szelekció, később pedig a szülői növények megválasztása és keresztezése tette hatékonyabbá a búza génösszetételének célirányos befolyásolását.
A növénynemesítés sikerességét sokban szolgálta a genetikai, növényélettani és a kórtani kutatások eredményeinek felhasználása. Jól érzékelhető hatása volt a citológiai módszerek tökéletesítésének, amelyek lehetővé tették a kromoszómák számának meghatározását és a strukturális átrendeződésének kimutatását. A mesterséges poliploidizációra alapozott nemesítés kiemelkedő eredményeket hozott például a cukorrépatermesztésben. A gének hirtelen megváltozásai, mutációi nemcsak a természetes evolúció során játszanak szerepet, hanem a genetikai variabilitás fontos forrásai a nemesítési tenyészanyagok esetében is. A mutációk gyakoriságának besugárzással vagy mutagén vegyületek felhasználásával történő megemelése durva és véletlenszerű beavatkozás, amely ennek ellenére eredményezheti hasznos genotípusok kialakulását.
Általános megfigyelés, hogy a termesztett növényeinkkel rokon, vadon élő fajok számos, agronómiai szempontból értékes génnel rendelkeznek. Különösen gazdag forrásai lehetnek betegségekkel vagy szélsőséges környezeti tényezőkkel (szárazság, fagy) szembeni rezisztenciát biztosító géneknek. Ezért a távoli keresztezések evolúciós korlátait a nemesítői találékonyság folyamatosan próbálja megkerülni. A testi sejtekből izolált protoplasztok fuzionáltatásával létrehozott szomatikus hibridek jelentősen kiszélesítették a nem rokon növények közötti génátvitel lehetőségeit. Mind a faj- és nemzetségkeresztezések, mind a sejthibridizáció során a gének tízezrei véletlenszerűen rekombinálódnak, így csak utólag, a növények tulajdonságait értékelve lehet a kívánt génkombinációkat megtalálni és hasznosítani.
A növényi gének szerkezetének és működésének titkait őrző DNS-molekulák
A rekombináns DNS módszerek kidolgozását követően kézenfekvő volt a növényekből izolált DNS-minták tanulmányozása az új metodikák birtokában (Dudits, 2000). Elkészültek az első genomikus gén klóntárak. Egyedi gének szekvenciaadatai alapján be lehetett határolni a növényi gének főbb funkcionális elemeit, amelyek a már ismert állati gének szerkezeti elrendeződéséhez sokban hasonlító felépítést mutattak. Igazolódott, hogy a kódoló DNS-szakaszt megelőző (5' végi) ún. promoterrégiók sajátos szekvenciamotívumokkal (cisz elemekkel) rendelkeznek, amelyek fénytől, szövettípustól vagy környezeti hatásoktól függő génkifejeződést biztosítanak. A cisz elemekkel kölcsönható akár gátló, akár aktiváló fehérjék (transzkripciós faktorok) megismerése elengedhetetlen a szabályozott génkifejeződés törvényszerűségeinek megismeréséhez. A legújabb kutatási eredmények fényében kiemelt hangsúlyt kap az a tény, hogy az egyes gének promotereinek működési állapotát alapvetően meghatározza a kromatin szerkezete. Változások a DNS metiláltságában, a hisztonfehérjék acetiláltságában, foszforiláltságában egyaránt szerepet játszanak a kromatin átstrukturálódásában. Mindinkább igazolást nyer, hogy az átrendeződésért (Chromatin-remodelling) felelős fehérjék mutációs hibái elvezethetnek a fejlődési program összezavarásához. Így fordulhat elő, hogy kimarad a növényi életciklus vegetatív fázisa, és a mutáns növények csírázás után azonnal virágot hoznak. Hibás kromatinszerkezet megtermékenyítés nélkül is okozhatja az endospermium-szövet kialakulását. A kromatinszerkezettel kapcsolatos kutatások is világosan mutatják, hogy a DNS-molekulák nukleotidszekvenciájában tárolt információnak a sejtfunkciók működtetéséhez való felhasználhatósága a magasabb szintű szabályozási rendszer ellenőrzése alatt áll.
A gének elsődleges termékei, az mRNS-molekulák vezérlik a sejtfunkciókhoz szükséges fehérjék, enzimek szintézisét. Az mRNS felhasználásával szintetizált ún. cDNS-molekula populációk egy adott sejt- vagy szövettípus aktív génjeit reprezentálják, és így fontos jellemzői az aktuális funkcionális vagy fiziológiai állapotnak. A növények különböző szöveteiből származó cDNS-bankok sokban segítik a génizolálási programokat. Beteg és egészséges, illetve stresszhatásnak kitett és kezeletlen növényi szövetekből származó cDNS-bankok klónjainak összevetése sok esetben vezetett el agronómiai értékeket felmutató gének azonosításához. A különböző eredetű cDNS-ekkel végzett differenciális hibridizáció mellett mind gyakrabban nagyszámú cDNS-klónt megszekvenálva ún. EST (Expressed Sequence Tag) adatbázisokat hoznak létre, amelyek megbízható alapot adnak az in silico végzett génvadászatokhoz.
Génkutatás in silico és növénynemesítés molekuláris markerek segítségével
Az "Arabidopsis Genom Kezdeményezés 2000" eredményeként széles nemzetközi együttműködéssel valósult meg a lúdfű (Arabidopsis thaliana) DNS-ének megszekvenálása (The Arabidopsis Genome Initiative, 2000). A számítógépprogramokkal végzett génpredikció szerint ez a gyomnövény - a növény molekuláris biológiai kutatás Drosophilája - 25 500 gént tartalmaz. Érdekes megfigyelés, hogy a gének többsége két példányban található meg, és mintegy 11 ezer géncsalád ismerhető fel. A genomikai kutatásban az egyszikű gabonafélék modellnövénye a rizs, amelynek mintegy 430 millió nukleotidból épül fel a genomja. Mind az "indica" típusú rizs szekvenálását végző pekingi intézet, mind a "japonica" típusú genomot szekvenáló Syngenta cég kutatói szerint a rizsnek hozzávetőlegesen 50 ezer génje van. (Yu, 2002; Goff, 2002). Az Arabidopsis-gének 36 %-a, a rizsgének 20 %-a esetében lehetett az INTERPRO vagy Gene Ontology programcsomagokkal a kódolt fehérje szerepét megjósolni. Az azonosított géntermékek molekuláris funkciók szerinti megoszlása nagymértékben hasonló a két növény esetében.
A törzsfejődés során, az egy-, illetve kétszikű fajok 200 millió évvel ezelőtti szétválását követően a genomok jelentős átrendeződése következett be. Így viszonylag kismértékű egybeesés (syntheny) figyelhető meg a gének kromoszómális elhelyezkedésében. Ugyanakkor a rizs molekuláris térképe nagyfokú megegyezést mutat a búza-, árpa- vagy kukoricakromoszómák genetikai markereinek elrendeződésével. Az Arabidopsis és a rizs génkészletének hasonlóságában jelentős aszimmetria figyelhető meg. Míg az Arabidopsis-gének 80 %-a tartalmazza a rizsben megtalálható homológ gént, addig a rizsgéneknek csak a fele mutat homológiát valamelyik Arabidopsis-génnel. Növénynemesítési szempontból figyelmet érdemel, hogy közel hatszáz rizsgén kódol betegségrezisztenciát biztosító fehérjét, amely az ún. apoptózis-rezisztencia doménnel rendelkezik. Ezen túl négyszáz ún. R gén mutatható ki a rizsben. A rezisztenciagének termékei leucinban gazdag ismétlődéseket tartalmazó fehérjék. Érdekes adat, hogy számos, a virágzás idejét, illetve a virág fejlődést szabályozó Arabidopsis-gén megfelelője megtalálható a rizs genomjában.
A növényi genomprogramok sikerességét nagymértékben elősegíti, hogy jó néhány gazdasági növényünk (búza, kukorica, árpa, lucerna, borsó, szója) bevonásával folyamatosan bővítik a kutatók és nemesítők a genetikai térképeken elhelyezett markerek körét. A részletes kromoszómatérképek elkészítésekor fenotípusos vagy élettani bélyegek génjei mellett a molekuláris markerek helyzetét is megállapítják. A kapcsoltság mértékét a rekombinációs gyakoriság alapján lehet megbecsülni. A molekuláris markerek széles választéka használható fel a géntérkép megszerkesztéséhez. Így a polimorfizmus a restrikciós enzimmel végzett hasításból származó DNS-fragmentek hosszában (RFLP) vagy specifikus primerekkel történt amplifikációs termékek méretében (AFLP) szolgálhat markerként. A mikroszatellitek sajátos nukleotidkombinációk egymás utáni ismétlődéseiből épülnek fel, és amplifikációjuk jellegzetes DNS-terméket ad a térkép elkészítéséhez. A specifikus DNS-szakaszok amplifikációja a polimeráz láncreakcióval (PCR) valósítható meg. Igen hasznos molekuláris markerek az EST klónok, amelyek ismert szekvenciájú cDNS-ek. A genomszintű molekuláris variabilitás, amely egyedek vagy rendszertani kategóriák azonosítását is lehetővé teszi, jellemezhető egyetlen nukleotidot érintő polimorfizmussal (SNP: single nucleotide polymorphism). A tranziciós (A?G vagy C?T), valamint transzverziós (A/G?C/T vagy C/T?A/G) változások akkor jelentenek polimorfizmust, ha a populáció több egyedének vizsgálatakor kimutathatók. Az SNP markerek jól használhatók rekombinációs térképek készítéséhez, továbbá mennyiségi tulajdonság kialakításában szerepet játszó kromoszómarégiók (Quantitative Trait Loci, QTL) behatárolásához. A növénynemesítő által javítandó tulajdonságok (terméshozam, minőség, tenyészidő, stb.) zöme több gén által befolyásolt mennyiségi bélyeg. Minden molekuláris marker, amely összefüggésbe hozható agronómiai értékű tulajdonságokkal, például betegség-ellenállósággal, szárazságtűréssel, terméskomponensekkel, jelentős megbízhatóságbeli és hatékonyságbeli javulást tesz lehetővé a szelekciós munkában. A fenotípus helyett a közvetlen genetikai alapok értékelhetők a környezeti tényezők zavaró hatásai nélkül. A molekuláris markerekre alapozott nemesítési gyakorlat mindinkább széleskörűen elterjed, hiszen a növények egzaktabb értékelésével a tulajdonságok javítása sikeresebbé válik.
A molekuláris markerekre alapozott genetikai térképeken behatárolható a mutációt szenvedett gének helye is. A térképezésen alapuló génizolálás számos esetben vezetett a gének klónozásához még a komplex genommal rendelkező fajok esetében is, mint a lucerna (Endre, 2002).
A transzgénikus növények nélkülözhetetlenek a gének szerepének kutatásában
Tradicionálisan egy ismeretlen gén szerepét csak közvetett információk alapján tudjuk megjósolni. Ha hiba, mutáció következik be a gén szerkezetében, akkor a megváltozott fenotípusos bélyegek árulkodhatnak a funkcióról. A keresztezésekből származó új génkombinációk is megváltoztathatják a morfológiai, élettani sajátosságokat. Az izolált gének birtokában például cDNS-klónok felhasználásával teljesen új génkutatási stratégiák kidolgozására nyílt lehetőség, amelyek során a vizsgálandó gének működőképes formában visszaépíthetők a gazdanövény genomjába. A génbeépítés műveletét transzformációnak, az in vitro rekombináns DNS módszerekkel megszerkesztett DNS-molekulát transzgénnek, és az új gént hordozó növényt transzgénikus növénynek nevezzük.
Napjainkra szinte minden, gazdaságilag jelentős növény esetében hatékony transzformációs módszerek állnak rendelkezésre. Leggyakrabban a talajbaktérium, az Agrobacterium természetes génátviteli rendszerét kihasználva építenek be géneket a növényekbe. Ez a megközelítés sikeresen alkalmazható mind kétszikű, mind egyszikű fajok génösszetételének megváltoztatására. A parányi aranyszemcsékre rögzített DNS-molekulák belőhetők a sejtekbe, és így biztosítható az idegen gén beépülése. A jelenlegi transzformációs módszerek elsősorban a testi, szomatikus sejtekbe juttatják be a vizsgálandó génkonstrukciókat. Ezért a transzformált sejtekből in vitro tenyészetekben növényeket kell regenerálni, ami gyakran metodikai korlátot is jelenthet. A növények egyedfejlődési sajátosságaiból is fakadóan a differenciált sejtek az osztódások indukciójával átprogramozhatók, kialakíthatók bennük a totipotens állapot, amely embriók vagy hajtáskezdemények kialakulását teszi lehetővé. Így fertilis növények nevelhetők fel a transzformált testi sejtekből (Dudits - Heszky, 2000).
A gének, illetve az általuk kódolt RNS- vagy fehérjemolekulák szerepét lehet tanulmányozni a vizsgálandó DNS-molekulák átmeneti, tranziens kifejeztetésével vagy a genomba integrálódott formában, amikor a beépült transzgén az utódgenerációkra öröklődik. Széleskörűen használt génmanipulációs stratégia, hogy a transzformációs vektor promoterének segítségével megnöveljük a géntermék mennyiségét, és értékeljük a túltermelt fehérje hatásait. A fehérjét kódoló DNS-szakasz származhat a transzformált fajból, de egyaránt lehetőség van virális, bakteriális, nem rokon növényi vagy állati gének kifejeztetésére is. A génműködés felfokozását nagy aktivitású, többnyire folyamatosan működő promoterek felhasználásával lehet biztosítani. A gén eredeti promoterét kicserélve kiválasztott regulátor DNS-szakaszra, megváltoztatható a génkifejeződési mintázat, új vagy több fehérje termeltethető a növények sejtjeiben. A céltudatosan megtervezett géntechnológiai beavatkozások eredményessége sokban függ a promoterkészlet gazdagságától. A génizolálási programok a kívánt cDNS-ek megtalálásán túl külön figyelmet fordítanak a promoterrégió azonosítására és jellemzésére. Minél pontosabban szabályozható a géntermék mennyisége illetve irányítható keletkezésének helye vagy ideje, annál gazdaságosabb a génsebészeti beavatkozás. Ha a nemesítés célja például a búzaszem tápértékének javítása, akkor indokolt endospermium specifikus promoterrel kifejeztetni a beépített gént. Igen nagy jelentősége van a szövet- vagy szervfüggő kifejeződést eredményező promotereknek. Intenzíven kutatják az ún. indukálható promotereket, amely környezeti tényezők megváltozásakor (fagy vagy hőhatás, vízhiány, kórokozók támadása) biztosítják a védekezéshez szükséges fehérjék szintézisét. Míg az ún. első generációs gyomirtó szer vagy kártevőrezisztens transzgénikus fajták többnyire folyamatos kifejeződésű (konstitutív) promotorekkel készültek, addig a jövőbeni termékek fejlesztésekor mérnöki precizitással tervezik meg a génműködés szabályozottságát.
A kívánt promoter megtalálásához, a gének funkciójának tisztázásához elengedhetetlen a génkifejeződés sokoldalú jellemzése. Egyedi génekről szintetizálódó RNS-molekulák mennyiségéről az ún. northern hibridizáció módszerével nyerhetünk adatokat.
A 3. ábrán (Oberschall, 2000) látható, hogy a lucerna aldózreduktáz mRNS szintetizálódik a vízhiány okozta szárazságstressz hatására. Ugyanakkor az Msc27 jelű gén valamennyi vizsgált növényi mintában aktív. A sejtek fiziológiai vagy működési állapotának jellemzéséhez célszerű nagyszámú gén kifejeződési paraméterét ismerni. Az ún. DNS-chip technológia egyetlen vizsgálattal több ezer génről nyújt információt. Az üveg tárgylemezre robot segítségével rögzített ezernyi génpróbához hibridizált és fluoreszcens festékkel megjelölt minta DNS-ek mennyiségét lézer leolvasó határozza meg. A fluoreszcencia-jelek feldolgozása után a komputerprogramok csoportosítják a géneket aszerint, hogy a működésük fokozódott vagy gátlódott a vizsgált sejtekben, szövetekben. A komplex génkifejeződési mintázatok diagnosztizálják a növény funkcionális képességeit.
A transzgénikus technológiák több alternatívát is kínálnak a gének hatástalanításához. Egy gén működésképtelenné válhat, ha idegen DNS-szekvenciák elrontják a funkcionális elemeket. Az ún. inszerciós mutagenezis programok nagyszámú transzgénikus vonalat hoznak létre az Agrobacterium T-DNS-ének beépítésével. A véletlenszerű beépülések szomszédságában található DNS-szakaszok megszekvenálásával megtudható, hogy milyen génben történt a hiba, illetve megállapítható az okozott biokémiai, fiziológiai vagy fejlődési hatás. Ez a rendszer fordítva is működik, ugyanis ha egy ismert szekvenciájú gén szerepét kívánjuk tisztázni, akkor a szekvencia alapján a mutánsgyűjteményből megkérhetők azok az inszerciós vonalak, amelyek esetében az adott génbe történt a beépülés. Az ilyen mutánsgyűjteményeket elsősorban az Arabidopsis-gének funkcionális vizsgálatában használják kiterjedten, de folyamatban van a rizs- vagy lucernamuntáns-parkok előállítása is. A mobilis DNS-elemek, a transzpozonok, szintén eredményesen használhatók a gének szerepének kutatásában és a génizolálási programokban.
A gének elhallgattatásának hatékony eszközét kínálja az ún. antiszensz megközelítés. Ahhoz, hogy valamely növényi gén termékét, a képződő RNS-molekulákat szekvenciaspecifikus enzimek lebontsák, kettős szálú RNS-hibridek keletkezését kell biztosítani. Ilyen molekulaszerkezet kialakulhat úgy, ha a célgént egy újabb példányban, de megfordított formában építjük be a gazdagenomba. Így a transzgénről képződő RNS-molekulák hibridizálhatnak a belső gén termékeivel, ami azok degradációjához vezethet. Ez a géntechnológiai stratégia idegen DNS-szekvenciák felhasználása nélkül is jelentős és specifikus hatásokat tud létrehozni a transzgénikus növényekben. Az ún. interferáló RNS-molekulák megszintetizáltathatók vírusvektorokkal vagy kémiai szintézis után bejuttathatók a növények sejtjeibe. A genomszintű génfunkció-vizsgálatok céljára, kihasználva a génelhallgattatás jelenségét, nagy kapacitású tesztrendszereket fejlesztenek ki.
A géntechnológiával módosított, nemesített (GM) fajták térhódítása
Az 1. ábra már felhívta a figyelmet arra, hogy az évszázadok folyamán a növénynemesítés eredményességét nagymértékben segítette az új genetikai módszerek és tudományos elméletek alkalmazása. Így teljesen indokolt, hogy az utóbbi évtizedek növénybiológiai kutatásait alapjaiban meghatározó géntechnológia szerves részévé váljék a fajtaelőállító munkának. Soha nem látott szellemi és anyagi kapacitásokat fordítottak növényi gének izolálására, transzgénikus genotípusok előállítására. A genomszekvenálások eredményeként még intenzívebbé és hatékonyabbá váltak ezek a programok. Szinte nincs olyan növényi szerv, funkció, amellyel kapcsolatban ne lenne folyamatban génizolálási és transzformációs kísérlet. Természetes és magától érthető, hogy ha a génbeépítés következményeként hasznos, új tulajdonságú növényeket sikerül előállítani, akkor azok növénynemesítési hasznosítását is megkísérlik. A laboratóriumban létrehozott genotípusok első értékelését általában üvegházakban végzik. A javított tulajdonságokat mutató variánsok azután átkerülnek a növénynemesítő tenyészkertjébe, ahol még kiterjedtebb, szigorúbb minősítés történik, akár éveken keresztül is. A fajtabejelentésre érdemes vonalak, törzsek további vizsgálatát az állami fajtaminősítő rendszerben végzik, és külön szabályok alapján vizsgálják a transzgénikus fajtajelölteket. A transzgénikus technológia a növénynemesítés folyamatának kezdeti fázisában jut szerephez, elsősorban új génkombinációt jelentő alapanyagok előállításával.
Két rizsnövény keresztezésekor 50 ezer gén véletlenszerű rekombinációjával jön létre az új genotípusú utód, amely számos nemkívánatos tulajdonságot is örökölhet a szülőktől, ezért éveken át tartó visszakeresztezésekre és szelekciókra van szükség az optimális génkombinációval rendelkező növények megtalálásához. Az in vitro kialakított transzgén beépítésekor egyetlen új genetikai elem kerül be a növény többi génjei közé. Ismert a felhasznált DNS szekvenciája, értékelhetők a kódolt fehérje várható tulajdonságai. A gyakorlatban több száz független transzformációs eseményt analizálnak, és kiválasztják azokat a transzgénikus termékeket, amelyek mellékhatások nélkül hordozzák a kívánt tulajdonságot. A forgalmazható termékké válást szükség esetén széles körű toxikológiai és allergiavizsgálatok is megelőzhetik. A transzgén a gazdanövény genomjába történt integrációja után a mendeli szabályok szerint öröklődik, és ebben nem különbözik a befogadó faj saját génjeitől. A transzgénikus fajták használatával kapcsolatban gyakran megfogalmazódó aggodalom, hogy ezek a genotípusok kereszteződés esetén beszennyezhetik a vadon élő rokon fajok génállományát. Ez fontos ökológiai kérdés, ami azonban korántsem új keletű, hiszen például a lucernába vagy repcébe beépített transzgén mellett több tízezer másik lucerna- vagy repcegén is hasonló valószínűséggel átkerülhet a vad fajokba. Ha évszázadok során nem törődtünk azzal a lehetőséggel, hogy a termesztett növények "nemesítik" majd a természetes populációkat, úgy a transzgénikus fajták használata sem jelent új helyzetet. Nem tapasztaljuk a gyomok nemesedését, inkább ellenkezőleg, elkényeztetett termesztett növényeinknek lenne szükségük a vad rokonfajok génjeire.
A nemzetközi szóhasználatot követve a géntechnológiával nemesített növényeket GMO (genetikailag módosított szervezet) rövidítéssel jelölik. Ez a megkülönböztetés szakmailag félrevezető, hiszen valamennyi termesztett növényünk, és így a belőlük származó élelmiszereink is genetikai módosítások sorozatának szüleményei, és ezért GMO termékek. Genetikai módosításnak kell tekintenünk a keresztezést, mutánsok előállítását vagy akár a poliploidizációt. Így a transzgénikus és a hagyományos fajták egyaránt génmanipulációkból származnak. A GMO megjelölés nem a termék sajátosságait minősíti, hanem a fajta-előállítás során alkalmazott többféle módszer közül egynek a felhasználásáról tájékoztatja a fogyasztót. A géntechnológia mint nemesítési módszer ugyanolyan, ha nem nagyobb biztonsággal kivitelezhető, mint a többi növénygenetikai beavatkozás. Ezt igazolja a csaknem tízéves termesztési tapasztalat: ez idő alatt több mint 230 millió hektáron termesztettek géntechnológiával nemesített növényeket minden egészségügyi vagy ökológiai katasztrófa nélkül.
A 4. ábra (James, 2003) adatai is megerősítik, hogy aligha ismert olyan, a mezőgazdaságot érintő technológiai forradalom, amely hasonló gyorsasággal terjedt volna el a világon. Az előnyök között elsőként említhető az olcsóbb és környezetkímélőbb növénytermesztési technológiák alkalmazhatósága. A betegségeknek és állati kórokozóknak ellenálló fajták termesztése sokban segítheti a biogazdálkodást. A rendelkezésre álló statisztikai adatok szerint a géntechnológiával nemesített, GMO növények révén 14 %-kal csökkent a felhasznált rovarirtó szerek mennyisége. Nagyszámú kutatási eredményre alapozva állítható, hogy a fenntartható fejlődést biztosító mezőgazdasági gyakorlat megvalósításában a géntechnológiával nemesített növények használata meghatározó tényezőként jelenik meg. A DNS szerkezetének megfejtésétől a rekombináns DNS módszerek kidolgozásán át a funkcionális genomika nyújtotta információk felhasználásáig vezető kutató-fejlesztő tevékenység fontos és nélkülözhetetlen eszközöket szolgáltat egy környezet- és egészségbarát növénytermesztés számára.
Köszönetnyilvánítás
A szerző ezúton is kifejezi köszönetét Keczán Józsefné Czakó Zsuzsannának a kézirat elkészítéséhez nyújtott segítségéért.
Kulcsszavak: növényi gének, kifejeződési mintázat, molekuláris markerek, szárazság, betegség, ellenállóság, genetikai módosítás, transzgénikus fajták
 1. ábra * A búzagének manipulálásának módszerei az évszázadok során
1. ábra * A búzagének manipulálásának módszerei az évszázadok során
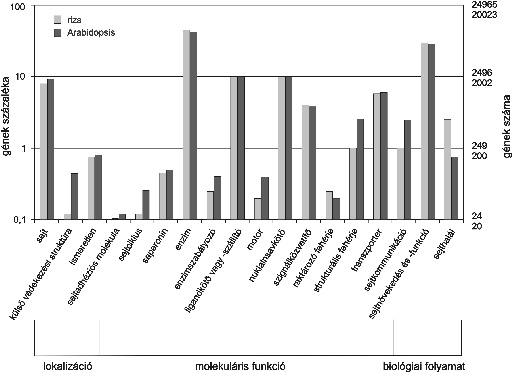 2. ábra * A rizs- és Arabidopsis-gének funkció szerinti osztályozása (Yu et
al., 2002)
2. ábra * A rizs- és Arabidopsis-gének funkció szerinti osztályozása (Yu et
al., 2002)
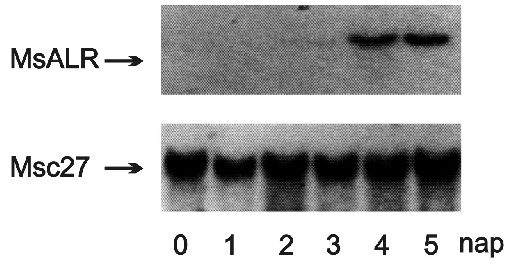 3. ábra * Az aldózreduktáz (MsALR) gén aktiválódása a lucernanövényekben a
szárazságstressz 4-5. napján. Az Msc27 gén mRNS mennyisége konstitutív
génkifejeződést mutat (Oberschall et al., 2000)
3. ábra * Az aldózreduktáz (MsALR) gén aktiválódása a lucernanövényekben a
szárazságstressz 4-5. napján. Az Msc27 gén mRNS mennyisége konstitutív
génkifejeződést mutat (Oberschall et al., 2000)
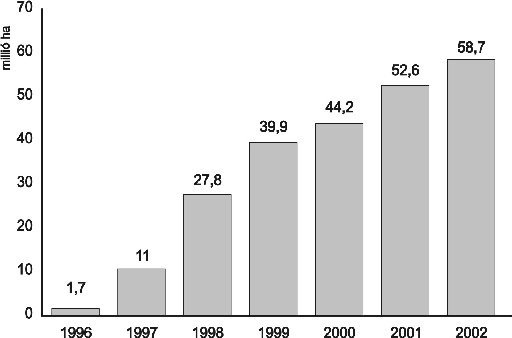 4. ábra * A géntechnológiával nemesített (GM) fajták vetésterületének
folyamatos növekedése (James C.: 2002)
4. ábra * A géntechnológiával nemesített (GM) fajták vetésterületének
folyamatos növekedése (James C.: 2002)
Irodalom
Avery, Oswald T. - MacLeod, Colin M. - McCarty, Maclyn (1944): Studies on the Chemical Nature of the Substance-inducing Transformation of Pneumococcal Types. Induction of Transformation by a Desoxyribonucleic Acid Fraction Isolated from Pneumococcus Type III. The Journal of Experimental Medicine. 79, 137-158.
Dudits Dénes - Heszky László (2000): Növényi biotechnológia és géntechnológia. Agroinform, Budapest, 312. p
Dudits Dénes (2000): Új korszak a növénybiológiában és -nemesítésben. Magyar Tudomány. 5, 537-554.
Endre Gabriella - Kereszt A. - Kevei Z. - Mihacea, S. - Kaló P. - Kiss G. B. (2002): A Receptor Kinase Gene Regulating Symbiotic Nodule Development. Nature. 417, 962-966.
Goff, Stephen A. - Ricke, D. - Lan, T. H. - Presting, G. - Wang, R. - Dunn, M. - Glazebrook, J. - Sessions, A. - Oeller, P. - Varma, H. - Hadley, D. - Hutchison, D. - Martin, C. - Katagiri, F. - Lange, B. M. - Moughamer, T. - Xia, Y. - Budworth, P. - Zhong, J. - Miguel, T. - Paszkowski, U. - Zhang, S. - Colbert, M. - Sun, W. - Chen, L. - Cooper, B. - Park, S. - Wood, T. C. - Mao, L. - Quail, P. - Wing, R. - Dean, R. - Yu, Y. - Zharkikh, A. - Shen, R. - Sahasrabudhe, S. - Thomas, A. - Cannings, R. - Gutin, A. - Pruss, D. - Reid, J. - Tavtigian, S. - Mitchell, J. - Eldredge, G. - Scholl, T. - Miller, R. M. - Bhatnagar, S. - Adey, N. - Rubano, T. - Tusneem, N. - Robinson, R. - Feldhaus, J. - Macalma, T. - Oliphant, A. - Briggs, S. (2002): A Draft Sequence of the Rice Genome (Oryza Sativa L. Ssp. Japonica). Science. 296, 91-100.
James, Clive (2003): Global Hectarage of GM Crops in 2002. Biotech Briefs. Vol 3. No. 1 http://www.isaaa.org/kc/Services/Biotech_briefs/brief_files/kc_brief8.htm
Oberschall Attila - Deák M. - Török K. - Sass L. - Vass I. - Kovács I. - Fehér A. - Dudits D. - Horváth V. G. (2000): A Novel Aldose/Aldehyde Reductase Protects Transgenic Plants Against Lipid Peroxidation under Chemical and Drought Stresses. The Plant Journal. 24, 437-446.
The Arabidopsis Genome Initiative (2000): Analysis of the Genome Sequence of the Flowering Plant Arabidopsis Thaliana. Nature. 408, 796-815.
Watson, James D. - Crick, Francis H. C. (1953): A Structure for Deoxyribose Nucleic Acid. Nature. 171, 737-738.
Yu, Jun - Hu, S. - Wang, J. - Wong, G. K. S. - Li, S. - Liu, B. - Deng Y. - Dai, L. - Zhou, Y. - Zhang, X. - Cao, M. - Liu, J. - Sun, J. - Tang J. - Chen, Y. - Tong, W. - Cong, L. - Geng, J. - Han, Y. - Li, L. - Li, W. - Hu, G. - Huang, X. - Li, W. - Li, J. - Liu, Z. - Li, L. - Liu, J. - Li, L. - Li, T. - Wang, X. - Lu, H. - Wu, T. - Zhu, M. - Ni, P. - Han, H. - Dong, W. - Ren, X. - Feng, X. - Cui, P. - Li, X. - Wang, H. - Xu, X. - ZHai, W. - Xu, Z. - Zhang, J. - He, S. - Zhang, J. - Xu, J. - Zhang, K. - Zheng, X. - Dong, J. - Zeng, W. - Tao, L. - Ye, J. - Tan J. - Ren, X. - Chen, X. - He, J. - Liu, D. - Tian, W. - Tian, C. - Xia, H. - Bao, Q. - Li, G. - Gao, H. - Cao, T. - Wang, J. - Zhao, W. - Li, P. - Chen, W. - Wang, X. - Zhang, Y. - Hu, J. - Wang, J. - Liu, S. - Yang, J. - Zhang, G. - Xiong, Y. - Li, Z. - Mao, L. - Zhou, C. - Zhu, Z. - Chen, R. - Hao, B. - Zheng, W. - Chen, S. - Guo, W. - Li, G. - Liu, S. - Tao, M. - Wang, J. - Zhu, L. - Yuan, L. - Yang, H. (2002): A Draft Sequence of the Rice Genome (Oryza sativa L. Ssp. Indica). Science. 296, 79-91.