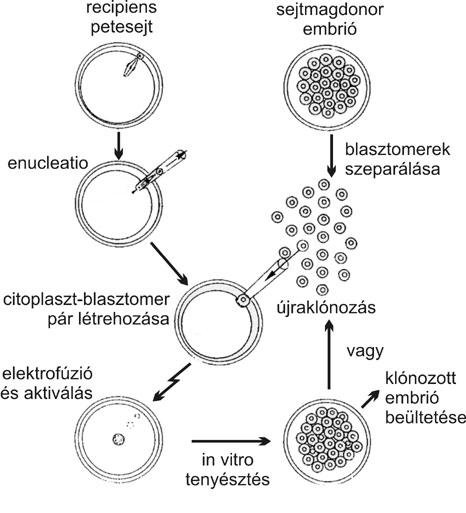
 1. ábra * Klónozás totipotens embrionális sejtek beültetésével
1. ábra * Klónozás totipotens embrionális sejtek beültetésével
Alig hat éve, 1997-ben valóságos bombaként robbant a hírügynökségek gyorsjelentése, amelyet azután a Nature folyóiratban megjelent cikk is megerősített, hogy a skóciai Roslin Intézet kutatóinak először sikerült testi sejtek klónozásával életképes juh utódot előállítaniuk. A Dolly névre keresztelt bárány azonnal világhírű lett, és fogantatásának körülményeit - a klónozás rejtelmeiről azelőtt sohasem hallott emberek is - megtanulták, kissé bizony tanácstalanul állva a nagy viták közepette, amit ez az ártatlan bárány kavart. Az etikai és biológiai viták nemrégiben újból fellángoltak, miután a világon legtöbbet fotózott nőnemű lénynek tartott Dollyt, előrehaladott ízületi és tüdőbántalmai miatt, hat és fél éves korában véglegesen el kellett altatni.
Vajon mi tette ezt az állatot életében és holtában egyaránt "fekete báránnyá" a közvélemény szemében? Miért tartotta szükségesnek mindenki az eljárást elítélni és betiltását követelni, vagy éppenséggel üdvözölni és folytatását remélni? Természetesen nem az állattenyésztés forradalmian új módszere váltott ki ilyen heves reakciókat, bár abban nagyjából egyetértés van, hogy Ian Wilmut és munkacsoportjának felfedezése tudományos szempontból mérföldkőnek számított. Sokkal inkább az a vízió keltett óriási hullámokat, amit az ember klónozásának elvi lehetősége jelentett, és ezt a félelmet csak tovább erősítették az időről időre felröppent (többnyire ellenőrizetlen) bejelentések a humán klónozási kísérletekről. Amikor pedig az elmúlt év végén egy (az ufóhívő raeliánus szektához tartozó és az emberiség eredetét a klónozásra visszavezető) vállalkozás, a Clonaid vezetője az első klónozott emberi csecsemő megszületéséről számolt be, amit hamarosan két további gyermekről szóló bejelentés követett, a társadalmi és tudományos testületek sorra fogalmazták meg tiltakozásukat vagy elutasító álláspontjukat. Noha a klónbébik létezésére mindmáig nincs hitelt érdemlő bizonyíték, az ismét bebizonyosodott, hogy a népszerűséget hajszoló és felelőtlen kutatók - a média szenzációéhségével párosulva - olyan mérvű társadalmi ellenállást gerjeszthetnek, ami hosszú időre megbénítja a kutatást. Nemrégiben a Magyar Tudományos Akadémia több illetékes bizottsága is foglalkozott a kérdéssel, ám (a megosztott közvéleményhez hasonlóan) az egyes szakbizottságok véleménye között jelentős különbség van. Az érzelemmentes, objektív megítélés kedvéért vizsgáljuk meg közelebbről a klónozás történetét, lehetőségeit és kilátásait.
Gordon R. Taylor Biológiai pokolgép című bestsellerében már több mint harminc évvel ezelőtt fölvillantotta azokat az óriási, de egyben félelmetes lehetőségeket, amelyet a genetika rohamos fejlődése ígért az ezredvég számára. A klónozást illetően jövendölése elég pontosnak bizonyult, hiszen számos állatot (és az sem kizárható, hogy az embert) már lehet klónozni. A harmincas évek hírhedt eugenikai programja; vagy a férfiak nélküli világ, amelyet Robert Merle a Védett férfiak-ban festett le érzékletesen; a diktátorok megsokszorozásának veszélyei; a Jurassic Park klónozással rekonstruált őslényei; a biológiai halhatatlanság kilátása Dollyval mind kicsit közelebb kerültek a valósághoz. Ez megzavarta és kissé meg is riasztotta a közvéleményt. Közben elfeledkezünk arról, hogy a növényvilágban a klónozást évszázadok óta használjuk, a "férfiak nélküli"-höz kissé hasonló világ - a mesterséges termékenyítés - az állattenyésztésben immár ötven éve nélkülözhetetlen, és ma már embernél is széles körben alkalmazzák. A korai embriók mikrosebészeti darabolásával pedig tizenöt éve rutinszerűen állítanak elő állati klónokat, és még a sejtmagátültetés viszonylag új módszere is évtizedes múltra tekinthet vissza.
Dolly a biológia régi dogmáját döntötte meg, születésével ugyanis bebizonyosodott, hogy az emlősök testi sejtjei is alkalmasak arra, hogy belőlük megfelelő módszerrel teljes élőlényt regeneráljanak. Korábban azt hittük, hogy az embrionális fejlődés kezdeti szakaszán túljutva (ahol a sejtek még totipotensek, tehát bármivé differenciálódhatnak) egyes gének visszafordíthatatlanul károsodnak, vagy legalábbis véglegesen kikapcsolódnak. Dolly példája megcáfolta ezt a hiedelmet, őt ugyanis egy hatéves anyajuh emlőhám-sejtjének egy petesejtbe való klónozásával hozták létre. Ha pedig egyik emlősnél sikerült, ugyan miért ne lehetne a többinél, akár az embernél is? És valóban, hamarosan szarvasmarhát, sertést és egeret is klónoztak.
A klónozás rövid története és formái
Klónoknak nevezzük az ugyanazon őstől ivartalanul előállított, genetikailag azonos utódpopulációt, amely az orvostudomány, a genetika, a gyógyszerkutatás és az állattenyésztés számára egyaránt értékes. Az ivartalan szaporítás e formája a növénytermesztésben már régen megvalósult, de az állattenyésztésben még kísérleti szakaszban van. Klónozással olyan homológ állatpopulációk hozhatók létre, amelyeken belül az örökletes teljesítmény- és viselkedési különbség minimális. Az állatok klónozásától várt előnyök: genetikailag identikus, azonos ivarú állatok létrehozása, valamint az ivadékvizsgálaton már előzetesen átesett és kedvező eredményeket mutató vérvonalak gyors elszaporításának lehetősége. Tervszerű alkalmazásával a genetikai bázis beszűkülésének veszélye is elkerülhető, és lehetővé teszi veszélyeztetett állatfajok vagy fajták megmentését (a közelmúltban születtek meg két, vadon élő és a kihalástól fenyegetett állatfajtól: a gaurtól és a bantengtől az első klónozott utódok).
A klónozás legegyszerűbb formája az embriódarabolás, ami lehetővé teszi egy embrióból két (vagy több) identikus utód születését. Az eljárás lényegében a természetben sem ritka egypetéjű ikrek keletkezési körülményeit utánozza. Meg kell jegyezni, hogy genetikai szempontból csakis a darabolt embriókból származó utódok teljesen azonosak, azaz valódi klónok. Mégis, az általános szóhasználat (helytelenül) a sejtmagátültetéssel előállított utódokat nevezi klónoknak, holott azok genetikailag valamelyest eltérnek a kiindulási sejttől.
Modellállatokon (egér, patkány és nyúl) végzett előkísérletek után, 1979-ben sikerült első ízben Cambridge-ben Steen Willadsennek és munkatársainak darabolt juhembriók átültetésével - amelyeket a darabolás és a beültetés közötti néhány nap során átmenetileg juh-petevezetőben tároltak - monozigóta ikreket előállítaniuk. A technikát ugyanők, illetve más kutatók a későbbiekben szarvasmarhánál valamint sertésen és lovon is eredménnyel megismételték. Kezdetben az embrió külső burkát, a zona pellucidát mikrosebészeti úton eltávolították, majd az így szabaddá tett sejteket (blasztomereket) mechanikusan kettő- vagy négyfelé vágva, a szétválasztott blasztomereket a fogadó állat zona pellucidájába fecskendezték. Ezt követően az embriókat kis agarhengerbe ágyazva, lekötött juh-petevezetőben tartották mindaddig, amíg azok az átültethetésre alkalmas szedercsíra (morula) vagy hólyagcsíra (blasztociszta) stádiumig fejlődtek. Ezeket az embriókat pár nap múlva sebészi úton visszanyerve, a végleges recipiensekbe ültették. A módszer fejlődésével a köztes recipienseket elhagyva, a felezett embriókat néhány órás in vitro tenyésztés után rögtön a végleges recipiensbe ültették át. Szarvasmarha, juh, sertés, ló, nyúl és egér esetében sikerült embriófelezéssel, néhány esetben három- vagy négyfelé vágással, élő ikreket előállítani. A beavatkozás mindössze 10-15 percet vesz igénybe, és ma már rutineljárásnak számít.
Amennyiben a megfelezett embriókat differenciálódás nélkül életben lehetne tartani addig, amíg néhány osztódás után ismét felezhetőek lesznek, azzal megvalósulna a klónozás legegyszerűbb formája. Az embrionális sejtek differenciálódása azonban elsősorban nem a sejtek számától, hanem az életkoruktól függ. Ezért, bár az embriók mikrosebészeti darabolása egyszerű és hatékony, de az előállított utódok számát illetően igen korlátozott eljárás.
Sokkal ígéretesebb eljárásnak tűnt a sejtmagátültetés, amely a nagy értékű állatok tömeges előállításának elméletileg leghatékonyabb klónozási formája. Amióta a harmincas években Hans Spemann kétéltűeken végzett magátültetési kísérleteket, majd később a sejtmagátültetés sikerült békaembriókon (Briggs - King, 1952), azóta felmerült ennek a lehetősége a haszonállatok esetében is. Az utóbbi két évtizedben egyre nőtt az érdeklődés az állatok sejtmagátültetéssel történő klónozása iránt. Az eljárás során az embrionális stádiumban lévő sejtmagot olyan zigótába vagy petesejtbe injektálják, amelynek saját sejtmagját előzőleg eltávolították.
A sejtmagátültetés elvi alapját az a felismerés képezi, hogy a korai fejlődés során az embrionális sejtek toti- vagy pluripotensek, azaz sejtmagjuk tartalmazza a teljes élőlény kifejlődéséhez szükséges összes genetikai információt. Ha tehát az elszaporítani kívánt többsejtes embrió egyes sejtjeit különválasztva, azokat saját magjuktól megfosztott (enukleált) petesejtek citoplazmájába ültetik át, ezáltal új embriók fejlődése indukálható. Az így előállított valamennyi utódembrió genomja ugyanabból a sejtből származik, ezáltal - bár a recipiens petesejtek mitokondriumaiban található kismennyiségű DNS miatt valamelyest különbözhetnek - genetikailag majdnem azonos. A klónozott embriók későbbi fejlődésük során maguk is felhasználhatók (második generációs) sejtmagdonorként, vagyis a folyamat elméletileg a végtelenségig ismételhető (1. ábra).
A nyolcvanas évek elején kimutatták, hogy az egérzigóta pronucleusai kicserélhetők kétsejtes egérembrió-sejtmagokkal, és ebből utód nyerhető, de a nyolcsejtes embriók magja zigótába ültetve már nem, csak kétsejtes embrióba ültetve fejlődött tovább. Később az is kiderült, hogy az oocyta jobb sejtmagrecipiens a zigótánál. A differenciálódott sejteket sejtmagdonorként már használhatatlannak tartották, amelyek átültetéséből utód nem születik. A pluripotens embrioblaszt (ICM) sejtek azonban sejtmagdonornak még alkalmasnak bizonyultak, amelyek jó eredménnyel ültethetők enukleált recipiens petesejtbe. Az is bizonyítást nyert, hogy a juhmorula sejtjei totipotensek. Minthogy csak toti- vagy legalábbis még pluripotens sejtek magvát vélték átültethetőnek, több állatfajnál (szarvasmarha, nyúl) igazolták, hogy a későbbi fejlődési stádiumú embriók embrioblaszt sejtjei is pluripotensek, és felhasználhatók sejtmagdonorként. További fontos állomás volt a klónozás területén, amikor az élő állatokból nyert oocytákat in vitro érlelt petesejtekkel váltották föl. Ez, valamint a nyúl mint a klónozási kísérletek modellállata nagymértékben hozzájárult az elviselhetetlen kutatási költségek redukálásához.
A kilencvenes években néhány kutatócsoport már beszámolt ilyen, sejtmagátültetés útján született borjakról. A pluripotens embriósejtek klónozásával elért kezdeti eredmények jogos reményt ébresztettek, hogy nagy genetikai értékű egyedek sejtmagvainak értéktelen recipiensek petesejtjeibe ültetésével tömegesen lesznek előállíthatók a legkiválóbb tulajdonságokat hordozó utódok.
A szarvasmarhán embrionális sejtekkel végzett eredményes sejtmagátültetési kísérletek azonban számos újabb problémát hoztak felszínre. A klónozott utódok között ugyanis - feltételezések szerint a tápfolyadék nem megfelelő összetétele és az elégtelen in vitro tenyésztési feltételek miatt - jelentősen megemelkedett a túlzottan nagy méretű magzatok előfordulási aránya. Az eljárásból született utódok mintegy 30 %-ánál a születési súly a szokásosnak a kétszeresét is elérheti, ami komplikációkhoz vezet. Ugyancsak megemelkedik a klónozott borjaknál a tüdő- és ízületi bántalmak gyakorisága. Bár sejtmagátültetéssel sikerült már nyúl-, juh- és szarvasmarhautódokat előállítani, de a módszer jelenlegi hatékonysága alig haladja meg az 1 %-ot, ráadásul nagyon munka- és költségigényes.
Mindezek miatt a több generációban és korlátlan számban előállítható identikus állatoknak szóló kezdeti eufóriát először egy józanabb, tartózkodó hozzáállás, később pedig kifejezett ellenkezés váltotta föl. Egyrészt, mert a klónozás optimális technikai paraméterei mindmáig nem tisztázottak, ezért az eljárás hatásfoka csekély, és az eredmény nehezen reprodukálható. Másrészt az ismételt klónozás a túlélési arány olyan drasztikus csökkenéséhez vezet, ami miatt a harmadik generáció után értelmetlenné válik a módszer további alkalmazása.
A későbbi, szomatikus sejtekkel végzett klónozási kísérletek technikailag mindössze annyiban tértek el az embrionális sejtekkel végzett sejtmagátültetéstől, hogy differenciálódott testi sejtekkel végezték (2. ábra). Pedig a közvéleményt látszólag meglepő eredmények nem voltak teljesen előzmény nélküliek, hiszen évtizedek óta folytak sikertelen próbálkozások felnőtt állatokból nyert testi sejtek klónozására. A skót kutatók egy évvel korábban maguk is beszámoltak arról, hogy nyugalmi stádiumú embriósejtek használatával birkában sikerült élő utódot előállítaniuk.
Az embriósejtekkel végzett klónozásnál döntő jelentőségű a citoplazma és a beültetett mag sejtciklusának szinkronitása. Tapasztalatok szerint a mitózis G1 vagy S fázisában lévő sejtmagot azonos fázisú citoplazmába klónozva érhető el a legjobb eredmény, ezért többen megkísérelték a donor embriók kémiai kezelésével szinkronizálni a sejtciklust, változó sikerrel. A mitózis során a sejt két részre osztódása előtt három fázison (G1, S és G2) megy keresztül. A sejtciklus G1 fázisban indul, az utána következő S fázisban a kromoszómák megkettőződnek, hogy majd az osztódással keletkező leánysejtek is ugyanannyi örökítő anyagot tartalmazzanak, mint a kiindulási sejt. Az S és G2 fázisú sejtben tehát átmenetileg a szükséges DNS-mennyiség kétszerese van. S vagy G2 fázisú sejteket klónozva a mitózis kezdeténél tartó petesejtbe, a rendszernek elméletileg működnie kellene, hiszen a petesejt készen áll az osztódásra, az S vagy G2 fázisú sejtmag pedig biztosítja a szükséges (kétszeres mennyiségű) DNS-t. Valamilyen okból azonban a sejtek fúziója után több DNS termelődik a szükségesnél, ami sérült kromoszómák keletkezéséhez, majd a klónozott sejt pusztulásához vezet. Ez okozta a testi sejtek klónozásának korábbi eredménytelenségét.
Wilmut és munkatársai más módszerhez folyamodtak. Ahelyett, hogy a mitózisos sejtciklus valamely aktív fázisában lévő donorsejtet alkalmaztak volna, nyugalmi stádiumú sejtekkel dolgoztak. Nyugalmi állapot közvetlenül osztódás után természetes körülmények között is előfordul, de ők - bizonyos tápanyagok (magzati szérum) öt napig tartó megvonásával - mesterségesen indukálták. Az "éheztetés" eredményeként a sejtek növekedése megállt, és a sejtciklusból kilépve nyugalmi (G0) állapotba kerültek. Az így nyugalmi állapotba kényszerített donorsejtek nemcsak normális mennyiségű (2n) DNS-tartalmuk miatt, hanem egyéb tekintetben (a sejtciklus során felhalmozódó fehérjék) is jobban összhangban állnak a petesejttel, mint az aktív növekedésű sejtek. A diploid G0 sejtek beültetése a metafázis-II. stádiumú petesejtbe jelentősen csökkentette a kromoszóma-rendellenességek kockázatát.
A skót kutatócsoport sikerének másik lehetséges magyarázata a G0 sejtek kromatinállománya és a petesejt újraprogramozó anyagainak (transzkripciós faktorok és kromatinkötő fehérjék) kölcsönhatása. A juhembrió ugyanis nyolc-tizenhat sejtes stádiumig csak a petesejt citoplazmájában fölhalmozott RNS-készletet használja, az embrionális DNS átírása (transzkripciója) majd ezt követően kezdődik. Így klónozás után juhnál legalább két sejtciklus áll rendelkezésre ahhoz, hogy a petesejt citoplazmája a beültetett idősebb sejtmagot újraprogramozza. Nem minden fajnál van ez így, egérnél például az embrionális transzkripció rögtön az első, embernél pedig a második sejtosztódás után bekövetkezik. Emiatt aztán sokáig valószínűtlennek tűnt, hogy a juhnál eredményesnek bizonyult módszer egérre vagy emberre is átvihető lesz. Sőt, a Clonaid által bejelentett sikeres humán klónozás hitelességét kétségbe vonva ma is sokan azt állítják, hogy főemlősöket és embert a jelenleg ismert technikákkal egyáltalán nem lehet klónozni. Ugyanakkor a Clonaid változatlanul ragaszkodik korábbi bejelentéséhez, miszerint a 2002 vége és 2003 eleje között született öt klónozott csecsemő él és egészségesen fejlődik, csak az érintett családok nyugalma érdekében tartják távol őket a nyilvánosságtól.
Velük ellentétesen vélekedik a bostoni székhelyű Whiteland Intézet kutatója, Rudolf Jaenisch, aki a Science szerkesztőségi cikkében a Dollyt klónozó Ian Wilmut-tal közös nyilatkozatot tett közzé. Állásfoglalásuk szerint a mai klónozási technika mellett a sejtmag hibás újraprogramozódásának kockázata nagy. Ez pedig a mintegy 30.000 gén bármelyikénél rendellenes génkifejeződéssel, majd torz magzatok születésével járhat, ami miatt az ember reproduktív célú klónozása veszélyes és felelőtlen vállalkozás. Ezzel szemben a terápiás célú klónozással összekapcsolt génterápiát, amelynek célja genetikailag módosított és klónozással fölszaporított őssejtek bejuttatása a betegek szervezetébe, ígéretesnek tartják. Az eljárás a genetikai rendellenességek mintegy személyre szabott génterápiával történő gyógyításával kecsegtet, ami Jaenisch immunhiányos egereken végzett kísérleteiben részben sikerült.
A testi sejtek klónozása 1996-ban tehát óriási tudományos teljesítmény volt, de - mint a fenti ellentmondásos helyzet mutatja - még ma sem aggálymentes. Hiszen a szomatikus sejtek beültetésével előállított 277 fúzionált sejtpár-konstrukcióból csupán egyetlen utód - Dolly - született, és őt is idő előtt el kellett altatni. Mégis fordulópontnak számított a biológiában annak bizonyításával, hogy igenis lehetséges felnőtt emlősök szomatikus sejtjeit klónozni. Emellett a génátültetés számára is új távlatokat nyitott azáltal, hogy elektroporációval módosított génállományú őssejtek klónozásával transzgenikus állatok állíthatók elő a korábbinál nagyobb hatékonysággal. Hamarosan, az első klónozással létrehozott transzgenikus juh, Polly születése után kiderült, hogy a klónozási kísérletek valójában nem elsősorban az identikus utódpopulációk, sokkal inkább a génmódosított (GM) állatok eddiginél hatékonyabb előállítására irányultak. A transzgenikus állatok ugyanis a gyógyszeripar, az orvostudomány és a mezőgazdaság számára beláthatatlan távlatokat (és természetesen óriási profitot) ígértek.
Transzgenezis
A GM állatok iránti növekvő igény ellenére, az előállításukra szolgáló eljárások legtöbbje vagy túl gyenge hatásfokú, vagy rendszeres használatuk költséges és bonyolult. A néhány éve publikált és nagyon ígéretes spermium-mediált génbevitel (Marialuisa Lavitrano és munkatársai) használhatósága mindmáig nem bizonyított, sokak által egyenesen megkérdőjelezett eljárás. Retrovírusok is átvihetik a gazdasejtek génjeit más egyedek sejtjeibe (transzdukció), ám ennek hatásfoka sem kielégítő, akárcsak a transzfekciónak, ahol a Ca-foszfáttal kezelt DNS beépül a kromoszómába. Elsősorban sejt-tenyészeteknél alkalmazható az elektroporáció, amelynek során egyenáramú térbe helyezett sejtek fölvehetik a DNS-t. Még a rendelkezésre álló legelterjedtebb eljárás, a DNS mikroinjektálás hatékonysága sem kielégítő, ráadásul az eredménye véletlenszerű és bizonytalan. Az alacsony hatásfok következtében egyetlen GM állat előállítása egérnél 120 USD-be kerül, de ez az összeg sertésnél 25 ezer USD-re, tehénnél pedig már 546 ezer USD-re növekszik. Az eljárás gyenge hatásfokára jellemző, hogy szarvasmarhánál 36 500 injektált zigótából 2300 érte el a beültethető blasztociszta stádiumot, amelyek beültetéséből mindössze tizennyolc transzgenikus utód született. Nos, ennek a mikroinjektálásnak a kiváltására indultak meg (a gyógyszeripar anyagi támogatásával) azok a klónozási kísérletek, amelyek Dolly születéséhez vezettek. A transzgenikus állatok klónozással történő előállítását mutatja vázlatosan a 3. ábra. A klónozás transzgenikus (transzfektált vagy elektroporált) donor sejtekkel és jelző- (például antibiotikum-rezisztencia) génekkel a többi eljárásnál lényegesen jobb hatékonyságú, és a klónozás előtti szelektálás révén megbízhatóbb eredményű.
Különböző szülőktől nyert teljes vagy félembriók összeolvadása olyan egyedek születéséhez vezethet, amelyek sejtjei kettőnél több szülőtől származnak. Ezeket az élőlényeket a görög mitológiából átvett néven kiméráknak hívjuk. Megkülönböztetünk fajkimérákat (például juh-kecske kiméra) és fajtakimérákat (például holstein fríz-magyartarka kiméra). Mindkét változat létrehozása sikerült már mikromanipuláció segítségével. Kimérák kísérleti úton embriók, illetve embriófelek közös zona pellucidába helyezésével (aggregációs kimérák), vagy másik embrióból kivett sejtcsoportok blasztocisztába történő injektálásával (injekciós kimérák) készíthetők. A szakirodalomban számos közlemény található szarvasmarha-, juh-, nyúl-, kecske- és egérkimérák születéséről. A kimérakészítésnek kezdetben túlnyomórészt tudományos jelentősége volt, elsősorban a fejlődésbiológiai, immunbiológiai és állattenyésztési kutatások szempontjából. Mivel az ivarsejtek vagy az egyik, vagy a másik sejtvonal genetikai anyagát tartalmazzák, a kimérák tehát kiméraként nem tenyészthetők tovább, mindig újat kell készíteni.
Érdekes az ún. kimérikus klónozás, amelyből eddig monozigóta ötösikreket sikerült előállítani juhon. Az eljárás azt a megfigyelést hasznosítja, hogy idősebb embrió szétszedett blasztomerjeit fiatalabb embrióba ültetve, az embrioblaszt (más néven ICM) sejtjei és ezáltal a születendő utódok mindig az idősebb embrió sejtjeiből fejlődnek ki. A kimérakészítés transzgenikus állatok előállítására is alkalmazható, mivel génmódosított sejteket fiatalabb embrióba ültetve, azok korai fejlődését a fiatalabb embrió támogatja, miközben az utód génállományához önmaga nem járul hozzá.
A génmódosított állatok ipari hasznosítására érdekes a pókháló-fehérje gént hordozó transzgenikus kecskék példája: az állatok teje 3-5 g/l mennyiségben tartalmazza a rekombináns proteint, amelyet az acélnál tízszer erősebb hajlítószilárdsága és erőssége miatt Biosteel néven űrtechnikai és ipari célokra alkalmaznak, de sebzárásra és vérzéscsillapításra is jó.
A mezőgazdaság számára is számos alkalmazási terület mutatkozik: ígéretes (bár Európában egyelőre tiltólistán szerepel), hogy a növekedési hormon génkonstrukciót (hMT-pGH) hordozó transzgenikus sertések gyorsabb növekedésűek, takarmányértékesítésük jobb, és hús/zsír arányuk is kedvezőbb. A bevitt transzgén működése Zn-etetéssel szabályozható. Ugyancsak érdekes, hogy a keratin-IGF-I génkonstrukció juhoknál 6 %-kal magasabb gyapjúhozamot eredményezett. A magyar kutatók által egérbe és nyúlba bejuttatott k-kazein génkonstrukciót Ausztráliában legújabban tehénbe is bevitték, ami a sajtgyártás szempontjából kedvezőbb összetételű tej termelését teszi lehetővé a tejipar számára. Jövőbe mutató törekvés, hogy a juhok szaporaságában szerepet játszó Booroola-gént vagy az ugyancsak szapora kínai Meishan sertésfajta azonosított és izolált génjeit más fajtákba beépítve azok szaporodási mutatói lényegesen javíthatók.
Az embrióklónozási és génátültetési kísérletekhez egyaránt nagy segítséget jelenthet a totipotens őssejtvonalak (embrionális stemsejtek vagy ES-sejtek) alkalmazása. Az őssejtek két legfontosabb tulajdonsága, hogy sejttenyészetben korlátlan ideig változatlanul életben tarthatók, de totipotenciájuknál fogva megfelelő körülmények között bármilyen sejtté képesek differenciálódni. Mindezidáig csak egérnél sikerült valódi totipotens őssejtvonalakat nyerni, bár pluripotens sejtvonalakat már több fajnál, egyebek közt szarvasmarhából is izoláltak. 7-9 napos szarvasmarha-blasztociszták embrioblaszt (ICM) sejtjeit rakták enukleált oocytákba, majd a beültetett ES-sejtet az oocyta citoplazmájával fúzionáltatták, a sejtet in vitro tenyésztették morula-blasztociszta stádiumig, végül beültették szinkronizált tehenekbe. Az eljárás vemhességet eredményezett, ami arra utal, hogy a szarvasmarha-hólyagcsíra egyes sejtjei legalábbis pluripotensek, és enukleált petesejtekbe átültetve normális embrionális és magzati fejlődést eredményeznek. Egy másik munkacsoport immunsebészeti úton izolált és tenyészetben differenciálatlanul fenntartott "őssejtszerű" sejtvonalat használt sejtmagátültetési kísérletekben, és vemhességet ért el.
Az őssejtekkel végzett kísérletek felbecsülhetetlen jelentőségűek a gyógyászat számára, hiszen egyre több bizonyíték van arra, hogy a csontvelőből vagy magzati köldökzsinórvérből is nyerhetők pluripotens sejtek. Ezek a sejtek betegekbe fecskendezve a vérkeringés útján a szívbe, a hasnyálmirigybe és az agyba jutnak, majd ott differenciálódva képesek pótolni a beteg hiányzó szívizom-, inzulin-termelő béta- vagy éppen neuronsejtjeit. Ezért is keltett meglepetést, amikor nemrégiben Magyarországon leállították az újszülöttek köldökzsinórvéréből nyerhető őssejtek tárolását, amelyek pedig sok későbbi betegségnél bevethetők volnának.
A humán gyógyászat számára azonban minden bizonnyal azoknak a génmódosított állatoknak van legnagyobb jelentőségük, amelyeket szervátültetésnél lehet donorként fölhasználni. Mivel a modern gépkocsik passzív és aktív biztonsága jelentősen megnőtt, szerencsére mind kevesebb a balesetben elhunyt beteg, ezáltal azonban egyre kevesebb beültethető szerv áll az orvoslás rendelkezésére. A probléma súlyosságát jelzi az a felmérés, amely szerint az USA-ban 1999-ben 4 ezer átültethető szívre lett volna szükség, amelynek csak a fele állt rendelkezésre, és ezért 767 várólistás betegnek meg kellett halnia. Veséből 42 ezerre volt szükség, de csak 12 ezer állt rendelkezésre, és 2300 várólistás halt meg. Ugyanebben az évben
3 300 átültethető tüdő helyett csak 850 állt rendelkezésre, ami miatt 486 várólistás beteg hunyt el. A listákra tizenhat percenként kerül új név, és naponta tizenegy embernek kell meghalnia azért, mert hiányzik az átültethető szerv. Az ezzel kapcsolatos kórházi költségeket évi 40-60 milliárd US dollárra becsülik.
Ekkora igényt kizárólag állati szervek felhasználásával lehet kielégíteni (xenotranszplantáció), ami óriási piacot jelent, becslések szerint a xenograft forgalom 2010-ben teljes szervekből 6 milliárd USD, sejtekből és szövetekből 4 milliárd USD nagyságú lesz. Az állati eredetű szervek termelésére ma legalkalmasabbnak látszó faj a sertés, mivel testtömege és élettani sajátosságai alapján közel áll az emberhez. Az idegen szerveket azonban beültetés után a szervezet kilöki. Miután megállapították, hogy a sertésből származó szervek azonnali kilökődéséért egy cukor a felelős, ezért a kutatások olyan génmódosított sertések előállítására összpontosultak, amelyeknél az a-1,3-galaktoziltranszferáz gént törölték, ezáltal a belőlük átültetett szerveket a befogadó ember szervezete nem löki ki magából. A kísérletek biztató eredményeket hoztak, ami előrevetíti, hogy hamarosan rászoruló emberek ezreinek életét lehet megmenteni sertés eredetű szervek beültetésével.
A transzgenikus állatok további hasznosítási formája olyan bioreaktor állatok előállítása, amelyek a tejükben tiszta formában, aránylag magas (35 g/l) koncentrációban képesek idegen fehérjék termelésére. Az első, ún. founder állatokból visszakeresztezéssel homozigóta vonalak állíthatók elő, és ezek az állatok gyógyászatilag fontos alapanyagokat termelnek a gyógyszeripar számára. Már a klinikai kipróbálás fázisába jutottak a humán antitrombin III (ATIII), az a1-antitripszin, a szöveti plazminogén aktivátor (tPA), az a-glukozidáz, a laktoferrin és a VIII. véralvadási faktor (hFVIII) és a humán szérum albumin (hSA). Biztató kísérletek folynak az eritropoetin (hEPO) termeltetésére, ami azonban még nem expresszálódott a tejben, és más problémákkal is terhelt.
Tiltás, tűrés vagy támogatás?
A sikeres klónozási kísérletek azonnal számos újabb kérdést vetettek föl, például miként alkalmazható a módszer más emlősöknél? Vajon hogyan öregszik az az újszülött, amelynek valamennyi sejtje egy idős állat sejtjéből származik? Dolly kromoszómáinál a teloméreket rövidebbnek találták, ami - ha bebizonyosodik - a születéstől számított életkornál előbbi öregedés jele lehet. Összeférnek-e a petesejt mitokondriális génjei a beültetett sejt génjeivel? Ott vannak továbbá azok a súlyos etikai aggályok, amelyek az ember potenciális klónozásával vagy egyáltalán a természet rendjébe való beavatkozásokkal kapcsolatban merülnek föl.
Kívánatos és elfogadható-e annak gondolata, hogy kiválasztott zsenik, a hatalmi elit tagjai vagy esetleg diktátorok megsokszorozására használják föl a klónozás technikáját? Vajon kedvünkre rendelhetjük-e meg születendő gyermekünk nemét (egyes országok ezt már lehetővé tették), esetleg külső és belső tulajdonságait? Fölvállalható-e bármilyen orvosi indokkal a klónozással vagy génmódosítással ma még szükségszerűen együtt járó fokozott kockázat? A válasz ezekre a kérdésekre többnyire nemleges, de hogyan ellenőrizhetők a technikai felszerelés szempontjából nem túl bonyolult eljárások? Megállítható-e a tudomány fejlődése csupán azért, mert egy zseniális felfedezést valahol, valakik rossz célok szolgálatába állíthatnak? Olyan dilemmák ezek, amelyekre bizony nem könnyű válaszolni. Az atomenergia felhasználásának fél évszázados történetére gondolva ma is ellentmondásos helyzetet tapasztalunk. De az orvostudomány területén eleinte ugyanilyen botrányosnak minősült a mesterséges termékenyítés, a szívátültetés vagy a lombikbébik előállítása is, amelyek hatásfoka idővel javult, és mára szinte észrevétlenül bevonultak a mindennapi gyakorlatba. Mindezeket figyelembe véve, nem célszerű dogmatikus tiltással vagy kritikátlan helyesléssel reagálni, hanem a várható előnyök és kockázatok alapos elemzése után, inkább rugalmas törvényi szabályozással tanácsos az eljárást megfelelő mederbe terelni.
Az ember szaporodási célú klónozását a törvényhozás egyelőre - túl nagy kockázata miatt - valószínűleg nem fogja megengedni, legalábbis szigorú korlátok közé szorítja. A kérdésről alkotott vélemény kialakítása előtt azonban érdemes végiggondolni, hogy a sejtmagátültetéssel létrehozott klónoknak már a genetikai anyaga sem teljesen azonos, hiszen azt a befogadó petesejt mitokondriális génjei némileg módosítják. Az is közismert, hogy a természetes (valóban azonos genetikai anyagú) egypetéjű ikrek között is van különbség, ami lényegesen nagyobb az egymástól eltérő környezetben nevelkedő klónozott utódok és sejtmagdonor "szüleik" között. Másfelől az élet során a sejtek genetikai anyagában olyan mutációk keletkezhetnek, ami miatt a klónozásra fölhasznált testi sejtek többé már nem tekinthetők az anyai genom pontos másolatának. Végül azt sem szabad elfelejteni, hogy a klónozás segítségével létrehozott GM állatok vagy az őssejtkutatások talán nem is olyan távoli jövőben számos beteg gyógyulásához, esetleg életének megmentéséhez járulhatnak hozzá, amit a terápiás célú klónozás vagy a génmódosítás merev elutasítása veszélyeztethet.
Kulcsszavak: klónozás, sejtmagátültetés, embriódarabolás, génmódosítás, etikai aggályok, szervátültetés, génterápia, őssejtek
IRODALOM
Briggs, Robert - King, Thomas J. (1952): Transplantation of Living Nuclei from Blastula Cells into Enucleated Frogs' Eggs. Proceedings of the National Academy of Sciences of the USA. 38, 455-463
Hill, Jonathan R. - Roussel, A. J. - Cibelli, J. B. - Edward, J. F. - Hooper, N. L. - Miller, M. W. - Thompson, J. A. - Looney, C. R. - Westhusin, M. E. - Robl, J. M. - Stice, S. L. (1999): Clinical and Pathologic Features of Cloned Transgenic Calves and Fetuses (13 Case Studies). Theriogenology. 51, 8, 1451-1465
Lavitrano, Marialuisa - Camaioni, A. - Fazio, V. M. - Dolci, S. - Farace, M. G. - Spadafora, C. (1989): Sperm Cells as Vectors for Introducing Foreign DNA into Eggs: Genetic Transformation of Mice. Cell. 57, 717-723
Ono, Yukiko - Shimozawa, N. - Ito, M. - Kono, T. (2001): Cloned Mice from Fetal Fibroblast Cells Arrested at Metaphase by a Serial Nuclear Transfer. Biology of Reproduction. 64, 44-50
Schnieke, Angelika E. - Kind, A. J. - Ritchie, W. A. - Mycock, K. - Scott, A. R. - Ritchie, M. - Wilmut, I. - Colman, A. - Campbell, K. H. S. (1997): Human Factor IX Transgenic Sheep Produced by Transfer of Nuclei from Transfected Fetal Fibroblast. Science. 278 (5346), 2130-2133
Solti László - Crichton, E. G. - Loskutoff, N. M. - Cseh S. (2000): Economical and Ecological Importance of Indigenous Livestock and the Application of Assised Reproduction to their Preservation. Theriogenology. 53, 149-162
Spemann, Hans (1938): Embryonic Induction. Hafner, New York
Wilmut, Ian - Schnieke, A. E. - McWhir, J. - Kind, A. J. - Campbell, K. H. S. (1997): Viable Offspring Derived from Fetal and Adult Mammalian Cells. Nature. 385, 810-813
Willadsen, Steen (1986): Nuclear Transplantation in Sheep Embryos. Nature. 320, 63-65
Willadsen, Steen (1979): A Method for Culture of Micromanipulated Sheep Embryos and Its Use to Produce Monozygotic Twins. Nature. 227, 298
 1. ábra * Klónozás totipotens embrionális sejtek beültetésével
1. ábra * Klónozás totipotens embrionális sejtek beültetésével
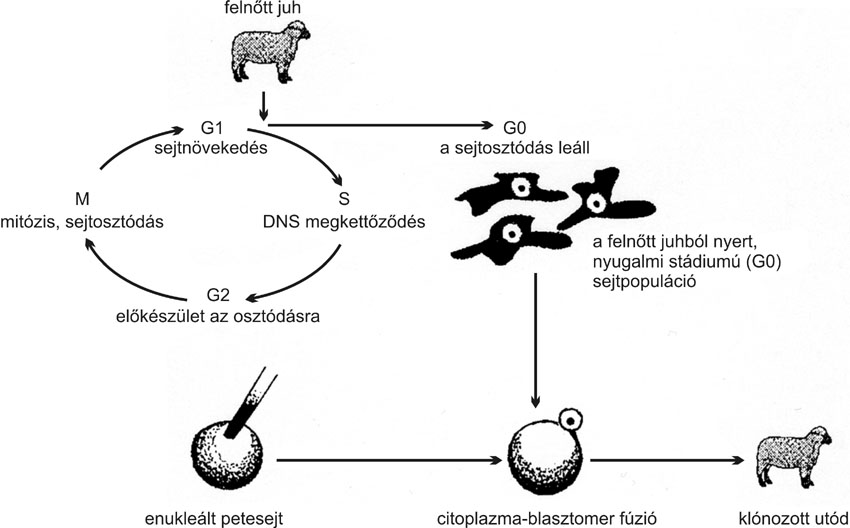 2. ábra * Nyugalmi állapotú szomatikus sejtekkel történő klónozás
2. ábra * Nyugalmi állapotú szomatikus sejtekkel történő klónozás
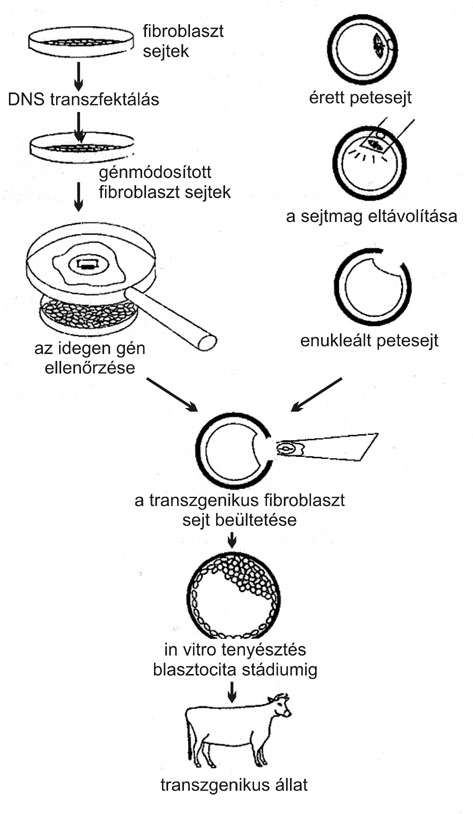 3. ábra. * Transzgenikus állat létrehozása génmódosított sejttel történő
klónozás segítségével
3. ábra. * Transzgenikus állat létrehozása génmódosított sejttel történő
klónozás segítségével