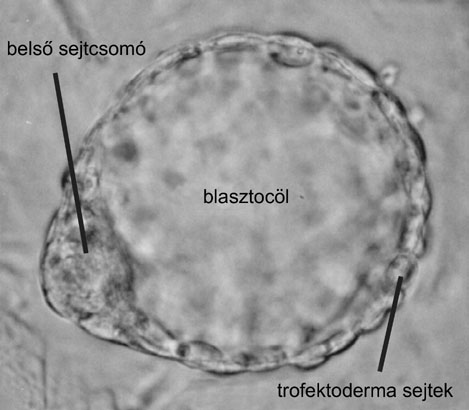
 1. ábra * Hólyagcsíra (blasztula) állapotban levő egérembrió
1. ábra * Hólyagcsíra (blasztula) állapotban levő egérembrió
Bevezetés
Az embrionális őssejt-vonalak az embrióban található pluripotens sejtpopulációból származnak. Az embrionális őssejtek fontos sajátossága, hogy megfelelő tenyésztési körülmények között folyamatosan osztódnak, és az osztódások során is megtartják pluripotenciájukat, önmegújuló képességüket. Másik jellemző tulajdonságuk az, hogy ha az optimális tenyésztési feltételek megváltoznak, a sejtek differenciálódni kezdenek, és a legkülönbözőbb specializálódott sejttípusok képződnek belőlük.
Az embrionális eredetű őssejteket (ES sejtek) az embriológiai, sejtbiológiai kutatások számos területén alkalmazzák. Az ES sejteket az embrionális környezetbe visszajuttatva kiméra egereket lehet létrehozni, amelyek minden szövetében megtalálhatók lesznek az ES sejtek utódsejtjei, még az ivarsejtek között is, így az ES sejteken végzett genetikai módosítások az ivarsejteken keresztül az utód nemzedékekbe is átadódhatnak. Genetikailag módosított, transzgénikus ES sejtek segítségével lehetségessé vált számos, az önmegújulásban, sejt-sejt kölcsönhatásban, sejt-elköteleződésben és a differenciálódásban szerepet játszó gén működésének megértése.
ES sejtvonalakat nemcsak egér, hanem más állatfajok embrióiból kiindulva is létre lehet hozni. Humán embrióból kiindulva is sikerült pluripotens sejtvonalakat alapítani. A humán ES sejtekkel végzett kutatások nagy lendületet adtak az ES sejteket in vitro vizsgáló kísérleti technológiák fejlődésének. A humán ES sejtekkel folytatott kutatások mára egyre jelentősebbé váló iránya, az ES sejtek in vitro differenciálódási képességének tanulmányozása lett. Az in vitro differenciálódás során lejátszódó folyamatokat megismerve, feltérképezve az ES sejtek nélkülözhetetlen eszközzé válhatnak a gyógyszerkutatásokban, illetve a sejttranszplantációs kísérletekben.
Pluripotens őssejt-vonalak típusai
A hólyagcsíra (blasztula) állapotú embrióban már két eltérő fejlődési képességgel rendelkező sejttípus található (1. ábra): a belső sejtcsomó sejtjei (Inner Cell Mass - ICM) illetve a trofektoderma sejtek.
Az ICM sejtjeit pluripotensnek tekintjük, belőlük az embriót kialakító csíralemezek (ektoderma, endoderma és mezoderma) mindegyike kialakulhat. A trofektoderma sejtek korlátozott fejlődési képességgel rendelkeznek, ezekből a sejtekből csak a külső magzatburkok és a méhlepényt alkotó sejtek jöhetnek létre. Az embrióban található pluripotens sejtek osztódásának eredményeként hozzájuk hasonló pluripotens őssejtek, illetve bizonyos fejlődési irányba már elkötelezett sejtek: a szöveti őssejtek alakulnak ki. A szöveti őssejteket multipotensnek tekintik, mivel ezek nem képesek csírasejtek vagy más néven ivarsejtek (petesejtek és hímivarsejtek) kialakítására.
Az első pluripotens őssejt-vonalak létrehozásához az egér teratokarcinómákkal végzett kutatások vezettek. A teratokarcinómák olyan tumorok, amelyek az ivarmirigyekben keletkeznek, számos differenciálódott szövettípust lehet azonosítani bennük, de megtalálható ezeken a tumorokon belül egy nem-differenciálódott sejtpopuláció is. Ezekből a pluripotens sejtekből lehetett az úgynevezett embrionális karcinóma-vonalakat (Embryonal Carcinoma - EC) létrehozni (Robertson, 1987). Az EC sejteket hólyagcsíra állapotú embrió belsejébe juttatva kiméra embriók és magzatok hozhatók létre. A kimérákban az EC eredetű sejtek minden szövetben, szövetféleségben megtalálhatók voltak. Az ES sejtek in vitro differenciáltatása során megfigyelhető változások megfeleltethetőek voltak az in vivo fejlődés során zajló differenciálódási lépéseknek, így az ES sejtek jó modellrendszerként szolgáltak a korai embrionális fejlődés folyamatának tanulmányozására. Az EC sejtek alkalmazásának azonban határt szabott az, hogy az EC sejtvonalak sejtjei gyakran tartalmaztak kromoszómarendellenességeket.
Pluripotens sejtvonalakat hólyagcsíra állapotú embrióból kiindulva is létre lehet hozni. Gail Martin, illetve Martin Evans egymástól függetlenül, 1981-ben új pluripotens sejtvonaltípus létrehozásáról számolt be (Martin et al., 1981; Evans et al., 1981). Az eredmény olyan diploid embrionális eredetű sejtvonal (Embryonic Stem Cell - ESC, ES sejt) (2. ábra) lett, aminek sejtjeiből a felnőtt szervezet mindenféle szövet- és sejttípusa kialakulhatott, még ivarsejtek is létrejöhettek ES sejtekből kiindulva.
1992-ben Brigitte Hogan és kollégái az ősivarsejtekkel (csírasejtek; Primordial Germ Cell - PGC) végzett kísérletek eredményeként arról tudósítottak, hogy közvetlenül ezekből a sejtekből kiindulva is létre lehet hozni az ES sejtvonalakhoz hasonló fejlődési képességgel rendelkező sejtvonalakat: ezek az úgynevezett ősivarsejt eredetű sejtvonalak (Embryonic Germ - EG). Ezeknek a sejteknek a differenciálódási képessége sok tekintetben megegyezett az ES sejtekével, azonban számos, az imprinting által érintett gén expressziójának mértéke eltért a normális szinttől (Matsui et al., 1992).
Az ES sejtek tenyésztési paramétereinek módosításával sikerült az ES sejtekből kiindulva egy újabb pluripotens sejtpopulációt kialakítani. Az így alapított sejtvonalakat primitív ektodermaszerű sejtvonalnak (Early Primitive Ectoderm Like - EPL) nevezték el (Rathjen et al., 1999). Az EPL sejtek génexpressziós mintázata, valamint az in vitro és in vivo differenciálódási képessége alapján, az EPL sejtek primitív ektoderma sejtekre jellemző tulajdonságokat mutatnak. Az ES és EPL sejtvonalak összehasonlító vizsgálata lehetőséget teremt azoknak a géneknek a tanulmányozására, amelyek szerepet játszanak az ICM sejtek primitív ektoderma sejtekké történő alakulásában.
Még egy igen érdekes embrionális eredetű sejtvonalat szeretnék bemutatni. Az ún. trofoblaszt eredetű sejtvonalak (Trophoblast Stem - TS) a trofektoderma sejtekből hozhatók létre (3. ábra).
A TS sejtek, az ES sejtekhez hasonlóan, képesek bekapcsolódni a magzati fejlődés menetébe, ha hólyagcsíra állapotú embrióba injektálják azokat. A TS sejtek azonban már elkötelezett sejtek, és a trofoblaszt sejtek differenciálódási mintázatának megfelelően differenciálódnak, így a belőlük származó sejtek a méhlepény kialakításában vesznek részt, nem képesek a magzat embrionális szöveteinek kialakítására (Tanaka et al., 1998).
Az ES sejtvonalak jellemzői
Néhány kutató úgy gondolja, hogy olyan formában, ahogy a sejttenyészetben megismertük az ES sejteket, azok nem fordulnak elő magában az embrióban. Az ES sejtek sok mindenben hasonlítanak az embrióban előforduló pluripotens sejtekre, de mégsem azonosak azokkal (Smith et al., 2001).
Más elméletek szerint maga az embrió is tartalmaz őssejteket. Ezeknek a sejteknek az osztódása az, amely azután minden felnőtt szöveti sejtet létrehoz. Ezek az őssejtek izolálhatók, felszaporíthatók, és ezekből megfelelő tenyésztési feltételek mellett folyamatosan osztódó sejteket tartalmazó sejtvonalakat lehet létrehozni. Ma még nem ismerjük részleteiben azt, hogy valóban mi is történik a sejtvonal alapítása folyamán az embrióban található pluripotens sejtekkel, azonban ahhoz, hogy egy ES sejtvonalat valóban pluripotensnek tekinthessünk, számos, jól meghatározott feltételnek kell megfelelniük a sejtvonalaknak. Az 1. táblázatban foglaltam össze azokat az ismérveket, amelyek alapján eldönthető, hogy valóban pluripotens ES sejtvonallal rendelkezünk-e.
ES sejtek in vivo differenciálódási képessége
Ha az ES sejteket immundeficiens, scid egerek bőre alá vagy vesetokjába juttatják, a beinjektált sejtek olyan teratoma tumorokat hoznak létre, amelyekben mindhárom embrionális csíralemezből származó differenciálódott sejtek megtalálhatóak lesznek.
Ha azonban az ES sejteket gazdaembrióba injektálják vagy nyolcsejtes gazdaembrióval aggregáltatják, az ES sejtek beépülnek gazdaembrió embriócsomójába. Az embrionális környezetbe visszakerülve, a valóban pluripotens ES sejtek differenciálódni kezdenek, s a normális embrionális fejlődés folyamatába bekapcsolódva a legkülönbözőbb sejtféleségekké alakulnak. Az ES sejtvonalból származó sejtek a megszülető ES kiméra állat minden szövetféleségében megtalálhatók lesznek, így az ivarsejtek között is.
Tetraploid gazdaembriók alkalmazásával lehetett igazolni, hogy az ES sejtek képesek kialakítani a magzat minden embrionális eredetű szövetét, és életképes, sejtvonal eredetű utódokat lehet létrehozni. Mivel a tetraploid embriókban az extraembrionális részek normálisan fejlődnek, de a magzat embrionális részei nem alakulnak ki, az embrió elpusztul. Megfigyelték, hogy tetraploid és diploid embriókból összeállított kiméra embriókban főleg a diploid sejtek vettek részt a magzat kialakításában. ES sejteket alkalmazva, a magzat embrionális részében az ES sejtek domináltak, és olyan életképes utódok születettek, amelyek minden sejtje sejtvonal eredetű volt, a tetraploid embrióból származó extraembrionális szövetek jelenléte csak segítette a normális embrionális fejlődést (Nagy et al., 1991).
Transzgénikus ES sejtvonalak létrehozása, alkalmazási lehetőségei
Az ES sejtek azon képessége, hogy fertilis ivarsejtekké tudnak alakulni, új lehetőségeket tárt fel az egér molekuláris genetikában. Az ivarsejt kimérák ES eredetű ivarsejtjein keresztül a genetikai módosítások az utód nemzedékekbe is átjutnak, így a genetikai változtatás hatásának megfigyelése generációkon át is lehetségessé válik.
A genetikai módosítás során alkalmazott DNS-vektorokat a legtöbb esetben elektroporáció segítségével juttatják be az ES sejtekbe. Az elektroporációt követően az ES sejtek milliói veszik fel egy időben a DNS-t. Ha a DNS-vektor szelekciós markert is tartalmaz, akkor szelekciós médiumot alkalmazva csak azok a sejtek maradnak életben, amelyekbe az exogén DNS beépült. A transzformált ES sejtek nem vesztik el pluripotenciájukat, továbbra is képesek a legkülönbözőbb sejttípusokká differenciálódni, s a legtöbb esetben a kiméra állatok ivarsejtjei között is meg lehet találni azokat, így a transzgént örökítik az utód nemzedékre is (Joyner et al., 2002). A transzgénikus egerek létrehozása olyan hasznos modellrendszert ad a kezünkbe, amelynek segítségével fontos gének, illetve a génműködést szabályozó, reguláló elemek működése is megismerhetővé válik.
ES sejtek in vitro differenciáltatása
Az ES sejtek differenciálódását több módon is indukálni lehet. Általában a letapadást elősegítő anyagokkal kezelt felszínű tenyésztőedény megakadályozza az ES sejtek spontán differenciálódását. Nem kezelt felszínű tenyésztőedényben, szuszpenzióban; vagy függőcseppekben tartva az ES sejteket, azok kis aggregátumokká, EB csomókká állnak össze. Ezekben az aggregátumokban kialakuló sejt-sejt közötti kölcsönhatások révén a sejtek indukálódnak, és az indukció eredményeként differenciálódni kezdenek (Rohwedel et al., 1994).
Növekedési faktorokat juttatva a tenyésztő médiumba, speciális gének aktiválódnak a sejteken belül, ami speciális irányú in vitro differenciálódás kezdetét jelentheti. Megpróbálkoztak azzal is, hogy transzgéneket bejuttatva az ES sejtekbe, célzott irányú differenciálódást indukáljanak. Megfelelő konstrukciókat találva a transzgén expresszióját térben és időben pontosan lehetne szabályozni.
Néhány biztató eredményről már beszámoltak a kutatók. ES sejtekből kiindulva sikerült differenciálódott, a szervezetben is megtalálható sejtekkel azonos módon működő sejteket létrehozniuk. Az ES sejtek in vitro képesek dopamint és szerotonint termelő idegsejtekké, szívizommá, a vérerek hámsejtjeivé (endotel sejtekké), a hasnyálmirigy inzulint szekretáló sejtjeivé differenciálódni.
Néhány hónapja Karin Hübner és munkatársai (Hübner et al., 2003) megdöbbentő eredményt tettek közzé, amellyel azt bizonyították, hogy az ES sejtek nem pluripotensnek, hanem totipotenseknek tekinthetők. Azért tartották az ES sejteket "csak" pluripotensnek, mert azokból az embrió extraembrionális részei már nem alakulhattak ki. Hübner csoportja azonban kidolgozott egy olyan in vitro differenciáltatási módszert, amelynek segítségével az egér ES sejtek in vitro képesek oogóniummá fejlődni, és belépve a meiózis folyamatába, a hozzájuk kapcsolódó sejtek segítségével follikulus (tüsző)-szerű struktúrákat alkotnak. Megfigyeltek zona pellucidával körülvett petesejteket és blasztulaszerű képződményeket is (megtermékenyülés nélkül, partenogenezissel képződő embriók), amik már ICM és trofektoderma-szerű struktúrákat is tartalmaztak. Ezzel igazolták, hogy az ES sejtek képesek trofektoderma sejtek létrehozására is.
Gerincesek embrióiból származó pluripotens őssejtvonalak
Az egér embrionális eredetű őssejt-vonalakhoz hasonló ES sejtvonalak alapításáról több emlős faj esetében is beszámoltak. Hörcsög-, szarvasmarha-, amerikai nyérc-, majomembrióból kiindulva is sikerült ES jellegű sejtvonalakat alapítani. Az így létrehozott sejtvonalak sejtjei lassan osztódtak, rövid időn belül differenciálódni kezdtek, így nem voltak alkalmasak transzgénikus sejtvonalak, így transzgénikus állatok létrehozására sem.
Patkány-, nyúl- és sertésembrióból kiindulva ugyan sikerült olyan ES sejtvonalat létrehozni, amelynek sejtjeit gazdaembrióba injektálva ES kiméra állatokat kaptak, azonban az így megszületett kiméra állatok közül egyik sem volt ivarsejt kiméra. Hal- illetve tyúkembrióból kiindulva sikerült valóban pluripotens, ivarsejt kiméra képzésére is alkalmas sejtvonalakat létrehozni, ezek gyakorlati alkalmazása azonban még várat magára.
1995-ben James Thomson csoportjának sikerült rhesusmajom (Macaca mulatta) és selyemmajom (Callithrix jacchus)-embrióból kiindulva ES sejtvonalat létrehoznia. Ezek a sejtvonalak diploidok voltak, széles differenciálódási képességgel rendelkeztek, mindhárom embrionális csíralemez sejtjeit képesek voltak létrehozni.
Humán embriókból származó pluripotens őssejt-vonalak
James Thomson és munkatársai 1998-ban számoltak be arról, hogy sikerült létrehozniuk humán ES sejtvonalakat olyan fel nem használt hólyagcsíra állapotú embriókból, amelyeket az in vitro megtermékenyítést követően nem ültettek vissza, hanem kutatási célokra adományoztak. A humán ES sejtvonal létrehozásának módja az egér ES sejtek esetében alkalmazottakhoz nagyon hasonlított, de a létrejött ES sejtvonalak a majom ES sejtvonalakra jellemző fenotípussal és sejtfelszíni markerekkel rendelkeztek (Thomson et al., 1998). Michael Shamblott és kollégái 1998-ban pluripotens EG sejtvonalat hoztak létre abortált öt-kilenchetes magzatok ivarmirigyeiben található ősivarsejtekből (Shamblot et al.) (4. ábra).
Mind a humán ES, mind a humán EG sejtvonalak megtartják normál kariotípusukat. Telomeráz aktivitást mutatnak, ami azt jelzi, hogy ezek immortalizált sejtvonalak. Humán ES sejtvonalakat hosszú ideje sikeresen tartanak fenn sejttenyészetekben, széles in vitro differenciálódási képességgel rendelkeznek, míg a humán EG sejtvonalak sejtjei lassabban osztódnak, nehezen differenciáltathatók in vitro, fejlődési képességük behatárolt, így inkább a humán ES sejtvonalaknak alkalmazása terjedt el.
Humán embrionális ES sejtek fontos szerepet játszhatnak majd a szövetpótlás területén, illetve hasznos eszközt jelenthetnek a korai embrionális fejlődés tanulmányozásában is. A humán ES sejtek (HES) sok mindenben hasonlítanak az egér ES sejtekre (MES). Ma már, az egér sejtvonalakhoz hasonlóan, jó hatékonysággal tudnak új humán ES sejtvonalakat létrehozni, bár a MES sejtek pluripotenciájának megőrzését eltérő növekedési faktorok alkalmazásával érik el. A MES sejtek azonban sokkal gyorsabban osztódnak, mint a HES sejtek. Sikerült lenti-vírussal, különböző traszformáló ágensekkel és homológ rekombinációval is transzgénikus humán ES sejtvonalakat létrehozni (Zwaka et al., 2003), de a módszerek hatékonysága ma még nem éri el a kívánt szintet.
Nagy kérdés, hogy a közeljövőben számíthatunk-e arra, hogy in vitro differenciáltatással olyan jól szabályozott körülményeket tudnak létrehozni, ami lehetővé teszi azt, hogy ES sejtekből kiindulva csak az adott sejttípust tartalmazó szövetek alakuljanak ki, illetve, hogy az indukált sejtek differenciálódása térben és időben annyira rendezett módon történjen, hogy működő szerveket hozhassanak létre in vitro.
Az őssejtkutatók általában egyetértenek abban, hogy az ES sejtek legfőbb alkalmazási területe az orvosi kutatásokban nem feltétlenül a sejttranszplantációs kísérletekben lesz, hanem inkább a célzott mutációkat tartalmazó HES sejtek tanulmányozása fog előtérbe kerülni. Az ES sejtek célzott irányú in vitro differenciálódása során tanulmányozhatóvá válik a genetikai mutációk okozta betegségek létrejöttének, illetve gyógyításának mechanizmusa (Brivanlou et al., 2003). Mivel a HES célzott genetikai módosítása még nem működik jó hatékonysággal, új HES sejtvonalakat kellene alapítani rákos, cukorbeteg, autoimmun betegségben szenvedő, allergiás, Parkinson-kóros betegek szöveteiből. Ezeket az újonnan alapított HES sejtvonalakat lehetne aztán alkalmazni az adott betegségek tanulmányozására, illetve az ezeket a betegségeket gyógyító hatóanyagok tesztelésére. Ezek az új sejtvonalak azonban csak terápiás célú klónozást alkalmazva jöhetnének létre. A terápiás klónozás alkalmazásának szükségszerűsége azonban még a kutatók körében is igen vitatott, mivel számtalan etikai problémát vet fel.
Bár jelenleg a humán ES sejtek in vitro és in vivo differenciálódási képességét vizsgáló kutatások támogatása került előtérbe, fontos cél, hogy egy napon sikerülhessen egy olyan módszer kidolgozása, amellyel lehetővé válik a humán sejtek átprogramozása anélkül, hogy humán embriókat kelljen elpusztítani. Ehhez mind a szöveti őssejtek fejlődési potenciáljának felderítését célzó kutatásokat, mind a nem humán embrionális sejtekkel végzett vizsgálatokat támogatni kell.
Kulcsszavak: pluripotens sejtvonalak, őssejtek, kiméra embrió, transzgénikus állatok, in vitro differenciálódás
 1. ábra * Hólyagcsíra (blasztula) állapotban levő egérembrió
1. ábra * Hólyagcsíra (blasztula) állapotban levő egérembrió
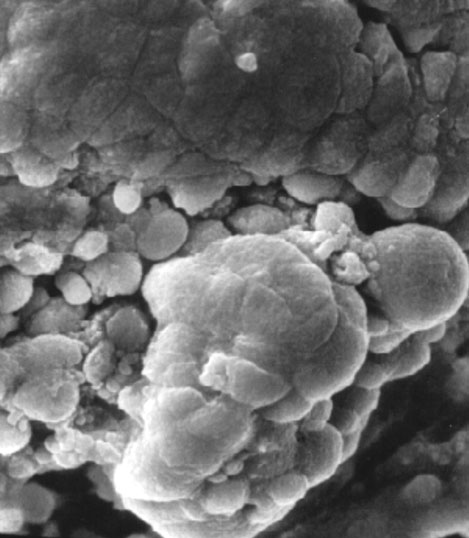 2. ábra * Egér ES sejtkolónia elektronmikroszkópos képe.
2. ábra * Egér ES sejtkolónia elektronmikroszkópos képe.
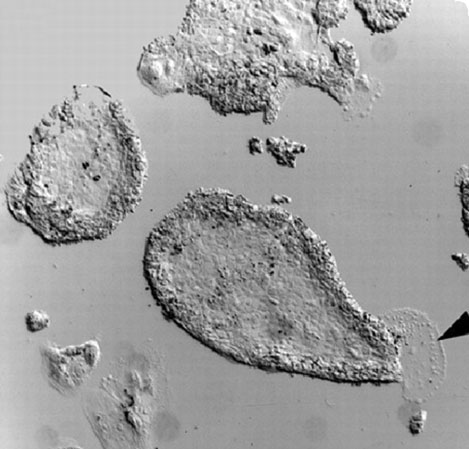 3. ábra * Egér TS-sejt kolóniák
3. ábra * Egér TS-sejt kolóniák
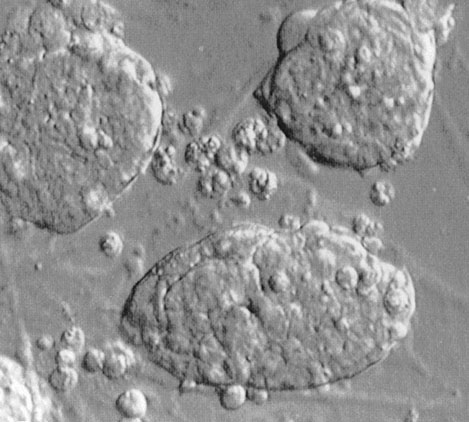 4. ábra * Humán EG-sejt kolóniák
4. ábra * Humán EG-sejt kolóniák
1. táblázat * Pluripotens embrionális őssejt-vonalakat jellemző sajátságok összefoglalása
* Hólyagcsíra állapotú embrió embriócsomójából származnak.
* Képesek folyamatosan osztódni anélkül, hogy differenciálódnának.
* Stabil, diploid kromoszómakészlettel rendelkeznek.
* Mindhárom csíralemez sejtje létrejöhet belőlük in vitro differenciálódás során.
* Képesek beépülni hólyagcsíra állapotú embrió embriócsomójába, ott tovább osztódnak, differenciálódnak, bekapcsolódnak az embrionális fejlődés mentébe. Kiméra embriót, kiméra állatot képesek létrehozni.
* Utódsejtjei képesek bekerülni a kiméra állat ivarsejtjei közé is, beépülve a csírasejt-vonalba hím, illetve női ivarsejteket képesek létrehozni.
* "Klónozható", ami ebben az estben azt jelenti, hogy egyetlen ES sejtből kiindulva létre lehet hozni genetikailag azonos sejtek halmazát, újabb ES sejttenyészeteket.
* Oct-4 transzkripciós faktor jelenléte mutatható ki a pluripotens sejtekben.
* Külső faktorok hozzáadásával befolyásolni lehet az ES sejtek osztódását, és indukálni lehet differenciálódásukat is.
* Az ES sejtek nagyrészt a sejtciklus S fázisában tartózkodnak, nem szükséges külön külső inicializáció ahhoz, hogy a DNS replikációja megtörténjen a sejtekben.
* Az ES sejtekben nem figyelhető meg X-kromoszóma inaktiváció.
IRODALOM:
Bradley, Allan - Evans, M. J. - Kaufman, M. H. - Robertson, E. (1984): Formation of Germ-Line Chimaeras from Embryo-Derived Teratocarcinoma Cell Lines. Nature. 309, 255-256
Brivanlou, Ali H. - Gage, F. H. - Jaenisch, R. - Jessell, T. - Melton, D. - Janet Rossant (2003): Setting Standards for Human Embryonic Stem Cells. Science. 300, 913-916
Capecchi Mario R. (1989): Altering the Genome by Homologous Recombination. Science. 244, 1288-1292
Evans, Martin J. - Kaufman, M. H. (1981): Establishment in Culture of Pluripotential Cells from Mouse Embryos. Nature 292, 154-156
Hübner, Karin - Fuhrmann, G. - Christenson, L. K. - Kehler, J. - Reinbold, R. - De La Fuente R. - Wood, J. - Strauss, J.F. 3rd, Boiani, M. - Scholer, H.R. (2003): Derivation of Oocytes from Mouse Embryonic Stem Cells. Science 300, 1251-1256
Joyner, Alexandra L. (1991): Gene Targeting and Gene Trap Screens Using Embryonic Stem Cells: New Approaches to Mammalian Development. Bioessays. 13, 12, 649-656
Martin, Gail R. (1981): Isolation of a Pluripotent Cell Line from Early Mouse Embryos Cultured in Medium Conditioned by Teratocarcinoma Stem Cells. Proceedings of the National Academy of Sciences of the USA. 78, 7634-7638
Matsui, Y. - Zsebo Krisztina - Hogan, Brigid L. M. (1992): Derivation of Pluripotential Embryonic Stem Cells from Murine Primordial Germ Cells in Culture. Cell. 70/5, 841-7
Nagy András - Gócza E. - Merentes, D. E. - Prideaux, V. R. - Iványi E. - Markkula, M. - Rossant, J. (1990): Embryonic Stem Cells Alone Are Able to Support Fetal Development in the Mouse. Development. 110, 815-821
Rathjen, Joy - Lake, J.A. - Bettess, M.D. - Washington, J. M. - Chapman, G. - Rathjen, P.D. (1999): Formation of a Primitive Ectoderm Like Cell Population, EPL Cells, from ES Cells in Response to Biologically Derived Factors. Journal of Cell Sci. 112, 601-612
Robertson, Elizabeth J. (1987): Embryo-Derived Stem Cell Lines in Teratocarcinomas And Embryonic Stem Cells a Practical Approach. IRL Press, Oxford, 108-112
Rohwedel, Jürgen - Maltsev, V. - Rober, E. - Arnold, H. - Hescheler, J. - Wobus, A. (1994): Muscle Cell Differentiation of Embryonic Stem Cells Reflects Myogenesis in Vivo: Developmentally Regulated Expression of Myogenic Determination Genes And Functional Expression of Ionic Currents. Developmental Biology. 164, 87-101
Shamblott, Michael J. - Axelman, J. - Wang, S. - Bugg, E. M. - Littlefield, J.W. - Donovan, P. J. - Blumenthal, P. D. - Huggins, G. R. - Gearhart, J. D. (1998): Derivation of Pluripotent Stem Cells from Cultured Human Primordial Germ Cells. Proceedings of the National Academy of Sciences of the USA. 95, 13726-13731
Smith, Austin (2001): Embryonic Stem Cells. in: Marshak, Daniel R. - Gardner, Richard L. - Gottlieb, David (eds.): Stem Cell Biology. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, 205-230
Tanaka, Satoshi - Kunath, T. - Hadjantonakis, A. K. - Nagy A. - Rossant, J. (1998): Promotion of Trophoblast Stem Cell Proliferation by FGF4. Science. 282, 2072-2075
Thomson, James A. - Iskovitz-Eldor, J. - Sharpio, S.S. - Waknitz, M. A. - Swiergiel, J. - Marshall, V. S. - Jones, J. M. (1998): Embryonic Stem Cell Lines Derived from Human Blastocysts. Science. 282, 1145-47
Zwaka, Thomas P. - Thomson, James A. (2003): Homologous Recombination in Human Embryonic Stem Cells. Nature Biotechnology. 21, 3, 319-21