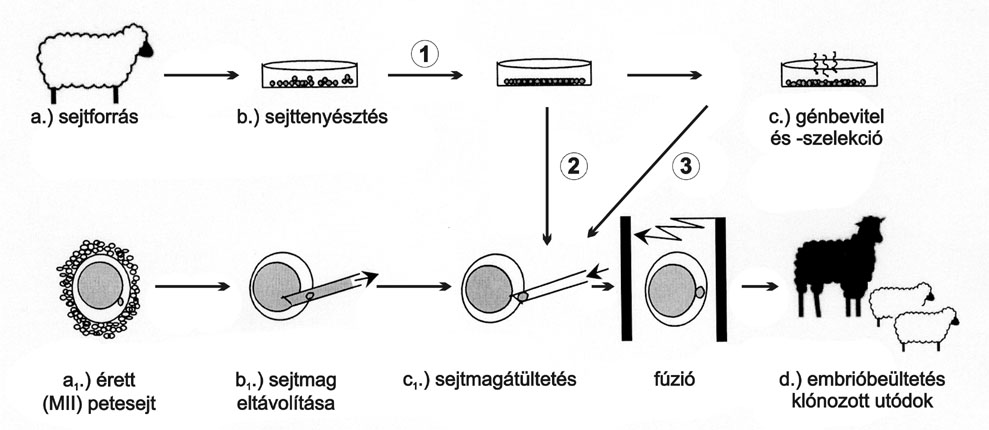
 1. ábra * A sejtmagátültetéses klónozás kulcsfontosságú lépései: 1)
sejtizolálás különböző testi sejt forrásokból, sejttenyésztés; 2)
sejtmagátültetés korai sejttenyészetből; 3) tartós sejttenyészet, ami
lehetőséget ad a génmanipulációra.
1. ábra * A sejtmagátültetéses klónozás kulcsfontosságú lépései: 1)
sejtizolálás különböző testi sejt forrásokból, sejttenyésztés; 2)
sejtmagátültetés korai sejttenyészetből; 3) tartós sejttenyészet, ami
lehetőséget ad a génmanipulációra.
Mi is a klónozás?
Az elmúlt évek nagy feltűnést és reményt keltő tudományos áttörései között a biológia területén az őssejtkutatással versenyezve jelennek meg a "klónozás" sikereiről és gyakran nehézségeiről szóló hírek. A klón genetikailag azonos élőlények összességét jelenti. Az identikus (egypetés, monozigotikus, esetleg embriófelezéssel létrehozott) ikrek klónoknak tekinthetők, mivel genetikailag azonos egyedek. A sejtmagátültetéses klónozás esetében a kétéltűekben elért sikerek ellenére emlősökben a kezdeti eredmények kiábrándítóak voltak. Az áttörést juhban (Willadsen, 1986) érték el, ahol sejtmagdonorként nyolc-tizenhat sejtes embriók sejtjeit, recipiensként pedig DNS tartalmától megfosztott (enukleált) petesejteket használva sikerült utódokat előállítani.
Az új eredmények rendkívüli érdeklődést keltettek a tudományos közösségben. Korai (beágyazódás előtti stádiumú) embriókból az 1980-as évektől kezdődően más fajokban (egér, nyúl, kecske, sertés) is sikerrel állítottak elő sejtmagátültetéses klónokat. Magyarországon Mosonmagyaróváron, osztrák segítséggel juhokat állítottak elő ezzel a módszerrel, valamint a gödöllői Mezőgazdasági Biotechnológiai Kutatóközpontban is hasonló kutatások folytak szarvasmarha-embriók felhasználásával (Dinnyés et al., 1997). Az embrió eredetű sejtmagátültetéses klónozás módszerével, a klónozott embriók több klónozási cikluson keresztüli "újrafelhasználásával", egy embrióból kiindulva akár százkilencven embrió is nyerhető (hatgenerációs klónozás). Azonban a harmadik klónozási generáció után a további klónozott embriók átültetéséből nem születtek utódok, jelezve a rendszer biológiai és technológiai korlátait. Az eljárás hatékonysága szarvasmarha esetében viszonylag magas volt, de a gazdasági felhasználást jelentősen korlátozta a klónozással előállított borjak szokásosnál nagyobb mérete, amely gyakran ellési nehézségekhez vezetett, valamint a jelentős születés utáni elhullás. Ennek okai a legutóbbi vizsgálatok szerint inkább az embriók előállítására használt in vitro rendszer tökéletlenségében és rendellenes génműködésváltozásokat indukáló hatásában keresendők, mintsem magában a klónozási folyamatban.
A nehézségek miatt a kutatók figyelme a totipotens (minden sejttípussá alakulni képes) sejtvonalak előállítása felé irányult, amely a klónozási technikával kombinálva a transzgénikus állatok előállításában ígért áttörést. Az embrionális eredetű totipotens őssejtvonalak egérben viszonylag könnyen előállíthatóak, és emberben, valamint rhesus- vagy bundermajomban is sikerült ilyen sejtvonalak alapítása. Gazdasági haszonállatokban azonban a stabil, nem differenciálódó totipotens őssejtvonalak előállítása igen nehéz, és noha szarvasmarhában, nyúlban, valamint sertésben sikerült néhány utódot nyerni ilyen sejtekből, a sejtvonalak fenntartása és az eredmények megismételhetősége nem megbízható.
Sejtmagátültetéses klónozás testi sejtekből
1997-ben az őssejtkutatás nehézségeivel küzdő kutatókat meglepte a tudományos áttörés híre, bárányok előállítása differenciálódott testi sejtekből. Magzati kötőszövet (fibroblaszt) és felnőtt egyed emlő-hámsejtjeiből egyaránt sikerült sejtmagátültetéssel utódokat előállítani (Wilmut et al., 1997). Dolly, az első felnőtt testi sejtből létrehozott emlős esetében az eljárás hatékonysága 0,4 %-os volt. Ezzel megdőlt egy dogma, azaz, hogy a felnőtt, differenciálódott sejtek genetikai anyaga már nem alkalmas teljes, új szervezet létrehozására. Dolly után más fajok esetében is (szarvasmarha, egér, kecske, sertés, macska, nyúl, gaur, banteng, muflon, öszvér, ló, afrikai vadmacska; összefoglaló cikket lásd Dinnyés et al., 2002) sikerült élő utódokat nyerni testi sejtekből.
A fenti összetett módszer magas szintű technikai felkészültséget igényel (in vitro maturációs és kultivációs rendszer, mikromanipulációs és sejtfúziós felszerelés), részleteit az 1. ábra mutatja be.
A folyamat egyes lépéseinek pontos időzítése, a háttérben folyamatosan zajló komplex biológiai folyamatok miatt nagy jelentőséggel bír. Ezen biológiai folyamatok számos ponton részleteikben még nem ismertek. Az újabb ismeretek szerint a befogadó petesejt citoplazma és a donor sejtmag állapotának szinkronja meghatározó jelentőségű ahhoz, hogy a citoplazma újraprogramozhassa a bejuttatott sejtmag genetikai anyagát, és az ismét totipotenssé váljon (Campbell et al., 1996). Az eredmények ellenére a technológia még gyerekcipőben jár, és számos problémával kell szembenézni. Egy recipiensbe általában a szokásosnál több (sertésben esetenként akár százötven!) embriót ültetnek, tekintettel a klónozott embriók alacsony megtapadási arányára. A vetélések magas aránya, a megszülető borjak és bárányok nagy mérete, illetve a klónozott utódok gyakori korai elpusztulása a gyakorlati felhasználás fő akadályai. Ezen problémák pontos oka még nem ismert, de alapvetően technikai gondokra és genom újraprogramozási hiányosságokra vezethetőek vissza (Wilmut et al., 2002).
Nőstény sejtdonor esetében az X-kromoszóma inaktiváció rendellenességei is felelősek lehetnek egyes magzatok pusztulásáért (Xue et al., 2002). A "Dolly" esetében megfigyelt ún. teloméra génszakasz rövidülése, ami idő előtti öregedés jele lehet (Shiels et al., 1998), más fajokban nem nyert megerősítést (Tian et al., 2000). "Dolly" esetében az öregedési folyamat korai kezdetére utalhatott egy enyhe ízületi gyulladás, azonban ennek pontos okát nem sikerült felderíteni. Az öregedési folyamat alaposabb megfigyelésére sajnos ez esetben nem nyílt lehetőség, mivel "Dolly" hat és fél éves korában áldozatul esett egy klónozástól független retrovírus fertőzésnek (tüdő adenomatózis, jagziekte betegség).
A testi sejtes klónozás sikere világosan bizonyította, hogy a felnőtt testi sejtek is lényegesen rugalmasabbak a genetikai újraprogramozás terén, mintsem azt korábban feltételezték. Ezen felfedezés megtermékenyítő hatást gyakorolt az őssejtkutatásra is, ahol a dogmák egy részétől megszabadult kutatók meglepetéssel tapasztalták, hogy a felnőtt szervezetben található szomatikus (szervspecifikus) őssejtek más szervekbe átültetve szintén sokoldalúan átalakulhatnak a helyi sérült szövetet pótolni képes prekurzor, majd differenciálódott sejtekké. Ennek részleteivel e kiadvány más fejezetei részletesebben foglalkoznak.
Klónozás és őssejtkutatás
A sejtmagátültetéses klónozás története más szempontokból is szervesen összefügg az őssejtkutatással. A klónozás alapkérdése a genetikai újraprogramozás folyamata, amelynek során az egyedfejlődés során kialakult ún. epigenetikus változások "letörlődnek", majd újraíródnak a sejtmag genetikai anyagán. A klónozással kapcsolatban gyakran megjelenő fejlődési rendellenességek, és az alacsony hatékonyság gyökere a gének működését meghatározó epigenetikus újraprogramozás tökéletlenségében eredeztethető. Ennek közvetett bizonyítéka az, hogy a klónozott állatok természetes módon fogant és megszületett utódaiban a szülők rendellenességei nem jelentkeznek. Mivel az ivaros szaporodás során a természetes folyamatnak megfelelően az epigenetikus (és a klónozás miatt esetleg hibás) génszabályozási információk letörlődnek, majd újraíródnak, az ilyen jellegű hibák eltűnnek az utódokból.
Annak megértése, hogy mely faktorok játszanak szerepet a genetikai újraprogramozásban, nemcsak a klónozás hatékonyságát javítaná, hanem forradalmasíthatná az őssejtkutatást is, mivel a genetikai újraprogramozást végző petesejten belüli faktorok valószínűleg képesek lennének arra, hogy petesejttől független közegben is átalakítsák a sejteket, és testi sejtekből "univerzális őssejteket" állítsanak elő. Lehetséges, hogy ne csak a petesejteknek, hanem például az embrionális őssejteknek is vannak ilyen faktoraik. Ebben az esetben embrionális őssejt-kivonatok is segíthetnek a genetikai újraprogramozásban.
A klónozás iránti érdeklődés egyik "szenzációt keltő" eleme a terápiás klónozás perspektívája. Ez esetben emberi, felnőtt testi sejteket sejtmagátültetési DNS-donorként használva hólyagcsíra-stádiumú embriót lehetne létrehozni, majd ebből őssejteket izolálni. Ezen őssejtek alkalmasak lennének egyéni sejt- és szövetpótlási valamint génterápiára, mivel a sejtmagdonor személy szervezetéből nem lökődnének ki. A terápiás klónozást az országok többségében a törvényhozás és a tudományos közélet sem ellenzi, tekintettel a gyakorlati felhasználás rendkívüli perspektíváira, noha gyakorlati alkalmazására, a számos technológiai nehézség miatt, még nem került sor. Ez a módszer céljaiban és lépéseiben alapvetően eltér az általános és szakmai közvélemény által egyaránt elítélt, klónozott csecsemők létrehozásáról fantazmagóriákat gyártó "humán reprodukciós klónozástól". Az emberi reprodukciós klónozás a világ országainak nagy többségében törvénybe ütközik, valamint szakmai szempontból is felelőtlen cselekedet lenne, mivel a jelenlegi ismeretszinten az epigenetikus újraprogramozás hibái lényeges egészségügyi kockázatot jelentenének a megszülető gyermekek számára.
A terápiás klónozás felé vezető úton érdekes kísérlet volt egy amerikai próbálkozás, amikor szarvasmarha-petesejtekből a maganyagot eltávolítva ezeket humán testi sejtek recipienseként használták (Lanza et al., 1999). Az így előállított embriók fejlődésnek indultak, de a blasztociszta stádiumig nem jutottak el. Ezen léptek túl kínai kutatók, amikor nyúl petesejteket használva a humán sejtmagot tartalmazó "kiméra" embriók blasztociszta stádiumig jutottak, majd ezekből embrionális őssejteket izoláltak (Chen et al., 2003). Az eredményeket több kutató is megkérdőjelezte, és ezen sejtek differenciálódási képessége és hosszú távú fenntarthatósága még nem bizonyított. Amennyiben működik, ez a módszer esetleg könnyebben elérhetővé teheti az egyedi őssejt-terápia orvosi alkalmazását. De a gyakorlati alkalmazás előtt még mindenképpen számos biztonsági és etikai kérdés vár majd tisztázásra.
Tévhitek a klónozásról - a módszer haszna és lehetőségei
A sejtmagátültetéses klónozással kapcsolatban elterjedt egyik tévhit az így előállított utódok "pontos másolat" mivolta. Ez több okból sem fedi a valóságot. Elsősorban, a folyamat során a DNS hordozója az átültetett sejtmag, ugyanakkor a recipiens petesejtben az eredeti mitokondriális DNS jelen marad. Ennek következtében mitokondriumaik genetikai anyagában a "klónozott" élőlények egymástól és a kiindulási sejtmagdonortól egyaránt eltérnek. További különbségeket okoz a genetikai újraprogramozás már említett folyamata, amely a meglévő gének működését jelentősen megváltoztatja. A végső különbségekhez hozzáadódik az embriókat befogadó "anya"-szervezet, melynek terhesség alatti állapota szintén egyedi különbségeket indukál a fejlődő magzatban. Mindezekből következik, hogy a sejtmagátültetéssel előállított állatok között jelentős különbségek fedezhetőek fel, tehát valójában nem is igazi "klónok". Mégis, a nehézségek és technológiai korlátok ellenére miért lehet fontos az állatok testi sejtes "klónozása"?
A sejtmagátültetéses klónozásnak, mint technológia rendszernek nagy jövője lehet a transzgenikus állatok hatékony létrehozásában. Transzgenikus állatok esetében a genetikai anyag egy új vagy megváltoztatott működésű gén bevitelével, illetve egy jelen lévő gén kicserélésével vagy "kiütésével" (működésképtelenné tételével) megváltoztatásra kerül. Ez jelenleg általában úgy történik, hogy a génkonstrukciókat a zigóták előmagvába injektálják, ez azonban nem teszi lehetővé a gének beépülésének pontos irányítását. Egérben az őssejtvonalak megléte lehetővé teszi a "halhatatlan" sejtvonalak hatékony genetikai módosítását, ami nemcsak a beépült és kifejeződő genetikai anyagú sejtek kiválogatását teszi lehetővé, hanem egyben utat nyit a finomabb, homológ rekombináción alapuló módszerek alkalmazásához.
A transzgénikus gazdasági haszonállatok előállítását jelentősen megnehezíti, hogy a zigóták előmagvába injektált DNS beépülése, kifejeződése és az injektált embriók túlélése alacsony hatásfokú (0,5-1 % transzgénikus egyed). Az ezzel kapcsolatos költségek igen magasak. Az injektálásos módszerrel csak DNS hozzáadására van lehetőség. A sejtvonalakra épülő klónozás alkalmazásával haszonállatok esetében lényegesen csökkenthető a transzgenikus egyedek előállítási költsége, valamint a testi sejttenyészetek hosszabb időn át való fenntartásával, szelekciójával első alkalommal nyílt lehetőség a célzott génbevitelre (McCreath et al., 2001) és a génkiütésre (Denning et al., 2001) juhban, majd sertésben is. Ezek az eredmények új korszakot nyitottak meg a transzgenikus állatmodellek terén, mivel a sok szempontból az embertől nagyon eltérő egér helyett nyúl-, patkány- és sertésmodellek előretörése várható (Dinnyés et al., 2002), ezzel kompenzálva az embrionális őssejt-vonalak hiányát ezen fajokban.
Ennek ellenére az őssejtvonalak megteremtésére irányuló kutatások az egéren kívül más fajokban is várhatóan tovább fognak folytatódni, mivel az egerekben elvégzett kísérletek alapján úgy tűnik, hogy az őssejtek genetikai anyaga könnyebben és tökéletesebben programozható újra, mint a testi sejteké. Egyes kutatócsoportok a testi sejtek genetikai újraprogramozási folyamatában gyakori és súlyos rendellenességeket figyeltek meg, különösen a "genetikai imprinting" folyamatában részt vevő gének esetében. Ezen elváltozások embrionális őssejtek esetében lényegesen ritkábbak voltak (Bortvin et al., 2003). Más fajok, különösen szarvasmarha esetében azonban a testi sejtes magátültetés lényegesen hatékonyabb, mint egérben. Lehetséges, hogy az egyes sejttípusok közötti különbségek részben fajtól függően is változnak.
A klónozott állatok természetes úton szaporított utódai általában egészségesek, mentesek a klónozott egyedekre jellemző epigenetikus elváltozásoktól (lásd fent). Alapvető fontosságú a klónozással összekapcsolt génátültetési programból született egyedeknél a transzgén integrálódására és kifejeződésére vonatkozó laboratóriumi vizsgálata. Ivadékvizsgálattal ugyancsak meg kell állapítani, hogy a vártnak megfelelően öröklődik-e az átültetett gén, és annak milyen mellékhatásai lehetnek. A transzgenikus vonalat állandó kontroll alatt kell tartani az esetleges génveszteségek kimutatására.
Összefoglalva - a sejtmagátültetéses klónozási technológia sok szempontból összefonódik az őssejtkutatással. Pontos szerepét, fontosságát nehéz jelenleg megjósolni, mivel a módszer hatékonysága és az alapvető biológiai folyamatok ismerete a gyors fejlődés ellenére egyelőre nem kielégítő. A klónozási lépések során megismert biológiai szabályok lehetővé tehetik a hatékonyabb őssejt-munkát, valamint a testi sejtes klónozás kompenzálhatja az őssejtvonalak hiányát az állatfajok többségében, ezzel járulva hozzá az orvosi kutatások és a biomedicina fejlődéséhez.
A kutatásokat támogatták az Oktatási Minisztérium Kutatás-fejlesztési Államtitkársága által a KMÜFA előirányzatból fedezett BIO-00017/2002 és BIO-00086/2002 pályázatai; valamint kétoldalú Tudományos és Technikai Együttműködés pályázatok Magyarország és Kína (CHN14/02), a Cseh Köztársaság (CZ13/2002), Németország (D6/01); Olaszország (I6/01); Nagy Britannia (GB52/01); Törökország (TR3/03) és Ausztria (A10/02) között.
Kulcsszavak: sejtmagátültetés, klónozás, őssejtek, terápiás klónozás, transzgenikus modell állatok
 1. ábra * A sejtmagátültetéses klónozás kulcsfontosságú lépései: 1)
sejtizolálás különböző testi sejt forrásokból, sejttenyésztés; 2)
sejtmagátültetés korai sejttenyészetből; 3) tartós sejttenyészet, ami
lehetőséget ad a génmanipulációra.
1. ábra * A sejtmagátültetéses klónozás kulcsfontosságú lépései: 1)
sejtizolálás különböző testi sejt forrásokból, sejttenyésztés; 2)
sejtmagátültetés korai sejttenyészetből; 3) tartós sejttenyészet, ami
lehetőséget ad a génmanipulációra.
Irodalom
Bortvin, Alex - Eggan, K. - Skaletsky, H. - Akutsu, H. - Berry, D. L. - Yanagimachi, R. - Page, D. C. - Jaenisch, R. (2003). Incomplete Reactivation of Oct4-Related Genes in Mouse Embryos Cloned from Somatic Nuclei. Development. 8, 1673-1680
Campbell, Keith H. S. - Loi, P. - Otaegui, P. J. - Wilmut, I. (1996): Cell Cycle Co- Ordination in Embryo Cloning by Nuclear Transfer. Reviews of Reproduction. 1, 40-46
Chen, Ying. - He, Zhi Xu - Liu, Ailian Ailian et al., (2003): Embryonic Stem Cells Generated by Nuclear Transfer of Human Somatic Nuclei Into Rabbit Oocytes. Cell Research. 13, 251-263
Denning, Chris - Burl, S. - Ainslie, A. - Bracken, J. - Dinnyés A. - Fletcher, J. - King T. - Ritchie, M. - Ritchie, W. R. - Rollo, M. - De Sousa, P. - Travers, A. - Wilmut, I. - Clark, A. J. (2001): Deletion of the a(1,3)Galactosyl Transferase (GGTA1) Gene and the Prion Protein (Prp) Gene in Sheep. Nature Biotechnology. 19, 559-562
Dinnyés. András. - Bodó Sz.- Solti L. (1997): Production of Cloned Hatched Blastocysts from in Vitro Produced Bovine Morulae in Hungary. Proc. 8th European Congress on Biotechnology, 17-21 Aug, 1997, Budapest, No. MO6208.
Dinnyés András - De Sousa, P. - King, T. - Wilmut, I. (2002): ):Somatic Cell Nuclear Transfer: Recent Progress and Challenges. Cloning Stem Cells. 1, 81-90
Lanza, Robert P. - Cibelli, José B. - West, Michael D. (1999): Human Therapeutic Cloning. Nature Medicine. 5, 975-977
CMcCreath, Kenneth J. - Howcroft, J. - Campbell, K. H. - Colman, A. - Schnieke, A. E. - Kind, A. J. (2000): Production of Gene-Targeted Sheep by Nuclear Transfer from Cultured Somatic Cells. Nature. 405, 1066-1069
Shiels Paul G. - Kind A. J. - Campbell K. H. - Waddington D. - Wilmut I. - Colman A. - Schnieke A. E. (1999): Analysis of Telomere Lengths in Cloned Sheep. Nature. 399, 316-317
Tian, X. Cindy - Xu, Jie- Yang, Xiangzhong (2000): Normal Telomere Lengths Found in Cloned Cattle. Nature Genetics. 26, 272-273
Willadsen, Steen M. (1986): Nuclear Transplantation in Sheep Embryos. Nature. 320, 63-65
Wilmut, Ian - Schnieke, A. E. -W - McWhir, J. - Kind, A. J. - Campbell, K. H. S. (1997): Viable Offspring Derived from Fetal and Adult Mammalian. Nature. 385, 810-813.
Wilmut, Ian - Beaujean, N. - De Sousa, P. - Dinnyés A. - King, T. J. - Paterson, L. A. - Wells, D. N. - Young, L. E. (2002): Somatic Cell Nuclear Transfer. Nature. 419, 583-587
Xue Fei - Tian, X. - Du, F. - Kubota, C. - Taneja, M. -é. - Dinnyés A. - Dai, Y. - Levine, H. - Pereira, L. V. - Yang, X. (2002): Aberrant Patterns of X Chromosome Inactivation in Bovine Clones. Nature Genetics. 31, 216-220