Őssejtek
Uher Ferenc
Dr. habil., tudományos főmunkatárs, Országos Gyógyintézeti Központ Őssejt-biológia
A felnőtt őssejtek - vérképző és egyéb szöveti őssejtek
Bevezetés
Az embrionális fejlődés korai stádiumában a sejtek még minden irányban képesek
differenciálódni. A felnőtt szervezetben erre már csak kisszámú, ún. szöveti
őssejt, és az is csak részben képes. Ezek a szöveti őssejtek fontos szerepet
töltenek be a sérülések regenerációjában és a folyamatosan megújuló szövetek
(például a vérképzőrendszer) fiziológiás működésében. Sorsukat a közvetlen
környezetükből, az őssejt-niche-ből érkező proliferációs, differenciációs és
túlélési jelzések határozzák meg. A folyamat mechanizmusa azonban mindmáig
tisztázatlan. A felnőtt szöveti őssejtek ugyanis különböző fejlődési irányokba
képesek differenciálódni, sokszor még fejlődéstanilag nem rokon sejttípusokká
is át tudnak alakulni. A központi idegrendszerből például olyan idegi őssejtek
izolálhatók, amelyek fiatal embrióba oltva mindhárom csíralemez (ekto-, endo-
és mezoderma) irányába képesek differenciálódni. A csontvelői stróma és/vagy
vérképző őssejtekből pedig - a vérsejteken és strómán kívül - idegsejtek és
gliasejtek, váz- és szívizomrostok, valamint májsejtek is keletkezhetnek. Ha
infarktuson átesett egerek szívébe autológ csontvelőt oltanak, az állatok
elhalt szívizomrostjainak hatvan-hetven százaléka kilenc nap alatt
regenerálódik. A csontvelőtranszplantált betegek májsejtjeinek egy-két
százaléka általában donor eredetű (Anderson, 2001; Bianco - Robey, 2000;
Weissman et al., 2001). Szinte hetente olvashatunk ilyen és ehhez hasonló
szenzációs eredményekről a Nature, a Science és más vezető tudományos
folyóiratok hasábjain, nem is beszélve a napisajtóról és az elektronikus
médiáról. Lassan már úgy vetődik fel a kérdés, hogy: a szervezetben vajon - kis
túlzással - bármiből bármi keletkezhet (Morrison, 2001)? Ez természetesen nem
így van, de a szöveti őssejtek plaszticitásának jellege és mértéke az
őssejtbiológia egyik legizgalmasabb kérdése.
Összefoglalómban nem tárgyalom szisztematikusan, mindenre kiterjedően a
különböző típusú szöveti őssejtek sajátságait és plaszticitását, inkább
általános törvényszerűségek megfogalmazására törekszem, amelyek alátámasztására
elsősorban a vérképző, az izom- és az idegi őssejtek (egér és ember) életéből
mutatok be jellemző példákat. Amikor a fejlődéstani összefüggések megértése azt
indokolja, még az ecetmuslinca (Drosophila melanogaster), a fejlődés- és
molekuláris biológusok egyik kedvenc kísérleti állata is szóba kerül. Szeretném
tehát az őssejteket fejlődéstani kontextusban (is) bemutatni, kiemelve azt,
hogy mit csinálnak (feltehetően) a szöveti őssejtek általában a szervezetben,
és mire képesek vagy inkább kényszeríthetők, extrém körülmények (in vitro
kultúra, idegen mikrokörnyezet stb.) között. Azaz megpróbálom elválasztani a
valóságost a lehetségestől.
In medias res
A szervezetben nagyon kevés szöveti őssejt van. A csontvelőben kb. minden 105
magvas sejtből egy lehet vérképző őssejt. Az ideg- és izomszövetben még
megbecsülni sem tudjuk az idegi és izom-őssejtek előfordulásának arányát,
részben mert olyan kevés van belőlük, részben mert nagyon jól rejtőzködnek.
Kevés - és nem szomatikus - őssejt az, ami morfológiailag megkülönböztethető a
környezetétől. Felszíni markereik alapján is csak a vérképző őssejteket tudjuk
hellyel-közzel azonosítani és viszonylag eredményesen izolálni. Úgy véljük,
hogy az idegi őssejtek - pontosabban egy részük vagy egy szubpopulációjuk - a
subventricularis (az oldalsó agykamrák alatti) zónában és/vagy magában az
ependymában, az agykamrákat bélelő hámrétegben található. Az izom őssejteket
valószínűleg az izomrostokhoz szorosan kötődő ún. kísérő (szatellita) sejtek
között kell keresnünk.
Szerencsére néha az őssejtek is elárulják magukat. Mind a csontvelőben, mind az
enzimatikusan feltárt izomszövetben van egy kis sejtpopuláció, amelynek tagjai
- a többi sejthez képest - alig jelölődnek egy Hoechst 33342-es nevű
fluoreszcens festékkel. Ez az ún. szegély (side) populáció, amely áramlási
citométer segítségével könnyen szeparálható, rendkívül gazdag vérképző illetve
izom őssejtekben. A jelenség magyarázata az, hogy az őssejtek nagyon sok
multidrog-rezisztencia fehérjét expresszálnak, és így gyorsan el tudják
távolítani a festékmolekulákat a sejtek belsejéből.
Kérdés, hogy más szöveti őssejtek esetén is beválik-e ez a módszer? Ez
különösen az idegi őssejtek esetében lenne érdekes, hiszen ezeknek a sejteknek
tisztítása és jellemzése még megoldatlan. Gyakorlatilag minden kísérleti
munkában az enzimatikusan feltárt idegszövetből in vitro kultúrában -
epidermális növekedési faktor (EGF) jelenlétében - növekedésnek induló kompakt
sejtaggregátumokat, a neuroszférákat, illetve a belőlük származó multi- vagy
inkább pluripotens őssejteket használják idegi őssejtekként. (A neuroszférák
anyasejtjei, az ún. szféraképző sejtek lennének a tulajdonképpeni idegrendszeri
őssejtek). Tény, hogy a neuroszférákból származó sejtek - szemben például a
vérképző vagy más szöveti őssejtekkel - EGF jelenlétében jól szaporodnak és
korlátlan ideig életben tarthatók in vitro kultúrában. Szöveti őssejt voltukat
azonban nagyon sokan kétségbe vonják, ami rengeteg vita forrása. A szöveti
őssejtek jelenlétét egy sejtpopulációban tehát változatlanul csak
transzplantációval, a megfelelően előkészített recipiensbe ültetett sejtek
önfenntartó és differenciálódási képességének megfigyelésével lehet
egyértelműen igazolni (Anderson, 2001; Dorshkind, 2002; Dzierzak; 2002).
Döntéskényszer az őssejt-kompartmentekben
Egy-egy szöveti őssejtnek nagyon sokféle döntést kell hoznia a szervezetben. Az
első és legfontosabb, hogy életben maradjon-e (szükség van-e rá) vagy
elpusztuljon? Ha életben marad, milyen életutat válasszon? Osztódás vagy
differenciálódás, helyben maradás vagy elvándorlás? Mi legyen az osztódás során
keletkező leánysejtek sorsa? Továbblépjenek-e a fejlődésben (differenciálódás),
vagy őrizzék meg a "fiatalságukat" (önfenntartás)?
A döntéseket az őssejtek hozzák, de mindenképpen meg kell felelniük az adott
szövet és az egész szervezet igényeinek - biztosítaniuk kell a homeosztázis
fenntartását (1. ábra).
Ez az igény - legalábbis mennyiségileg - nagyon eltérő feladatokat ró az egyes
szöveti őssejtpopulációkra. A folyamatosan megújuló szövetek, például a vér
fiziológiás működése naponta néhányszor 1011 új vörösvérsejtet és granulocitát
igényel. Ráadásul a vérképző őssejteknek a szervezetet érő stresszhelyzetekre -
fertőzés, sérülés, tartós oxigénhiány stb. - is rugalmasan kell reagálniuk,
növelve (vagy néha csökkentve) az érett vérsejtek számát a keringésben.
Aligha véletlen, hogy őssejtátültetés után éppen a vérképző rendszer
regenerálódik a leggyorsabban és a legteljesebb mértékben a recipiens(ek)
szervezetében. Ugyanakkor - és ez a másik véglet - az ún. állandósult
szövetekben, például a központi idegrendszerben található idegi őssejtek
fiziológiás körülmények között szinte észrevehetetlenek. Felnőtt korban új
idegsejtek csak kis számban, és valószínűleg csak az agy bizonyos területein
(például: hippocampus, bulbus olfactorius) keletkeznek. (Egyes vélemények
szerint ingergazdag környezetben (tanulás?) az átlagosnál valamivel több új
idegsejt keletkezik.) A sérült vagy pusztuló idegsejtek pótlására általában nem
vagy legfeljebb minimális mértékben képesek. (Az in vitro növesztett
neuroszférákból származó sejtek viszont már a vérképző őssejteknél is nagyobb
regenerációs képességgel rendelkeznek)(Dzierzak, 2002; Uher et al., 2003).
Édenkert(ek) a szervezetben: az őssejt-niche
A fentiek alapján az őssejtbiológia kulcskérdése: hogyan választ magának
"életpályát" egy őssejt úgy, hogy közben - legalábbis a populáció szintjén -
önfenntartóképességét is megőrizze? A válasz, amit csak részben ismerünk, az
őssejtek mikrokörnyezetében keresendő. Az őssejt-niche koncepciója közel
harminc évvel ezelőtt a hematológiában alakult ki. Lényege, hogy a vérképző
őssejtek és az őket körülvevő csontvelői stroma sejtek, valamint az
extracelluláris mátrix egy funkcionális egységet alkotnak. Az őssejt számára ez
a niche maga az Édenkert, innen kiemelve rövid idő alatt elveszíti önfenntartó
képességét, és besugárzott recipiensbe oltva nem képes annak vérképzőrendszerét
újratelepíteni (repopulálni). Az őssejt-lét szempontjából kulcsfontosságú a
niche-ben termelődő őssejt faktor (stem cell factor - SCF), ami az őssejtek
c-Kit receptoraihoz (egy tirozin-proteinkináz receptor) kötődik. Az SCF és
receptora, a c-Kit felfedezése óta szinte megszámlálhatatlan citokinnek az
őssejtek életére, illetve a vérképzésre gyakorolt hatását írták le. Ezek
oldható fehérjék, glikoproteinek, de gyakran kötődnek az extracelluláris
mátrixban található proteoglikánokhoz (kondroitin-szulfát, heparán-szulfát
stb). Az így "felfűzött" citokinek multivalens ligandumot képeznek, és
keresztkötéseket hoznak létre az őssejtek megfelelő receptorai között, ami
jócskán felerősíti a hatásukat, sőt az FGF például csak ilyen formában aktív.
Az extracelluláris mátrixot alkotó molekuláknak azonban nem csak ez a
funkciójuk. Maguk is ligandumai számos sejtadhéziós molekulának, amelyek nagy
számban fordulnak elő az őssejtek felszínén. A legfontosabbak közülük az
integrinek. Funkciójuk nem korlátozódik az őssejtek helyhez kötésére,
jelzéseket is eljuttatnak a sejtek belsejébe, amelyek számos különböző -
például citokin receptorokat kódoló - gén kifejeződését befolyásolhatják. A
számtalan részeredmény ellenére a vérképző őssejtek önfenntartó képességének a
titkát még nem sikerült megfejteni. In vitro kultúrában - különböző citokin
(SCF, Flt-3, IL-3, IL-6, IL-7, kolónia-stimuláló faktorok, stb.) kombinációk
segítségével - osztódásra tudjuk bírni az őssejteket, de ez mindig együtt jár
önfenntartó és repopulációs képességük gyors elvesztésével. (Ez ma a
génmanipulációs próbálkozások egyik legfőbb akadálya). Jobb, de még korántsem
kielégítő eredményeket értek el olyan sejtkultúrákban, amelyek a "hagyományos"
citokinek mellett morfogéneket is tartalmaznak.
A morfogének pleiotróp hatású fehérjék. Különböző kombinációkban más-más
fejlődési programokat képesek aktiválni a fogékony, azaz a megfelelő
receptorokat hordozó sejtekben, de van egy másik - legalább ilyen fontos -
funkciójuk is. Az egyedfejlődés korai szakaszában a sejtek nemcsak osztódnak és
differenciálódnak, hanem egyidejűleg létrehozzák a szövetek és szervek
szigorúan meghatározott, rendezett térbeli struktúráit is. Ezt a folyamatot
mintázat-kialakulásnak (pattern formation) nevezzük. A hibátlan háromdimenziós
szerveződés előfeltétele, hogy minden sejt pontos információkkal rendelkezzen
saját térbeli helyzetéről, s ennek megfelelően tudjon fejlődni.
A szükséges "pozicionális" információkat morfogenetikus gradiensek biztosítják
a sejtek számára, amelyek képesek érzékelni az egyes morfogének relatív
koncentrációját, azaz - erősen leegyszerűsítve - az adott sejtnek a különböző
morfogén forrásoktól (morfogént elválasztó sejtektől) való távolságát. Az
egyedfejlődés során tehát a morfogének a fejlődési programok kivitelezői vagy
végrehajtói.
A természet egyik csodája, hogy a legegyszerűbb soksejtű állatoktól az emberig
ugyanaz az öt - igaz, egyre nagyobb méretű és egyre több génből álló -
multigéncsalád: az Egf, az Fgf, a Hedgehog, a Tgf és a Wnt által kódolt
fehérjék látják el ezt a feladatot. Az egyedfejlődés befejeződése után a
legtöbb morfogén, az EGF (epidermális növekedési faktor), az FGF (fibroblaszt
növekedési faktor), a Hh (Hedgehog) és a TGF családba tartozó TGF-b
(transzformáló növekedési faktor-b), aktivin és körülbelül húszféle BMP
(csontfejlődést indukáló faktorok), valamint a Wnt fehérjék, részben
citokinekként - növekedési és/vagy differenciálódási faktorokként - is
funkcionálnak tovább a különböző szövetekben.
A többi szöveti őssejt mikrokörnyezetéről alig tudunk valamit, de tény, hogy
kiszakítva onnan - a vérképző őssejtekhez hasonlóan - néhány nap alatt
elveszítik önfenntartó képességüket. Egyedül az idegi őssejtek lógnak ki -
látszólag - a sorból. Valójában nem az egyes őssejtek, hanem a neuroszférák
azok, amelyek tartósan életképesek in vitro kultúrában. Egy-egy ilyen
neuroszféra pedig egészen sajátos mikrovilág. Több száz sejtből áll, amelyeknek
csak egy része klonogén, és valószínűleg még kevesebb rendelkezik
önfenntartóképességgel. A többi - valamivel differenciáltabb - sejt
valószínűleg csak ezeknek a túlélését biztosítja. Mindenesetre érdemes lenne a
neuroszférákat, mint az őssejt-niche egy (talán egyetlen) in vitro modelljét
(is) tanulmányozni (Watt - Hogan, 2000; Weissman et al., 2001).
Elkötelezettség vagy genetikai promiszkuitás
A következő kérdés az, hogy van-e a szöveti őssejteknek speciális genetikai
programjuk. Összehasonlító génexpressziós módszerekkel (DNS-chip technikával)
végzett vizsgálatok során mintegy kétszáz-kétszázötven olyan DNS-szekvenciát
azonosítottak, amelyek többféle (embrionális, vérképző és idegi) őssejtben is
kifejeződnek. Valamilyen "őssejt-program" tehát valószínűleg létezik. A szöveti
őssejtek legfőbb "titka" azonban valami egészen más. A legfontosabb fejlődési
irányok - haematopoesis, neurogenezis, miogenezis stb. - meghatározásában és
(ezeken belül) a különböző sejtfejlődési sorok differenciálódásának
szabályozásában - a homeodomén tartalmú fehérjék mellett - mindig kulcsszerepet
játszik néhány, alap spirál-hurok-spirál (bHLH) típusú transzkripciós faktort
kódoló, ún. "mester-szabályozó" gén.
A szöveti őssejtekre viszont a genetikai promiszkuitás a jellemző. Genomjuk
meglehetősen nyitott, így egyidejűleg számos különböző - más-más fejlődési
irány meghatározására képes - mester-szabályozó gént expresszálnak. Mégsem
differenciálódnak, mivel egyik mester-gén transzkriptuma (mRNS-e) sem éri el az
ehhez szükséges kritikus mennyiséget a sejtekben. (Ugyanez igaz a szöveti
őssejtek felszínén expresszálódó morfogén, citokin és kemokin receptorokra is.)
A szöveti őssejtek tehát potenciálisan sokféle genetikai program
megvalósítására képesek. A döntés, hogy e lehetőségek közül adott esetben
melyik realizálódik - azaz milyen irányba kezd differenciálódni a sejt - az
elsősorban az őssejt közvetlen környezetéből érkező jelzésektől (morfogének,
növekedési faktorok stb.) függ. Ezeket a jelzéseket az őssejt feldolgozza,
integrálja, majd meghozza döntését. Lényegében hasonló a helyzet az
"elkötelezett" elődsejtek esetében is. Maga az elkötelezettség tehát minden
szinten - legyen szó multipotens őssejtekről vagy elődsejtekről - relatív
fogalom (Hu et al., 1997; Uher et al., 2003).
Az őssejtek őrült tánca?
A szöveti őssejtek bevezetőben említett plaszticitásának mechanizmusát nem
ismerjük. Modelleket tudunk alkotni, amelyek többé-kevésbé megfelelnek a
rendelkezésünkre álló adatoknak, de természetesen egyik ilyen modell sem
tökéletes vagy kizárólagos. Lehetséges, hogy minden szövetünkben vannak olyan
rendkívül fiatal, a csíralemezek kialakulása előtti állapotban "szunnyadó"
vagy inkább lassan osztódó pluripotens őssejtek, amelyek az őket körülvevő
mikrokörnyezettől függően még bármilyen irányba képesek differenciálódni.
Vérképző, miogén vagy idegi őssejtek helyett tehát inkább a vérképző
rendszerben, az izomzatban, a központi idegrendszerben és más szövetekben
található őssejtkompartmentekről beszélhetünk, amelyek pluripotens sejteket is
tartalmaznak. Ez a modell elsősorban azért vonzó, mert rendkívül egyszerű. Az
is kétségtelen, hogy vannak a szervezetünkben olyan - igaz, nem szomatikus -
őssejtek, amelyeknek az eredete és fejlődése egyaránt független a három
csíralemeztől. Ilyenek például a primordiális csírasejtek.
Jóval merészebbnek tűnik a szöveti őssejtek de- és redifferenciálódásán alapuló
modell. Főként azért, mert a differenciálódási folyamat(ok)
visszafordíthatatlansága sokáig a fejlődéstan egyik alaptörvényének számított.
Dolly és a többi klónozott állat megszületése óta erről már nincs szó. Ráadásul
a dedifferenciálódás in vivo sem ismeretlen jelenség. Jól tudjuk, hogy a halak
és kétéltűek egy része képes pótolni elvesztett végtagjait (úszót, lábat).
(Emberben ez a regenerációs képesség az utolsó ujjpercekre korlátozódik és
azokra is csak nagyon fiatal - egy-két éves - korig.) Feltételezik, hogy a
csonkulás helyén a hámsejtek nagy mennyiségű FGF-et termelnek, és a környező
izomrostok dedifferenciálódnak. (A gerincesek többségében ez a jeltovábbító út
nem vagy csak nagyon fiatal korban működik). Blasztéma keletkezik - olyan
plasztikus sejtek (őssejtek?) halmaza - amiből hamarosan kifejlődik az új
végtag. Csontok, erek, izmok, idegek keletkeznek és mindez dedifferenciálódott
izomból (Tsonis, 2000).
Sokak számára mindez nehezen elfogadható, hiszen a normális növekedés és később
a fizikai megterhelés - például sport vagy testépítés - során a kísérősejtekből
keletkeznek az új izomrostok. Pedig a dedifferenciálódáson alapuló, illetve a
kísérősejtekre visszavezethető regeneráció és növekedés korántsem zárják ki
egymást. Elképzelhető - de ez még csak spekuláció - hogy az izmok növekedésében
és a kisebb sérülések utáni regenerációjában valóban a kísérősejtek játsszák a
főszerepet (ez történik a legtöbb állat és az ember izomzatában is), de egy
teljes végtag pótlása meghaladja e sejtek lehetőségeit. Ilyenkor kaphat
szerepet néhány "szerencsés" hal és kétéltű faj esetében az izomrostok
dedifferenciálódása, ami nyilván sokkal nagyobb tartalékok mozgósítását teszi
lehetővé. Semmiképpen sem zárható ki tehát, hogy a szöveti őssejtek
plaszticitásának hátterében a megváltozott mikrokörnyezetbe (niche-be) került
őssejtek de-, majd redifferenciálódása áll.
A harmadik lehetőség a transzdifferenciálódás. Ez sem ismeretlen jelenség,
legalábbis a patológusok számára nem az. Vesefibrózis során például a
vesetubulusok hámsejtjei miofibroblasztokká alakulnak (epithelialis
mesenchymalis transzdifferenciálódás), és így a vese működésképtelenné válik.
Más szervek - a tüdő, a máj - fibrózisának is hasonló a mechanizmusa. A
transzdifferenciálódás azonban nem csak beteg sejtekben tanulmányozható.
A transzdifferenciáció és a szöveti őssejtek plaszticitása tehát egyaránt a
sejtek elkötelezettségének megváltozására visszavezethető jelenségek. Mindkettő
csak regeneratív sejtosztódás során (illetve azt követően) figyelhető meg, és
egyik sem jár átmeneti (két különböző sejtfejlődési sorra jellemző markereket
egyidejűleg hordozó) sejtalakok megjelenésével. Lehetséges tehát, hogy a
szöveti őssejtek plaszticitása a sejtek megváltozott környezeti feltételek
hatására bekövetkező transzdifferenciálódásával magyarázható. Csak a következő
években fog kiderülni, hogy a fenti három modell mely elemei helytállóak, azaz
pontosan mi az őssejtek plaszticitásának a magyarázata (Graf, 2002; Orkin -
Zon, 2002; Vas et al., 2002).
Az őssejtek öregedése
Általánosan elfogadott, hogy a nem immortalizált eukarióta sejtek osztódása
egyben öregedésüket is jelenti. Osztódáskor ugyanis a kromoszómák vége, az ún.
teloméra megrövidül. A telomera-rövidülés mitózisról mitózisra folytatódik,
amíg el nem ér egy kritikus értéket. Az adott sejt számára ez az utolsó
lehetséges osztódás volt, hiszen egy következő mitózis után már olyan
utódsejtek keletkeznének, amelyek megfelelő hosszúságú telomera nélküli
kromoszómákat hordoznak, és ezért életképtelenek. Tehát a telomera hossza az
egyik legfontosabb "mitotikus óra" a sejtek számára. Létezik azonban egy enzim,
a telomeráz, amely képes megnyújtani a kromoszómák végét, ezáltal lassítani,
illetve immortalizált sejtekben megállítani e mitotikus óra ketyegését. A
vérképző és más szöveti őssejtek rendkívüli önfenntartó és proliferációs
képessége - többek között - ennek az enzimnek az aktivitására vezethető vissza.
A foetalis májból származó vérképző őssejtekben például még igen magas, az
érett felnőttkori csontvelőből izolált sejtekben viszont már meglehetősen
alacsony a telomeráz-aktivitás. Ezzel párhuzamosan csökken a vérképző őssejtek
kromoszómáinak végén található telomerák hossza. Közben az őssejtek
funkcionálisan is öregednek. Egy adott csontvelőt általában legfeljebb
háromszor lehet sorozatosan transzplantálni. A harmadik átültetés után az
őssejtek elvesztik önfenntartó és ezzel együtt repopulációs képességüket is.
A jelenleg legelfogadottabb és kétségtelenül legátfogóbb elmélet szerint a
vérképző (és valószínűleg más szöveti) őssejtek öregedése a tartós in vivo
repopulációra képes sejtek "minőségének" az életkor előrehaladtával
párhuzamosan bekövetkező folyamatos romlására vezethető vissza. Ha a foetalis
májban található, tartós csontvelő repopulációra képes sejtek összességét 100
%-nak tekintjük, ebből mintegy 95 % a jó és 5 % a gyengébb minőségű őssejt. A
jó minőségű őssejtek potenciálisan még nagyszámú osztódásra képesek. A gyengébb
minőségű őssejtek mitotikus órája (lásd telomera rövidülés) viszont már
lejáróban van, így további lehetséges osztódásaik száma korlátozott. A fiatal
felnőtt csontvelőben körülbelül tizenötször, az időskoriban pedig ötvenszer
akkora az őssejt kompartment, mint a foetális májban. E növekedő kompartment
azonban egyre kevesebb jó minőségű őssejtet tartalmaz. Végül a jó minőségű
őssejtek elfogynak, és ettől kezdve - megfelelő utánpótlás hiányában - a
gyengébb minőségű őssejtkészlet is rohamosan fogyni kezd, és hamarosan
bekövetkezik a csontvelő pusztulása. A vérképző őssejtek minősége tehát az
egyed biológiai korának egyik fontos meghatározója.
Természetesen minden, a vérképző rendszert súlyosan károsító és nagyfokú
csontvelő-regenerációt előidéző hatás vagy beavatkozás - mérgezés,
sugárártalom, kemo- és radioterápia, szupraletálisan besugárzott egyedbe
történő őssejtátültetés stb. - gyorsítja az öregedési folyamatot. Más szóval
krízishelyzet(ek)ben a vérképző őssejtek ún. akcelerált öregedése figyelhető
meg. Az őssejtállomány minőségének romlása azonban fiziológiás körülmények
között is nyilvánvaló. Jól ismert például, hogy idős korban csökken a szervezet
védekező képessége. Ugyancsak az őssejtek öregedésével függhet össze a vérképző
rendszerből kiinduló daganatok gyakoriságának növekedése idős emberekben. Amit
nem tudunk: vajon mekkora tartalékok vannak a vérképző rendszerben? Hány éves
korig biztosíthatná - elvben - a magzati élet során kialakult vérképző
őssejt-készlet a folyamatos vérképzést, azaz hány év a vérképző rendszer
lehetséges maximális élettartama? Óvatos becslések szerint emberben talán
százhússzázötven, egérben pedig két és fél-három év (Anderson, 2001; Vas et
al., 2002; Weissman, 2001).
Összefoglalás helyett
Mit profitál(hat) mindebből a gyakorlati orvoslás? A választ három részre kell
bontanunk. Egyrészt minden, őssejtekkel foglalkozó fórumon - szóban és írásban
- visszatér egy közhely: "új korszak kezdődik a transzplantációs medicinában".
Természetesen mint minden közhelyben, ebben is van igazság, de a szöveti
őssejtek átültetése - legalábbis a vérképző őssejtek esetében - korántsem
újdonság. A csontvelő-transzplantáció több évtizedes múltra visszatekintő,
elfogadott terápiás eljárás.
Ugyanakkor pont a vérképző őssejtek átültetése kapcsán szerzett, nemritkán
keserű tapasztalatok figyelmeztetnek arra, hogy a többi - kevésbé ismert és
jóval nehezebben hozzáférhető - szöveti őssejt transzplantációs célú
felhasználása korántsem ígérkezik túl egyszerűnek. Így erre néhány évet (vagy
inkább évtizedet) még biztosan várni kell. Pillanatnyilag sokkal reálisabbnak
tűnik szövetek és egyszerűbb szervek (protézisek) előállítása (szívbillentyű,
ízületek, porckorongok stb.) az őssejtekből in vitro kultúrában. Ez ma a
biotechnológiai ipar egyik legígéretesebb területe (ún. tissue engineering).
Az igazi áttörést azonban az jelentené, ha sikerülne "rávenni" a szervezetet,
hogy maga javítsa ki a sérüléseit, pótolja a betegség, baleset vagy egyszerűen
öregedés következtében elvesztett sejtjeit (body, heal thyself). Ehhez nem kell
izolálni, tisztítani és in vitro kultúrában tartani az őssejteket. Nincs
szükség nehezen felkutatható donorra és a recipiens immunrendszerének
gátlására. Ha egyszer az őssejtek ott vannak minden szövetben, akkor "csak"
tudni kell őket - a megfelelő helyen és időben - aktiválni. (Az őssejteket is
érintő, öröklött betegségben szenvedőkben ez a módszer természetesen nem
alkalmazható.) Azaz meg kell tanulnunk, hogyan irányíthatjuk az őssejtek
osztódását és differenciálódát a saját mikrokörnyezetükben in vivo. Ez egy
nagyszabású, több évtizedre szóló kutatási program, de az e területen elért
legkisebb eredmény is biztosan megéri a szellemi és anyagi ráfordítást.
Végezetül annyit jegyzünk még meg, hogy a szöveti őssejtek terápiás
felhasználása során nem merülnek fel olyan - mostanában hatalmas viharokat
kavaró - etikai és erkölcsi kérdések, mint az embrionális őssejtekkel
kapcsolatban.
Kulcsszavak: genetikai promiszkuitás, öregedés, őssejt-niche, szöveti őssejtek,
vérképzés
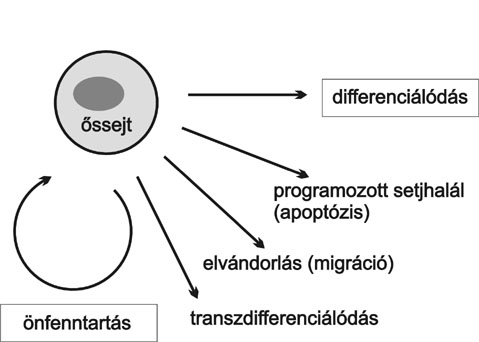 1. ábra * Amit egy szöveti őssejtnek tudnia kell. Az önfenntartáson és
differenciálódáson kívül minden szöveti őssejtpopuláció egyensúlyának
fenntartásában szerepet játszik a sejtek egy részének szabályozott pusztulása
(apoptózis). Az egyedfejlődés korai szakaszában, a magzati élet során, minden
őssejt rövidebb-hosszabb vándorutat tesz meg a szervezetben, és legtöbbjük
(talán minden szöveti őssejt?) a születés után is megőrzi migrációs képességét.
Esetleges transzdifferenciálódásukat a sejtek genomjának "nyitottsága", tehát
az általuk megvalósítható genetikai programok sokfélesége teszi lehetővé.
1. ábra * Amit egy szöveti őssejtnek tudnia kell. Az önfenntartáson és
differenciálódáson kívül minden szöveti őssejtpopuláció egyensúlyának
fenntartásában szerepet játszik a sejtek egy részének szabályozott pusztulása
(apoptózis). Az egyedfejlődés korai szakaszában, a magzati élet során, minden
őssejt rövidebb-hosszabb vándorutat tesz meg a szervezetben, és legtöbbjük
(talán minden szöveti őssejt?) a születés után is megőrzi migrációs képességét.
Esetleges transzdifferenciálódásukat a sejtek genomjának "nyitottsága", tehát
az általuk megvalósítható genetikai programok sokfélesége teszi lehetővé.
Irodalom
Anderson, David J. (2001). Stem Cells and Pattern Formation in the Nervous
System: the Possible Versus the Actual. Neuron. 30, 19-35.
Bianco, Paolo - Robey, P. Gehron (2000): Marrow Stromal Stem Cells. Journal of
Clinical Investigation. 105, 1663-1668
Dorshkind, Kenneth (2002): Multilineage Development from Adult Bone Marrow
Cells. Nature Immunology. 3, 311-313
Dzierzak, Elaine (2002): Hematopoietic Stem Cells and Their Precursors:
Developmental Diversity and Lineage Relationships. Immunological Reviews. 187,
126-138
Graf, Thomas (2002): Differentiation Plasticity of Hematopoietic Cells. Blood.
99, 3089-3101
Hu, Ming - Krause, D. - Greaves, M. - Sharkis, S. - Dexter, M. - Heyworth, C. -
Enver, T. (1997): Multilineage Gene Expression Precedes Commitment in the
Hemopoietic System. Genes and Development. 11, 774-785
Morrison, S. J. (2001): Stem Cell Potential: Can Anything Make Anything?
Current Biology. 11, R7-R9
Orkin, Stuart H. - Zon, Leonard I. (2002): Hematopoiesis and Stem Cells:
Plasticity Versus Developmental Heterogeneity. Nature Immunology. 3, 323-328
Tsonis, Panagiotis A. (2000): Regeneration in Vertebrates. Developmental
Biology. 221, 273-284
Uher Ferenc - Hajdu Melinda - Vas Virág (2003): Self-Renewal and
Differentiation of Hematopoietic Stem Cells: A Molecular Approach. Acta
Microbiologica et Immunologica Hungarica. 50, 3-21
Vas Virág - Hajdu, M. - Pálóczi, K. - Uher, F. (2002): Alternative Views of
Tissue Stem Cell Plasticity. Haematologia. 32, 175-190
Watt, Fiona M. - Hogan, Brigid L. M. (2000): Out of Eden: Stem Cells and Their
Niches. Science. 287, 1427-1430
Weissman, Irvin L. - Anderson, David J. - Gage, Fred (2001): Stem and
Progenitor Cells: Origins, Phenotypes, Lineage Commitments, and
Transdifferentiation. Annual Review of Cell and Developmental Biology. 17,
387-403
<-- Vissza a 2004/3 szám tartalomjegyzékére
<-- Vissza a Magyar Tudomány honlapra
[Információk] [Tartalom] [Akaprint Kft.]
 1. ábra * Amit egy szöveti őssejtnek tudnia kell. Az önfenntartáson és
differenciálódáson kívül minden szöveti őssejtpopuláció egyensúlyának
fenntartásában szerepet játszik a sejtek egy részének szabályozott pusztulása
(apoptózis). Az egyedfejlődés korai szakaszában, a magzati élet során, minden
őssejt rövidebb-hosszabb vándorutat tesz meg a szervezetben, és legtöbbjük
(talán minden szöveti őssejt?) a születés után is megőrzi migrációs képességét.
Esetleges transzdifferenciálódásukat a sejtek genomjának "nyitottsága", tehát
az általuk megvalósítható genetikai programok sokfélesége teszi lehetővé.
1. ábra * Amit egy szöveti őssejtnek tudnia kell. Az önfenntartáson és
differenciálódáson kívül minden szöveti őssejtpopuláció egyensúlyának
fenntartásában szerepet játszik a sejtek egy részének szabályozott pusztulása
(apoptózis). Az egyedfejlődés korai szakaszában, a magzati élet során, minden
őssejt rövidebb-hosszabb vándorutat tesz meg a szervezetben, és legtöbbjük
(talán minden szöveti őssejt?) a születés után is megőrzi migrációs képességét.
Esetleges transzdifferenciálódásukat a sejtek genomjának "nyitottsága", tehát
az általuk megvalósítható genetikai programok sokfélesége teszi lehetővé.