Őssejtek
Rajnavölgyi Éva
az MTA doktora, Debreceni Egyetem Orvos- és Egészségtudományi Centrum Általános Orvostudományi Kar Immunológiai Intézet
AZ ŐSSEJTEK ÉS AZ IMMUNRENDSZER
Bevezetés
Az őssejtek korlátlan ideig osztódó, nem specializálódott önmegújító sejtek,
amelyek aszimmetrikus osztódás révén önmagukhoz hasonló sejteket és emellett
elkötelezett utódsejteket hoznak létre. Az emlős egyedfejlődés korai
embrionális szakaszában kialakuló embrionális őssejtek (embryonal stem - ES) a
szervezet mintegy kétszáz különböző szövetének újraképzésére képesek. Ezek a
sejtek ma már izolálhatók, és - ellentétben az adott funkciókra szakosodott
differenciált testi sejtekkel - megfelelő in vitro körülmények között korlátlan
ideig fenntarthatók vagy különböző testi sejtekké alakíthatóak.
Az embrionális és a magzati egyedfejlődést követően a felnőtt szervezet
specializálódott testi sejtjei között nagyon kis számban jelen vannak olyan
sejtek, amelyek megtartják önmegújító képességüket és azt a sajátságukat is,
hogy belőlük többféle típusú utódsejt alakulhat ki. Mai tudásunk alapján
mintegy húsz eltérő szöveti őssejttípus azonosítható, amelyek nagyfokú
fejlődési rugalmassággal rendelkeznek. Ide tartoznak a csontvelői vérképző
őssejtek is, amelyek a vér összes sejttípusának kialakulását biztosítják. Akár
egyetlen ilyen őssejt is képes a szervezet teljes vérrendszerét felépíteni
(Osawa, 1996). Emlősökben az immunrendszer működését biztosító sejtek a
magzati élet utolsó szakaszától kezdve a csontvelői hematopoetikus őssejtekből
(hematopoietic stem cell - HSC) fejlődnek. Ez a folyamat nem fejeződik be a
születést követően, hanem egész életünket végigkíséri. A vér sejtes elemeinek
folyamatos újratermelődése, gyors válasza a különböző stresszhatásokra (például
vérzés, fertőzések) és az egyensúly fenntartása összetett szabályozó
mechanizmusok eredménye. Az immunrendszer sejtjeinek állandó újraképződése
alapvető fontosságú a szervezet megfelelő védelmét biztosító folyamatok
zavartalan és hatékony lezajlásához.
Különleges regenerációs képességük és "halhatatlan" sajátságuk alapján mind az
embrionális, mind a felnőtt őssejtek felhasználhatók hiányzó, károsodott vagy
hibásan működő szövetek pótlására, helyettesítésére. A különböző eredetű
őssejtek terápiás felhasználási lehetőségeivel ma már külön tudományág, a
regenerációs medicina foglalkozik. Ennek kutatási és alkalmazási területe
kiterjed az embrionális őssejtekből származó működő szövetek előállítására és
megfelelő előkészítésére éppúgy, mint a szöveti őssejtek izolálására és
megfelelő számban történő felszaporítására. Az őssejtek elvi felhasználási
lehetőségei a gyógyításban szinte korlátlanok, de ezek nagy része jelenleg még
komoly etikai és módszertani korlátokba ütközik. Továbbá az őssejtek terápiás
felhasználási lehetőségeinek jelentős gátat szabnak az őssejtek és a belőlük
származó szövetek korlátlan beültetését akadályozó immunológiai reakciók is.
Ebben a rövid áttekintésben a HSC-knek az immunrendszer működésében betöltött
létfontosságú szerepét próbálom meg érzékeltetni, valamint a különböző őssejtek
sajátságainak és felhasználási lehetőségeinek néhány, az immunrendszer
működésével kapcsolatos vonatkozását ragadtam ki. Bár a HSC-k a terápiás célra
legrégebben alkalmazott őssejtek (Pálóczi, 2003), az ezzel kapcsolatos legújabb
eredményeket és terápiás vonatkozásokat e kötet egyéb fejezetei érintik.
Az immunrendszer sejtjei a hematopoetikus őssejtek leszármazottai
A HSC-ből fejlődő sejtek általában rövid élettartamúak, és ezért folytonos
utánpótlást igényelnek. A szerzett immunitás legfontosabb sejtjei a limfociták,
amelyek a csontvelői HSC-ből képződő limfoid előalakokból fejlődnek (1. ábra).
A B-limfociták érése a csontvelőben zajlik, míg a T-limfocitáké és a
természetes ölő sejteké (natural killer - NK) a tímuszban folytatódik (1.
ábra). A HSC-kből differenciálódó mieloid előalakokból - szintén a csontvelőben
- alakulnak ki a monociták, a dendritikus sejtek, a granulociták és a
hízósejtek, amelyek a természetes immunitás fontos szereplői, valamint a
szerzett immunitás számos folyamatában is részt vesznek (Rajnavölgyi, 2003, 1.
ábra). A vérben keringő monocitákból a perifériás szövetekben differenciálódó
makrofágok és dendritikus sejtek hivatásos antigénbemutató sejtek, és ezáltal a
T-sejtek által közvetített sejtes immunválasz fontos szabályozói. A makrofágok,
a szöveti hízósejtek és a granulociták a természetes immunitás hatékony
effektor sejtjeiként működnek, és elősegítik a szerzett immunitás hatékony
működését is (Erdei, 2003).
A limfociták élettartama, osztódása, öregedése
A felnőtt emberi szervezetben a limfociták száma megközelítőleg 1012, a B- és
T-limfociták megoszlása közel azonos. A limfocitákra jellemző, hogy egyedileg
eltérő antigén-felismerő receptorokkal rendelkeznek, és ezáltal nagyszámú,
eltérő szerkezetű antigén felismerésére képesek. Az egyes limfociták az antigén
ingertől függően eltérő időpontokban aktiválódnak és indulnak osztódásnak. A
limfociták egyik legfontosabb sajátsága az antigén hatására bekövetkező gyors
klonális osztódás, ami időlegesen biztosítja a megfelelő specificitással
rendelkező sejtek feldúsulását és az adott antigénnel szembeni hatékony
védelmet (2. ábra).
Az antigén eltávolítását követően azonban a felszaporodott sejtek feleslegessé
válnak, elpusztulnak, és az egyensúly fenntartása érdekében a csontvelőből új
sejtek pótolják őket. A naiv, antigénnel még nem találkozott limfociták
folyamatos újraképződése a HSC-kből biztosítja a rendelkezésre álló
limfocitakészlet terjedelmét, egyensúlyát és az immunrendszer állandó
felkészültségét az újabb és újabb környezeti hatásokkal szemben.
Az immunrendszer hatékony működése szempontjából fontos kérdés, hogy mennyi
ideig élnek és hányszor képesek a limfociták az antigén-specifikus aktiváció
hatására osztódni. A sejtbiológiai kutatások még az 1960-as évek elején
igazolták, hogy a testi sejtek csak bizonyos ideig képesek szaporodni. Ezek a
vizsgálatok azt is felderítették, hogy a sejtek megkétszereződésének
lehetőségeit nem az időtartam, hanem az osztódások száma határozza meg. Ezt a
jelenséget "osztódási öregedésnek" nevezték, amely tulajdonság függ a fajtól,
az egyed korától és genetikai adottságaitól. Így például a rövid életű
élőlények sejtjei kevesebb osztódásra képesek, mint a tovább élő fajoké, a
magzati vagy az újszülöttekből származó sejteknek több osztódási lehetőségük
van, mint az idősebbek sejtjeinek. Kísérletes adatok azt is alátámasztották,
hogy a korlátozott idejű szaporodó képesség domináns genetikai sajátosság, és a
törzsfejlődés során valószínűleg a korlátlanul szaporodó sejtek (például
rosszindulatú daganatok) kialakulását gátló fontos mechanizmus. A
sejtosztódások számát a sejtekben "biológiai órák" szabályozzák, amelyek
meghatározott gének aktivációja és kiiktatása révén "számolják" az adott sejt
osztódási lehetőségeinek számát. Egy ilyen fontos időmérő mechanizmust az ún.
telomérák biztosítanak. Ezek az ismétlődő DNS-szekvenciák a magvas sejtek
kromoszómavégeit védik az enzimatikus hasítástól, és ezáltal fokozzák azok
genetikai stabilitását. A telomérák azonban minden sejtosztódás során
rövidülnek, és egy kritikus hossz elérésekor a sejt osztódóképességének
leállítását eredményezik. A telomérák rövidülését bizonyos sejtekben, így
például az őssejtekben és a legtöbb rosszindulatú daganatos sejtben, a
telomérák helyreállítását biztosító telomeráz enzim komplex ellensúlyozza.
A B- és T-limfocitákban a telomeráz enzim aktivitása függ a sejt altípusától,
fejlődési és aktivációs állapotától. Így például a tímuszban és a perifériás
T-limfocitákban a telomeráz aktivitás - a rosszindulatú tumorsejtekhez
hasonlóan - magas, de mintegy tíz osztódási ciklust követően jelentősen
csökken. A B-limfociták összes osztódásainak száma sejtkultúrában átlagosan
huszonhárom, míg a T-limfociták esetében mintegy harmincötre becsülhető. Így
egyetlen T-limfocita egész élete során mintegy 1010 utódsejtet képes
létrehozni, ami jól érzékelteti az adott antigén specificitással rendelkező
limfocita klónok funkcionális hatékonyságát. Az egyes T-sejt klónok osztódása
azonban - az immunrendszer működési elve alapján - megszakításokkal,
hullámokban történik, amelyeket a felesleges sejtek pusztulása követ. A 2. ábra
a T-limfociták ismétlődő antigén ingerre bekövetkező osztódási szakaszait
vázolja fel. Ennek alapján érthető, hogy a sokszor ismétlődő vagy folytonos
antigén stimuláció az egyes T-sejt klónok "kimerülését" váltja ki, amit a
megváltozott működéssel járó öregedés, majd sejthalál követ. A folyamat során
képződő kevés, lassan osztódó memóriasejt ezzel szemben mintegy kettő-öt évig
is életben maradhat, és hosszú ideig képes az immunológiai memória
fenntartására.
Az osztódások számával öregedő limfociták nem válnak teljesen
funkcióképtelenné, de az osztódóképesség leállását fontos, az immunológiai
funkciókat befolyásoló genetikai és fenotípusváltozások kísérik. Így például
csökken az antigén ingerre történő aktiváció mértéke és a programozott
sejthalállal (apoptózissal) szembeni érzékenység. Ilyen elöregedő, nem
funkcióképes T-limfociták szaporodnak fel - az egyed korától függetlenül - a
krónikus antigén stimulációval járó betegségben, így például a humán
immundeficiencia vírussal (HIV) fertőzött egyedek perifériás vérében is.
Az immunrendszer differenciált sejtjei tehát folyamatosan öregednek, a tímusz
serdülőkorban történő visszafejlődésével pedig csökken az újonnan képződő
T-limfociták száma is. Ennek következtében a perifériás nyirokszövetekben és a
vérben nő a memóriasejtek aránya, ami a szervezet "immunológiai tapasztalatait"
felhasználva védelmet biztosít számos antigénnel szemben. Az immunrendszer
rugalmassága az ismétlődő stresszhatások, új kórokozók vagy a daganatos sejtek
szaporodásának kivédésében azonban egy idő után csökken. Ezért fontos
immunológiai és talán gerontológiai kérdés is, hogy mennyire változik meg az
immunrendszer folyamatos utánpótlását biztosító HSC-k funkciója a kor
előrehaladtával, hiszen ez az egész szervezet élettartamát is befolyásolhatja.
Öregszenek-e az őssejtek?
A limfocitákkal ellentétben a csontvelői sejtek csupán 0,01 %-át kitevő HSC-k
hosszú életűek, az "örök életet" a telomérák rövidülését helyreállító telomeráz
enzim mellett egyéb mechanizmusok is biztosítják. Ennek egyik bizonyítéka, hogy
a HSC-k és a belőlük származó, eltérő funkciójú utódsejtek száma az öregedéssel
nem csökken, sőt bizonyos beltenyésztett egértörzsekben növekedik. Ennek
ellenére kísérleti adatok igazolták, hogy a vérképző rendszer pótlásához az
idős HSC-kből többre van szükség, mint a fiatalokból. Ez arra utal, hogy a
HSC-k száma ugyan nem, de funkcionális aktivitása a kor előrehaladtával
csökken.
Ellentétben az embrionális őssejtekkel, az emberi HSC-kben kimutatható a
telomérák hosszának rövidülése és ezáltal az osztódással járó öregedés is, noha
ezt a magas telomeráz aktivitás részben ellensúlyozza. Emellett azonban a HSC-k
korral járó funkcionális módosulását egyéb belső tényezők vagy külső hatások,
mint például a sztrómasejtek öregedése, funkcionális változásai is
előidézhetik. A HSC-k jellegzetes nem differenciált állapota és a limfoid
leszármazottak fokozott érzékenysége a radioaktív sugárzással szemben arra
utal, hogy az öregedő HSC-kben zajló belső változásokat - más sejtektől
eltérően - elsősorban a genomiális DNS-ben halmozódó mutációk, az ezeket
helyreállító mechanizmusok károsodása és a sejtciklus szabályozásának zavarai
idézik elő. Ezzel szemben a csontvelő és a tímusz eltérő sztrómasejtjeinek
(például a fibroblasztok, hámsejtek) öregedéssel járó változásai hasonlóak az
egyéb testi sejtek öregedését előidéző folyamatokhoz, amiben a fenti
mechanizmusok mellett fontos szerepet játszanak az oxidatív stressz által
kiváltott fehérje- és lipidváltozások is. Ezek az eltérések a HSC-k fejlődését
biztosító speciális környezetben (csontvelő, tímusz) a citokinek
koncentrációjának, összetételének, a lebontó enzimek és a sejten kívüli mátrix
fehérjék mennyiségének, szerkezetének és funkcióinak módosulásához vezethetnek.
Ezek a külső tényezők szintén jelentősen befolyásolhatják a HSC-k regenerációs
képességét (Effros, 1997). Ez a folyamat megy végbe a tímusz serdülőkorban
bekövetkező visszafejlődésekor, amikor a megváltozott sztróma gátolja a
csontvelői timocita előalakok bevándorlását és ezt követő differenciálódását,
noha a T-sejt előalakok száma nem változik. Ebben a folyamatban fontos szerepet
játszik a tímusz hámsejtek által termelt IL-7 citokin termelésének csökkenése,
ami hátráltatja a timociták osztódását és túlélését.
Hosszú és rövid életidejű HSC-kkel jellemezhető beltenyésztett egereken végzett
genetikai vizsgálatok igazolták, hogy a 2., a 7. és a 11. kromoszómán
azonosított, az állatok korának szabályozásához kapcsolható hét különböző gén
lókusz közül öt a HSC-k életidejét is befolyásolta. Érdekes módon ezekben a
kromoszómarégiókban a sejtciklus szabályozásában és a DNS-helyreállításban
szereplő géneket is azonosítottak. Ezek az eredmények arra utalnak, hogy bár a
HSC-k egészséges egyedekben az egész élet során gondoskodnak a vérsejtek
számának folyamatos fenntartásáról, "funkcionális" életidejük közvetlenül vagy
közvetve hatással van az egész szervezet élettartamára.
Noha a HSC-ket érintik az öregedés bizonyos tünetei, önmegújító és sokféle
utódsejtet létrehozó képességük hosszú ideig lehetővé teszi a teljes vérképző
rendszer, ezen belül az immunrendszer sejtjeinek folytonos újraképzését. Ahogy
ezt a csontvelőátültetések gyakorlata igazolja, a felnőttkori HSC-k képesek a
teljes vérképző rendszer és az immunrendszer regenerációjára. Az utóbbi néhány
év vizsgálatai továbbá azt is igazolták, hogy a HSC-k és leszármazottaik
nagyobb rugalmassággal rendelkeznek, mint azt előzetesen gondolták. Így a HSC-k
más szöveti környezetbe helyezve egyéb szöveti sejtekké is fejlődhetnek,
valamint a csontvelőben a HSC-knél szélesebb regenerációs képességgel
rendelkező őssejtek is találhatók (Jiang, 2002).
Az őssejtek terápiás alkalmazásának immunológiai korlátai
Az immunrendszer egyik fontos biológiai funkciója a szervezet integritásának,
belső egyensúlyának folyamatos védelme. Ennek érdekében az immunrendszer
felismeri és tolerálja a saját szerveket, szöveteket, de sejtpusztító
folyamatokkal lép fel a testidegen kórokozók, valamint a más egyedből származó
idegen szövetek ellen. Az emberi populáció immunológiai szempontból rendkívül
sokféle, ami jelentős előny a faj megmaradása szempontjából, de nem kedvez a
szervátültetésnek, hiszen az emberi szövetek másik egyedbe juttatva erős
immunológiai, ún. szövet kilökődési reakciót váltanak ki. Bár szervezetünk
zömében hasonló fehérjékből épül fel, a kilökődési reakció során a befogadó
szervezet immunrendszere idegenként ismeri fel a beültetett szövet eltérő,
polimorf fehérjéit. Ilyen reakciót váltanak ki például a vércsoport antigének,
valamint a T-limfociták antigénfelismerő működését szabályozó fő szövet
összeférhetőségi génkomplex (major histocompatibility gene complex - MHC)
génjei által kódolt membránfehérjék (Gogolák et al., 2003). Az MHC molekulák az
emberi genom legváltozatosabb fehérjéi, amelyek két egyed között csak az
egypetéjű ikrekben azonosak, közeli rokonokban lehetnek részben azonosak, de
nem rokon egyedek között nagy valószínűséggel eltérőek. Így a kilökődési
reakció csak a saját őssejtek vagy a saját őssejtekből származó szövetek
visszaültetésekor (autológ szövetátültetés) kerülhető el. Az emberi felnőtt
csontvelőből és a köldökzsinórvérből kis számban izolálható HSC-k az autológ
szövetátültetés lehetőségét nyújtják. Más, genetikailag eltérő egyedek
szöveteinek bejuttatásakor (allogén szövetátültetés) az immunrendszer reakciói
komoly gátat jelentenek az őssejtek vagy a belőlük származó szerv
megtapadásának.
A szövetkilökődési reakció erőssége függ a beültetett sejt vagy szövet, a
"graft" és a befogadó szervezet, a "recipiens" közötti genetikai eltérések
mértékétől, valamint az adott szövet egyedi sajátságaitól, elsősorban
immunogenitásától. Az immunogenitást a szöveti összeférhetőséget meghatározó
MHC fehérjék szerkezete és kifejeződésének mértéke mellett az adott szövetben
jelen lévő, donor eredetű hivatásos antigént bemutató sejtek (dendritikus
sejtek, makrofágok) száma határozza meg.
Az őssejtek és az őssejt eredetű szövetek immunogenitása
Az eltérő donorokból előállított ES-sejtek, valamint az ezekből előállított
különböző szövetek - a felnőtt testi sejtekhez és szövetekhez hasonlóan -
immunológiai szempontból rendkívül sokfélék. Így az őssejtek és a belőlük
származó szövetek nem rokon egyedbe juttatva kilökődési reakciót válthatnak ki.
Az emberi ES-sejteken - mint minden testi sejten - megjelennek az I típusú MHC
molekulák, de csak nagyon kis számban. A szöveti differenciálódás során
sejtfelszíni megjelenésük fokozódik, de az érett testi sejtekhez viszonyítva
alacsony marad. Az ES-sejtek II típusú MHC molekulákat nem fejeznek ki, azonban
rendelkeznek IFNg receptorral és az IFNg citokin hatására fokozódik az MHC
molekulák kifejeződése. Bár az ES-sejtek és a belőlük származó szövetek
immunogenitása az MHC molekulák alacsony szintje miatt kisebb, mint a felnőtt
szöveti sejteké, allogén egyedbe ültetve kilökődési reakciót válthatnak ki. Az
emberi szövetek és az ES eredetű szövetek közötti legfontosabb immungenitási
eltérés azonban abból adódik, hogy az utóbbiak nem tartalmaznak szöveti
dendritikus sejteket. A csontvelőátültetések gyakorlatából ismert, hogy a
szöveti dendritikus sejtek kiemelt szerepet játszanak az allo-graftok
immunogenitásának fokozásában, mivel nagy számban hordoznak MHC molekulákat
(direkt bemutatás), valamint hatékonyan mutatják be a graft polimorf
fehérjéiből származó peptideket a befogadó szervezet T-limfocitái számára (3.
ábra, Rajnavölgyi, 2003).
A graft eredetű dendritikus sejtek hiánya az ES eredetű szövetekben jelentősen
csökkenti az immunogenitást és az akut kilökődési reakció mértékét. A befogadó
szervezet saját hivatásos antigént bemutató sejtjei (makrofágok, dendritikus
sejtek) azonban felvehetik az elöregedő vagy elpusztult donor sejteket vagy az
azokból felszabaduló szöveti antigéneket, és a T-limfociták számára "indirekt"
módon bemutatják a donor eredetű fehérjékből származó peptideket (3. ábra). Az
antigénbemutatásnak ez a módja is képes aktiválni az allo-reaktív
T-limfocitákat és kiváltani a kilökődési reakciót.
Az immunológiai korlátok csökkentésének lehetőségei
1. Az őssejtek és az őssejt eredetű szövetek módosítása
A felnőtt szövetekhez hasonlóan az immunológiai korlátok csökkentésének egyik
lehetősége a donor és a befogadó szervezet szövetei közötti genetikai
különbségek csökkentése. Ezt szolgálja az "őssejtbankok" létrehozása, ami
lehetővé teszi nagyszámú, ismert MHC molekulákat kifejező őssejtek hosszú távú
tárolását, és ezt követően az egymásnak legjobban megfelelő donorok és
recipiensek kiválasztását.
Ellentétben a felnőtt szövetek felhasználásával végzett terápiás eljárásokkal,
az őssejtek felhasználása során további manipulációs lehetőségek is
elősegíthetik az immunológiai összeférhetetlenség kiküszöbölését (Bradley,
2002). A "genomikai helyettesítés" módszere sikeresen alkalmazható eljárás
arra, hogy az ES-sejtből származó szövetet immunológiailag elfogadhatóvá tegyük
a kiválasztott donor számára a laboratóriumi és háziállatokban. A
"sejtmagátvitel" vagy "terápiás klónozás" néven is ismertté vált eljárás során
a befogadó szervezetből származó érett petesejtből eltávolítják a genetikai
állományt, majd azt a donor testi (szomatikus) sejtjeiből származó genommal
helyettesítik. Így az osztódó embrionális őssejtekből in vitro létrehozott
szövetek genetikai állománya - a mitokondriális gének által kódolt ún. "minor"
szövet összeférhetőségi fehérjéket kódoló gének kivételével - megegyezik a
befogadó szervezet génjeivel. Az eljárás rendkívül idő- és költségigényes,
ezért a jövőben csak úgy válhat terápiás célra is alkalmazható eljárássá, ha a
szomatikus géntranszfer segítségével ismert genotípusú ES-sejtvonalbankokat
hoznak létre, amelyek lehetőséget adnak a donor genotípusával azonos ES-sejtek
kiválasztására. Ez a lehetőség jelenleg nemcsak etikai, de módszertani
nehézségek miatt sem alkalmazható emberben, mivel a géntranszferrel módosított
emberi petesejtek osztódó képessége lényegesen rosszabb, mint az eddig
alkalmazott, nem a főemlősökhöz tartozó fajokban.
Az őssejtek genetikai módosításával olyan univerzális donorsejtek is
létrehozhatók, amelyek a genetikai háttértől függetlenül is felhasználhatók. A
donor szöveti sejtjein megjelenő MHC molekulák kiemelt szerepet játszanak a
szövetkilökődés elindításában, így az MHC gének eltávolítása vagy inaktiválása
olyan sejteket eredményezhet, amelyek a donor T-limfocitái számára nem
felismerhetők. Ez a beavatkozás azonban jelentősen növeli a sejtek
érzékenységét a természetes ölősejtek (NK sejtek) funkcióival szemben, ami
jelentős szövetkárosodást eredményezhet. Ennek a stratégiának a legnagyobb
kockázata azonban az, hogy az MHC molekulák hiányában a bevitt szövet kikerül
az immunrendszer ellenőrző funkciója alól. Így az ilyen szöveti sejtek
alkalmasak lehetnek például különböző vírusok hosszú távú "bujtatására" vagy
tumorok kialakítására is, hiszen a vírus vagy tumor antigénekből származó
peptidek az MHC molekulák hiányában nem kerülhetnek bemutatásra, és így ezek a
sejtek észrevétlenek maradnak a T-limfociták és a sejtes immunitás számára. Ezt
a lehetőséget támasztják alá azok a megfigyelések, miszerint a legagresszívebb
rosszindulatú daganatok és a legsikeresebb patogén vírusok olyan menekülési
mechanizmusokat fejlesztettek ki, amelyek az MHC molekulák megjelenését képesek
gátolni.
2. A kilökődési reakció gátlása
A donorszövet kilökődése az immunrendszer működését gátló szerekkel is
megakadályozható. Ezek az eljárások hasonlóak az allogén csontvelő-átültetés
során alkalmazott terápiás lehetőségekhez. Az immunrendszer folyamatainak
gátlása azonban nemcsak a kilökődési reakciót, de az immunrendszer általános
védelmi funkcióit is gátolja, és egyéb súlyos mellékhatásokkal is jár.
Az ES-sejtek vagy az ES-sejt eredetű szövetek túlélése olyan módon is
biztosítható, hogy azokat az immunrendszer működését gátló génekkel vértezzük
fel. Így a programozott sejthalált (apoptózist) kiváltó receptorokhoz kötődni
képes Fas ligand bevitele a befogadó szervezet graft-specifikus T-sejtjeinek
pusztulását eredményezheti. A T-sejtes immunitást gátló IL-10 citokin génjének
bevitelével az ES eredetű szövetet védő környezet alakítható ki.
A szervkilökődési reakció gátlásának ígéretes lehetősége a donorszövetre
specifikus aktív immunológiai tolerancia kiváltása. Az eljárás előnye, hogy a
donorszövet ellen kialakított specifikus immunológiai válaszképtelenség nem
érinti az immunrendszer egyéb, a szervezet számára fontos funkcióit. A
donorszövet beadásának megfelelő módja és időzítése elősegítheti a tolerancia
kialakulását és a kilökődési reakció gátlását. A donor eredetű vér
transzfúziója a beültetést megelőzően, a transzplantátum környezetébe
bejuttatott donor eredetű limfociták, a donorsejtek tímuszba történő oltása,
valamint a hematopoetikus kimerizmus kiváltása rágcsálókban végzett
modellkísérletekben alkalmasnak bizonyult a donorsejtek elleni tolerancia
kialakítására. A tolerancia kiváltását segítheti a citokin egyensúly irányított
megváltoztatása vagy a dendritikus sejtek és a T-limfociták közötti kapcsolatok
gátlása is. A befogadó szervezet dendritikus sejtjei továbbá in vitro
körülmények között oly módon is előkezelhetők a donor allo-antigénjeivel, hogy
azok a visszaadást követően a befogadó szervezet válaszképtelenségét váltsák
ki. Ezek a még kísérleti fázisban lévő lehetőségek csupán rövid ideig tartó
kezelést igényelnek, de feltehetőleg speciális szabályozó T-limfociták
aktiválása révén hosszú távú tolerancia kialakulásához vezethetnek.
A "kevert hematopoetikus kiméra állapot" kialakítása a felnőtt szövetek
beültetése során az egyik leghatékonyabb módja a tolerancia kiváltásának. Ezt
az állapotot allogén donor eredetű HSC-k beültetésével lehet elérni, ami a
donor és a gazdaszervezet hematopoetikus sejtjeinek hosszú távú együttes
jelenlétét eredményezi. Az ilyen kiméra szervezetekben a donor eredetű szövetek
allo-antigénjeivel szemben tolerancia alakul ki, és a testi sejtek beültetését
követően a kilökődési reakció nem következik be. A kiméra állapot nemcsak
HSC-kkel, de az MHC génekben eltérő ES-eredetű hematopoetikus sejtekkel is
kiváltható. Patkányokban végzett kísérletekkel igazolták, hogy az ES-szerű
sejtvonalak vérkeringésbe juttatása stabil kevert kiméra állapotot
eredményezett (Fandrich, 2002). A bejuttatott donor eredetű ES-sejtek
betelepítették a tímuszt, és ezáltal a T-limfociták érése során a donorszövet
allo-antigénjeit felismerő sejtek a negatív szelekciós folyamat eredményeként
elpusztultak, és nem kerültek ki a perifériás nyirokszervekbe. Az így
felkészített gazdaszervezet - saját szöveteihez hasonlóan - elfogadta a később
beültetett donorszívet (4. ábra).
Ellentétben a felnőtt csontvelői sejtekkel, amelyek érett T-limfocitákat is
tartalmaznak, az ES-eredetű donorsejtek sem fordultak a gazdaszervezet szövetei
ellen. Ezek az eredmények azt igazolják, hogy az allogén ES-eredetű sejteket az
immunológiailag kompetens felnőtt szervezet kilökődési reakció nélkül képes
elfogadni, és ezáltal a szervezet - az immunrendszert károsító előkezelés
nélkül - felkészíthető a donorszövet (például hasnyálmirigysejtek,
szívizomsejtek) befogadására. Az ES-sejtek - a teratoma-képződés veszélye miatt
- önmagukban erre a célra nem használhatók fel. Új kísérletek azonban
igazolták, hogy az ES-sejtekből in vitro hematopoetikus őssejtek állíthatók elő
(Kaufman, 2001), amelyek kísérleti állatokban biztosítják a hematopoetikus
sejtek fejlődését (Kyba, 2002).
Az őssejtek előnyös immunológiai sajátságai a génterápia során
Ahogy az előzőek is igazolták, az immunrendszer egyik fontos sajátsága, hogy
képes különbséget tenni a saját és a nem saját szövetek között. A kérdés
természetesen az, hogy a felnőtt immunrendszer számára mi tekinthető sajátnak.
Számos példa igazolja, hogy a "genetikai saját" nem jelenti azt, hogy az
immunrendszer a szervezet összes komponensét sajátnak tekinti. Az "immunológiai
saját" egyik lehetséges meghatározása, hogy az immunrendszer azokat a szöveti
fehérjéket tekinti sajátnak, amelyekkel az egyedfejlődés korai szakaszában
találkozott, és velük szemben tolerancia alakult ki. Így fiziológiás
körülmények között az őssejteknek és a belőlük kialakuló differenciált, adott
funkcióra specializálódott sejteknek fontos szerepük van az immunológiai saját
és az immunológiai tolerancia kialakításában.
Ez azt is jelenti, hogy az egyetlen gén hibájából származó kóros elváltozások
terápiás korrigálása során a testi sejtekbe mesterségesen bevitt gén
fehérjeterméke "idegennek" minősül a szervezet számára, és ezért az
immunrendszer az adott gént hordozó sejtekkel szemben kilökődési reakcióval
válaszol. Ez az immunológiai reakció a génterápiás eljárások kudarcát
jelentheti, amit számos megfigyelés igazol. Az is bizonyítást nyert, hogy a
génbevitellel módosított differenciált szöveti sejtekben az immunrendszer
először a gén bevitelét szolgáló - általában vírus eredetű - vektort ismeri
fel, majd ezt követően fordul a bevitt gén fehérjeterméke ellen. Az
immunrendszer reakcióját tehát nemcsak az "idegenként" felismert géntermék
váltja ki, hanem a vektor. A DNS, illetve a bevitel hatására kialakuló helyi
gyulladási reakció "veszély"-jelként is hat, és elősegíti az immunológiai
folyamatok beindulását (Brown, 2002). Ennek hátterében az áll, hogy a vektor
aktiválja a természetes immunitás elemeit, például a természetes ölősejteket,
amelyek a vektort hordozó sejteket elpusztítják. A károsodott sejteket,
valamint a belőlük kiszabaduló fehérjéket - köztük a bevitt gén termékét - a
szöveti dendritikus sejtek felveszik, és hatékonyan mutatják be a T limfociták
számára (3. ábra). Ennek következtében a vektort és ezzel együtt a korrekciós
gént hordozó sejtek a citotoxikus T-limfociták (Tc) és az immunválasz egyéb
effektor funkcióinak áldozatává válnak.
Ennek a mechanizmusnak az alapján a génterápiás eljárások hatásfoka a
"veszély"-jelek csökkentésével és/vagy megszüntetésével jelentősen javítható.
Ennek egyik lehetősége a kevéssé immunogén vektorok kifejlesztése, valamint a
legalkalmasabb hordozó sejtek kiválasztása. In vitro állatkísérletekben
igazolták, hogy ha a specializálódott limfociták helyett a helyettesítendő gént
autológ hematopoetikus őssejtekbe juttatták be, akkor az adott génnel
transzfektált HSC-k nem kilökődési reakciót, hanem hosszan tartó toleranciát
váltottak ki. Ahogy korábban már említettük, a HSC-k a befogadó szervezetben
különböző vérsejtekké, többek között makrofágokká és dendritikus sejtekké
differenciálódnak. Az így képződő antigén bemutató sejtek fiziológiás
körülmények között az új fehérjét sajátként mutatják be a tímuszban, és ezáltal
hosszan tartó immunológiai toleranciát váltanak ki (3. ábra). Ennek alapján a
HSC-k a génterápia új, ígéretes eszközei lehetnek, és felhasználhatók a
befogadó szervezet megfelelő immunológiai előkészítésére, a specifikus
immunológiai tolerancia kialakítására.
Saját kutatások
A T-limfociták különböző altípusai által közvetített sejtes immunválasz szinte
minden típusú patogén elleni hatékony védekezés fontos eleme, alapvető szerepet
játszik az allergiás reakciók kialakulásában, a daganatok elleni immunológiai
folyamatokban és a saját szövetekkel szembeni immunológiai tolerancia
létrehozásában, fenntartásában is. A T-limfociták a szerzett immunitás antigént
felismerő és végrehajtó sejtjei, működésükhöz azonban a természetes
immunitáshoz tartozó antigént bemutató sejtekre, például dendritikus sejtekre
van szükség. A T-limfocitáknak számos, funkcionálisan eltérő altípusa ismert: a
CD4+ segítő és a CD8+ sejtölő képességgel rendelkező T-limfociták mellett az
ún. szabályozó sejtek - amelyek az immunválasz mértékét és lefolyását
irányítják - szintén ide sorolhatók. Eltérő funkcióik ellátásához a
T-limfociták átmeneti kapcsolatokat teremtenek a dendritikus sejtekkel, a két
sejt kölcsönhatása kétirányú szabályozást tesz lehetővé, amely meghatározza a
celluláris immunválasz mértékét, irányultságát, összetevőit (Rajnavölgyi -
Lányi, 2003). Mind a dendritikus sejtek, mind a T-limfociták funkcionális
szempontból rugalmas sejtek, így az antigén természetétől, a szervezetet ért
"veszély"-jelektől függően többféle módon képesek válaszolni az őket ért
hatásokra. A dendritikus sejtek közé többféle sejtféleség sorolható, amelyek a
HSC-kből és más előalakokból is előállíthatók. A dendritikus sejtek izolálására
és in vitro fenntartására, differenciáltatására kidolgozott új eljárások
lehetőséget adnak arra, hogy a dendritikus sejtek funkcióit in vitro
módosítsuk, és segítségükkel a sejtes immunválasz hatásfokát, irányát
befolyásoljuk. Saját vizsgálatainkban elsősorban a dendritikus sejtek és a CD4+
T-limfociták kölcsönhatását vizsgáljuk azzal a céllal, hogy a vírus- és a
tumorellenes immunitás hatékonyságát növeljük (Gogolák, 2003). Továbbá olyan
módszerek kifejlesztésén is dolgozunk, amelyek segítségével az immunológiai
tolerancia a dendritikus sejtek in vitro előkészítése révén kiváltható,
erősíthető.
Kulcsszavak: embrionális őssejt, hematopoetikus őssejt, szövetkilökődés,
antigén bemutatás, dendritikus sejt, T-limfocita, klonális osztódás,
regenerációs medicina
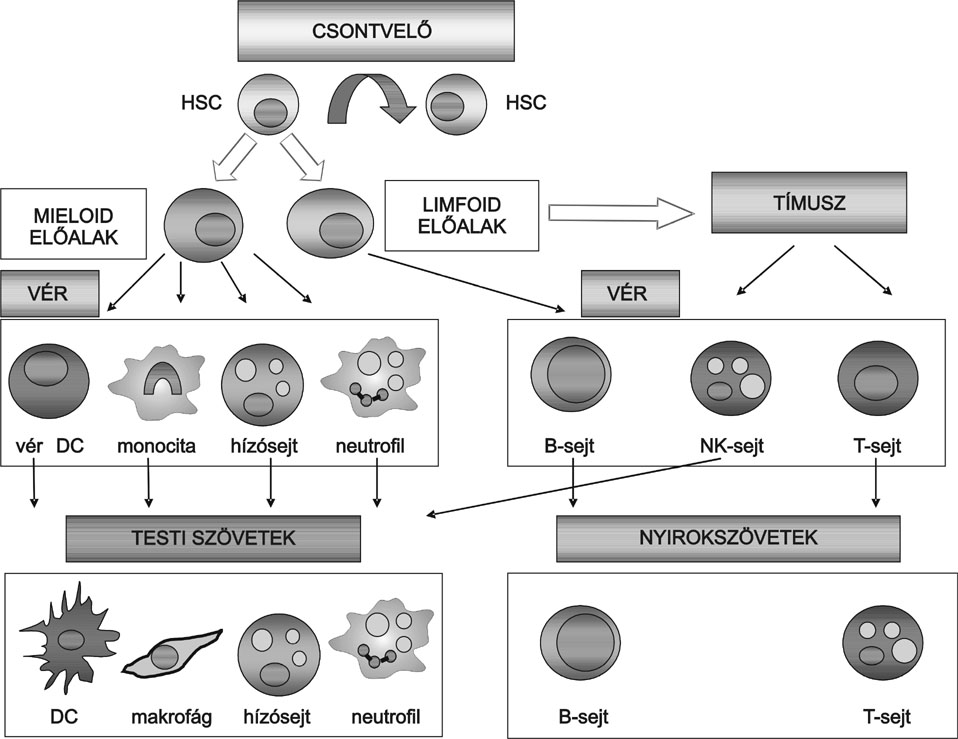 1. ábra * Az immunrendszer működésében részt vevő sejtek fejlődése a
hematopoetikus őssejtekből - A hemopoetikus őssejtekből a csontvelőben mieloid
és limfoid előalakok képződnek. A mieloid sejtek leszármazottai specializált
sejtekké érnek és a vérkeringésbe kerülnek. A vérben keringő dendritikus
sejtek, monociták és granulociták megfelelő ingerek hatására átlépnek az
érfalon, és utódaik a testi szövetekben telepednek le. A limfoid előalakokból a
csontvelőben fejlődnek a B-limfociták, míg a T-limfociták és a természetes
ölősejtek előalakjai a csontvelőből a tímuszba vándorolnak, és
differenciálódásuk ott fejeződik be. A B- és T-limfociták a vér- és a
nyirokkeringés révén örökös körforgásban vannak, antigén-specifikus
aktivációjuk a perifériás nyirokszervekben történik.
1. ábra * Az immunrendszer működésében részt vevő sejtek fejlődése a
hematopoetikus őssejtekből - A hemopoetikus őssejtekből a csontvelőben mieloid
és limfoid előalakok képződnek. A mieloid sejtek leszármazottai specializált
sejtekké érnek és a vérkeringésbe kerülnek. A vérben keringő dendritikus
sejtek, monociták és granulociták megfelelő ingerek hatására átlépnek az
érfalon, és utódaik a testi szövetekben telepednek le. A limfoid előalakokból a
csontvelőben fejlődnek a B-limfociták, míg a T-limfociták és a természetes
ölősejtek előalakjai a csontvelőből a tímuszba vándorolnak, és
differenciálódásuk ott fejeződik be. A B- és T-limfociták a vér- és a
nyirokkeringés révén örökös körforgásban vannak, antigén-specifikus
aktivációjuk a perifériás nyirokszervekben történik.
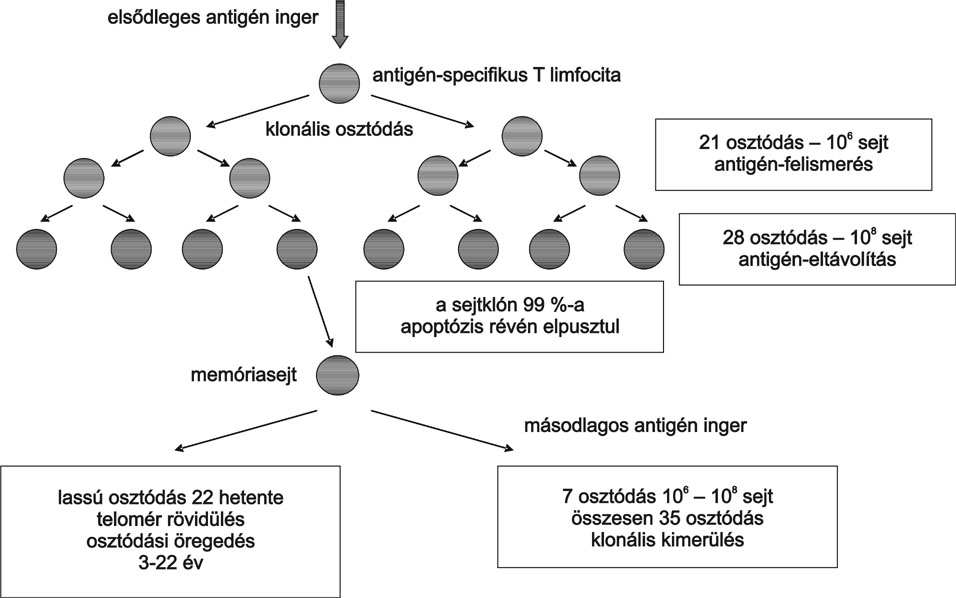 2. ábra * A T-limfociták osztódási szakaszainak vázlatos menete - Az
antigén-specifikus T-limfociták az elsődleges antigén inger hatására gyors
osztódásnak indulnak, aminek eredményeként időlegesen nagymértékben megnő a
kiválasztott sejtek aránya. Az antigén sikeres eltávolítását követően - további
antigén inger hiányában - a feleslegessé vált T-limfociták programozott
sejthalál révén elpusztulnak, csupán néhány memóriasejt marad életben. A
memóriasejtek az antigén ismételt belépésekor gyorsan újra osztódnak, az összes
lehetséges osztódást követően azonban funkcionálisan kimerülnek. Ha a
memóriasejtek újbóli aktivációja nem következik be, azok lassú osztódással
tartósan fennmaradnak, miközben lassan öregszenek (Effros - Pawelec nyomán).
2. ábra * A T-limfociták osztódási szakaszainak vázlatos menete - Az
antigén-specifikus T-limfociták az elsődleges antigén inger hatására gyors
osztódásnak indulnak, aminek eredményeként időlegesen nagymértékben megnő a
kiválasztott sejtek aránya. Az antigén sikeres eltávolítását követően - további
antigén inger hiányában - a feleslegessé vált T-limfociták programozott
sejthalál révén elpusztulnak, csupán néhány memóriasejt marad életben. A
memóriasejtek az antigén ismételt belépésekor gyorsan újra osztódnak, az összes
lehetséges osztódást követően azonban funkcionálisan kimerülnek. Ha a
memóriasejtek újbóli aktivációja nem következik be, azok lassú osztódással
tartósan fennmaradnak, miközben lassan öregszenek (Effros - Pawelec nyomán).
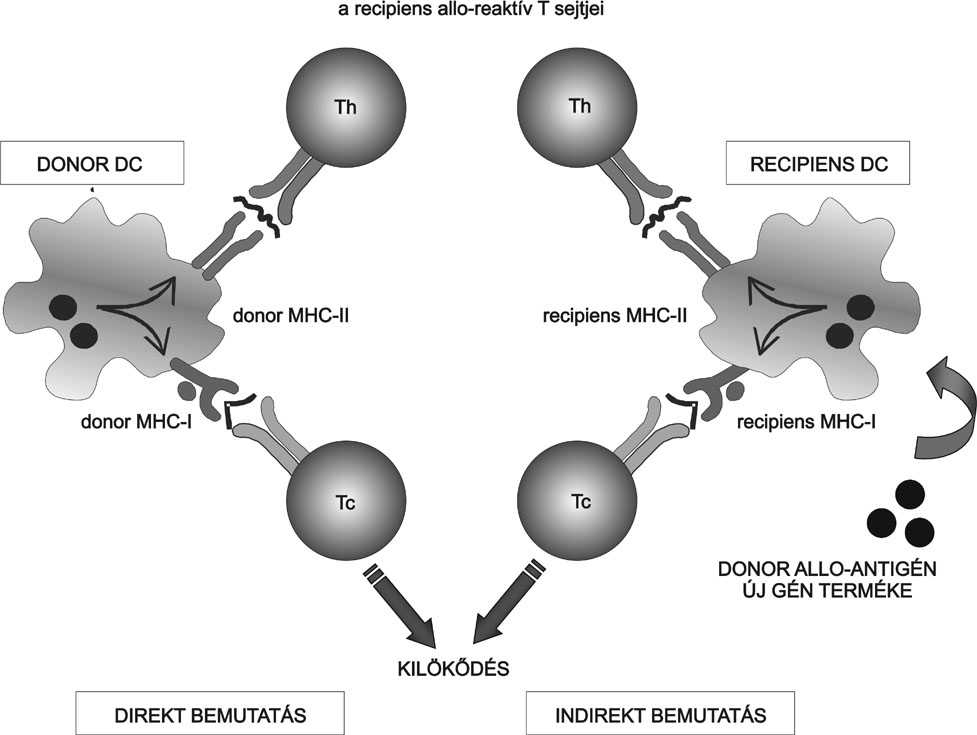 3. ábra * Az allo-graft és a génkorrekcióval módosított sejtek elleni
kilökődési reakcióban szerepet játszó immunológiai folyamatok - Az allogén
testi sejtek beültetésekor a graft testidegen MHC-I molekulákat fejez ki, amit
a befogadó szervezet T-limfocitái felismernek. A II típusú MHC és a
ko-stimulációs molekulák hiányában ez a folyamat nem indítja el a kilökődési
reakciót. A beültetett graft szöveti vagy a vérárammal bekerülő dendritikus
sejtjei azonban nagy számban fejezik ki az I és II típusú MHC, valamint a
kostimuláló molekulákat is, és hatékonyan indítják el a befogadó szervezet
allo-reaktív T-limfocitáinak aktiválódását. Az allo-antigének bemutatásában a
befogadó szervezet saját dendritikus sejtjei úgy vesznek részt, hogy felveszik
az allo-graft elhaló sejtjeit vagy a belőlük felszabaduló allo-antigéneket,
majd a feldolgozott fehérjék peptidjeit bemutatják a T-limfociták számára.
Ebben a folyamatban a segítő Th- és a sejtölő képességgel rendelkező
Tc-limfociták együttműködve vesznek részt. A génkorrekciós terápia során az "új
fehérje" hasonló mechanizmus révén fordíthatja maga ellen az immunválaszt. Ezt
a folyamatot a természetes immunitást - köztük a dendritikus sejteket -
aktiváló "veszélyjelek" nagymértékben elősegítik.
3. ábra * Az allo-graft és a génkorrekcióval módosított sejtek elleni
kilökődési reakcióban szerepet játszó immunológiai folyamatok - Az allogén
testi sejtek beültetésekor a graft testidegen MHC-I molekulákat fejez ki, amit
a befogadó szervezet T-limfocitái felismernek. A II típusú MHC és a
ko-stimulációs molekulák hiányában ez a folyamat nem indítja el a kilökődési
reakciót. A beültetett graft szöveti vagy a vérárammal bekerülő dendritikus
sejtjei azonban nagy számban fejezik ki az I és II típusú MHC, valamint a
kostimuláló molekulákat is, és hatékonyan indítják el a befogadó szervezet
allo-reaktív T-limfocitáinak aktiválódását. Az allo-antigének bemutatásában a
befogadó szervezet saját dendritikus sejtjei úgy vesznek részt, hogy felveszik
az allo-graft elhaló sejtjeit vagy a belőlük felszabaduló allo-antigéneket,
majd a feldolgozott fehérjék peptidjeit bemutatják a T-limfociták számára.
Ebben a folyamatban a segítő Th- és a sejtölő képességgel rendelkező
Tc-limfociták együttműködve vesznek részt. A génkorrekciós terápia során az "új
fehérje" hasonló mechanizmus révén fordíthatja maga ellen az immunválaszt. Ezt
a folyamatot a természetes immunitást - köztük a dendritikus sejteket -
aktiváló "veszélyjelek" nagymértékben elősegítik.
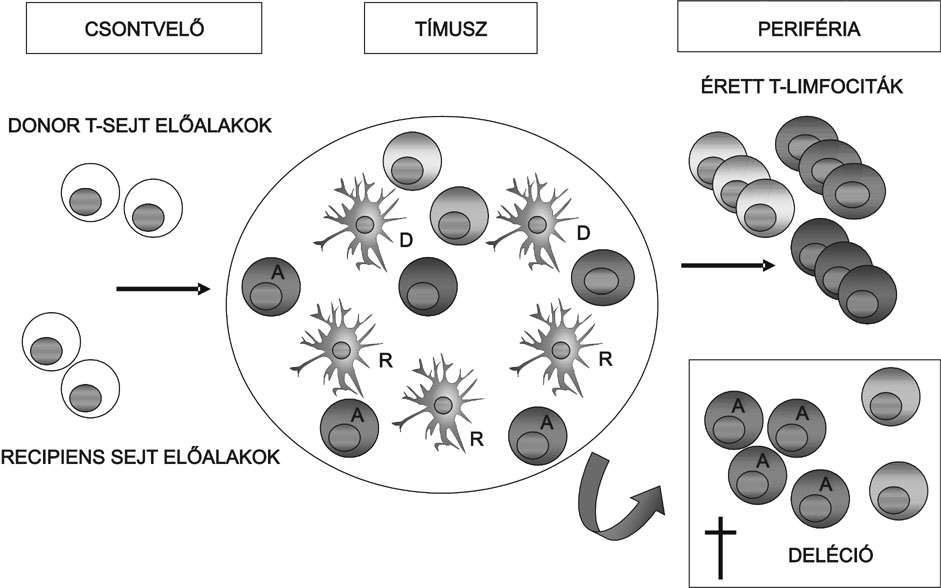 4. ábra * A kevert kiméra állapot szerepe a tolerancia kialakításában - A
"kevert hematopoetikus kiméra" állapot kialakulását követően a tímuszt mind az
allogén donor (D), mind a befogadó szervezet, a recipiens (R) saját dendritikus
sejtjei telepítik be. A donor és a recipiens eredetű csontvelői T-limfocita
előalakok közül mindazok, amelyek a kétféle eredetű dendritikus sejt által
bemutatott fehérjék peptidjeit felismerik, így az allo-reaktív T-limfociták is
(A) a tímuszban zajló negatív szelekciós lépések eredményeként programozott
sejthalállal elpusztulnak (deléció). Így a perifériás nyirokszervekbe és a
keringésbe nem kerülnek ki autoreaktív T-limfociták, ezáltal az ugyanabból a
donorból származó szöveti sejtek allo-antigénjeivel szemben a befogadó
szervezetben hosszú távú tolerancia alakul ki (Bradley et al. alapján).
4. ábra * A kevert kiméra állapot szerepe a tolerancia kialakításában - A
"kevert hematopoetikus kiméra" állapot kialakulását követően a tímuszt mind az
allogén donor (D), mind a befogadó szervezet, a recipiens (R) saját dendritikus
sejtjei telepítik be. A donor és a recipiens eredetű csontvelői T-limfocita
előalakok közül mindazok, amelyek a kétféle eredetű dendritikus sejt által
bemutatott fehérjék peptidjeit felismerik, így az allo-reaktív T-limfociták is
(A) a tímuszban zajló negatív szelekciós lépések eredményeként programozott
sejthalállal elpusztulnak (deléció). Így a perifériás nyirokszervekbe és a
keringésbe nem kerülnek ki autoreaktív T-limfociták, ezáltal az ugyanabból a
donorból származó szöveti sejtek allo-antigénjeivel szemben a befogadó
szervezetben hosszú távú tolerancia alakul ki (Bradley et al. alapján).
Irodalom
Bradley, J. Andrew - Bolton, Eleanor M. - Pedersen, Roger A. (2002): Stem Cell
Medicine Encounters the Immune System. Nature Reviews. Immunology. 2, 859-871
Brown, Brian D. - Lillicrap, David (2002): Dangerous Liaisons: the Role of
“Danger" Signals in the Immune Response to Gene Therapy. Blood. 100, 1133-1140
Effros, Rita B. - Pawalec, Graham (1997): Replicative Senescence of T Cells:
Does the Hayflick Limit Lead to Immune Exhaustion? Immunology Today. 18, 450-454
Erdei Anna (2003): A természetes immunitás hatalma.
Magyar Tudomány. 48, 422-430
Fandrich, Fred et al. (2002): Preimplantation-Stage Stem Cells Induce Long-Term
Allogeneic Graft Acceptance Without Supplementary Host Conditioning. Nature
Medicine. 8, 171-178
Geiger, Hartmut - Van Zant, Gary (2002: The Aging of Lympho-Hematopoietic Stem
Cells. Nature Immunology. 3, 329-333
Gogolák Péter - Réthi B. - Hajas G. - Rajnavölgyi É. (2003: Targeting Dendritic
Cells for Priming Cellular Immune Responses. Journal of Molecular Recognition.
(In Press)
Jiang, Yuehua - Jahagirdar, B. N. - Reinhardt, R. L. - Schwartz, R. E. et al.
(2002): Pluripotency of Mesenchymal Stem Cells Derived from Adult Marrow.
Nature. 418, 41-49
Kaufman, Dan S. - Hanson, E. T. - Lewis, R. L. - Auerbach, R. - Thomson, J. A.
(2001): Hematopoietic Colony-Forming Cells Derived from Human Embryonic Stem
Cells. Proceedings of the National Academy of Sciences of the USA. 98,
10716-10721
Kyba, Michael - Perlingeiro, Rita C. - Daley, George O. (2002): Hoxb4 Confers
Definite Lymphoid-Myeloid Engraftment Potential on Embryonic Stem Cell and Yolk
Sac Hematopoietic Progenitors. Cell. 109, 20-37
Osawa, Mitsujiro - Hamad, K. - Hamada, H. - Nakauchi, H. (1996): Long-Term
Lymphohematopoietic Reconstitution by a Single CD34-Low/Negative Hematopoietic
Stem Cell. Science. 273, 242-245
Pálóczi Katalin (2003): Az immunrendszer újrafejlődése csontvelő-átültetést
követően: az allogén őssejtterápia immunológiai vonatkozásai.
Magyar Tudomány. 48, 477-487
Rajnavölgyi Éva - Lányi Árpád (2003): CD4+ T Lymphocytes in Anti-Tumor
Immunity. Advances in Cancer Research. 87, 195-249
Rajnavölgyi Éva (2003): A dendritikus sejtek és terápiás felhasználási
lehetőségeik.
Magyar Tudomány. 48, 440-450
<-- Vissza a 2004/3 szám tartalomjegyzékére
<-- Vissza a Magyar Tudomány honlapra
[Információk] [Tartalom] [Akaprint Kft.]
 1. ábra * Az immunrendszer működésében részt vevő sejtek fejlődése a
hematopoetikus őssejtekből - A hemopoetikus őssejtekből a csontvelőben mieloid
és limfoid előalakok képződnek. A mieloid sejtek leszármazottai specializált
sejtekké érnek és a vérkeringésbe kerülnek. A vérben keringő dendritikus
sejtek, monociták és granulociták megfelelő ingerek hatására átlépnek az
érfalon, és utódaik a testi szövetekben telepednek le. A limfoid előalakokból a
csontvelőben fejlődnek a B-limfociták, míg a T-limfociták és a természetes
ölősejtek előalakjai a csontvelőből a tímuszba vándorolnak, és
differenciálódásuk ott fejeződik be. A B- és T-limfociták a vér- és a
nyirokkeringés révén örökös körforgásban vannak, antigén-specifikus
aktivációjuk a perifériás nyirokszervekben történik.
1. ábra * Az immunrendszer működésében részt vevő sejtek fejlődése a
hematopoetikus őssejtekből - A hemopoetikus őssejtekből a csontvelőben mieloid
és limfoid előalakok képződnek. A mieloid sejtek leszármazottai specializált
sejtekké érnek és a vérkeringésbe kerülnek. A vérben keringő dendritikus
sejtek, monociták és granulociták megfelelő ingerek hatására átlépnek az
érfalon, és utódaik a testi szövetekben telepednek le. A limfoid előalakokból a
csontvelőben fejlődnek a B-limfociták, míg a T-limfociták és a természetes
ölősejtek előalakjai a csontvelőből a tímuszba vándorolnak, és
differenciálódásuk ott fejeződik be. A B- és T-limfociták a vér- és a
nyirokkeringés révén örökös körforgásban vannak, antigén-specifikus
aktivációjuk a perifériás nyirokszervekben történik.
 2. ábra * A T-limfociták osztódási szakaszainak vázlatos menete - Az
antigén-specifikus T-limfociták az elsődleges antigén inger hatására gyors
osztódásnak indulnak, aminek eredményeként időlegesen nagymértékben megnő a
kiválasztott sejtek aránya. Az antigén sikeres eltávolítását követően - további
antigén inger hiányában - a feleslegessé vált T-limfociták programozott
sejthalál révén elpusztulnak, csupán néhány memóriasejt marad életben. A
memóriasejtek az antigén ismételt belépésekor gyorsan újra osztódnak, az összes
lehetséges osztódást követően azonban funkcionálisan kimerülnek. Ha a
memóriasejtek újbóli aktivációja nem következik be, azok lassú osztódással
tartósan fennmaradnak, miközben lassan öregszenek (Effros - Pawelec nyomán).
2. ábra * A T-limfociták osztódási szakaszainak vázlatos menete - Az
antigén-specifikus T-limfociták az elsődleges antigén inger hatására gyors
osztódásnak indulnak, aminek eredményeként időlegesen nagymértékben megnő a
kiválasztott sejtek aránya. Az antigén sikeres eltávolítását követően - további
antigén inger hiányában - a feleslegessé vált T-limfociták programozott
sejthalál révén elpusztulnak, csupán néhány memóriasejt marad életben. A
memóriasejtek az antigén ismételt belépésekor gyorsan újra osztódnak, az összes
lehetséges osztódást követően azonban funkcionálisan kimerülnek. Ha a
memóriasejtek újbóli aktivációja nem következik be, azok lassú osztódással
tartósan fennmaradnak, miközben lassan öregszenek (Effros - Pawelec nyomán).
 3. ábra * Az allo-graft és a génkorrekcióval módosított sejtek elleni
kilökődési reakcióban szerepet játszó immunológiai folyamatok - Az allogén
testi sejtek beültetésekor a graft testidegen MHC-I molekulákat fejez ki, amit
a befogadó szervezet T-limfocitái felismernek. A II típusú MHC és a
ko-stimulációs molekulák hiányában ez a folyamat nem indítja el a kilökődési
reakciót. A beültetett graft szöveti vagy a vérárammal bekerülő dendritikus
sejtjei azonban nagy számban fejezik ki az I és II típusú MHC, valamint a
kostimuláló molekulákat is, és hatékonyan indítják el a befogadó szervezet
allo-reaktív T-limfocitáinak aktiválódását. Az allo-antigének bemutatásában a
befogadó szervezet saját dendritikus sejtjei úgy vesznek részt, hogy felveszik
az allo-graft elhaló sejtjeit vagy a belőlük felszabaduló allo-antigéneket,
majd a feldolgozott fehérjék peptidjeit bemutatják a T-limfociták számára.
Ebben a folyamatban a segítő Th- és a sejtölő képességgel rendelkező
Tc-limfociták együttműködve vesznek részt. A génkorrekciós terápia során az "új
fehérje" hasonló mechanizmus révén fordíthatja maga ellen az immunválaszt. Ezt
a folyamatot a természetes immunitást - köztük a dendritikus sejteket -
aktiváló "veszélyjelek" nagymértékben elősegítik.
3. ábra * Az allo-graft és a génkorrekcióval módosított sejtek elleni
kilökődési reakcióban szerepet játszó immunológiai folyamatok - Az allogén
testi sejtek beültetésekor a graft testidegen MHC-I molekulákat fejez ki, amit
a befogadó szervezet T-limfocitái felismernek. A II típusú MHC és a
ko-stimulációs molekulák hiányában ez a folyamat nem indítja el a kilökődési
reakciót. A beültetett graft szöveti vagy a vérárammal bekerülő dendritikus
sejtjei azonban nagy számban fejezik ki az I és II típusú MHC, valamint a
kostimuláló molekulákat is, és hatékonyan indítják el a befogadó szervezet
allo-reaktív T-limfocitáinak aktiválódását. Az allo-antigének bemutatásában a
befogadó szervezet saját dendritikus sejtjei úgy vesznek részt, hogy felveszik
az allo-graft elhaló sejtjeit vagy a belőlük felszabaduló allo-antigéneket,
majd a feldolgozott fehérjék peptidjeit bemutatják a T-limfociták számára.
Ebben a folyamatban a segítő Th- és a sejtölő képességgel rendelkező
Tc-limfociták együttműködve vesznek részt. A génkorrekciós terápia során az "új
fehérje" hasonló mechanizmus révén fordíthatja maga ellen az immunválaszt. Ezt
a folyamatot a természetes immunitást - köztük a dendritikus sejteket -
aktiváló "veszélyjelek" nagymértékben elősegítik.
 4. ábra * A kevert kiméra állapot szerepe a tolerancia kialakításában - A
"kevert hematopoetikus kiméra" állapot kialakulását követően a tímuszt mind az
allogén donor (D), mind a befogadó szervezet, a recipiens (R) saját dendritikus
sejtjei telepítik be. A donor és a recipiens eredetű csontvelői T-limfocita
előalakok közül mindazok, amelyek a kétféle eredetű dendritikus sejt által
bemutatott fehérjék peptidjeit felismerik, így az allo-reaktív T-limfociták is
(A) a tímuszban zajló negatív szelekciós lépések eredményeként programozott
sejthalállal elpusztulnak (deléció). Így a perifériás nyirokszervekbe és a
keringésbe nem kerülnek ki autoreaktív T-limfociták, ezáltal az ugyanabból a
donorból származó szöveti sejtek allo-antigénjeivel szemben a befogadó
szervezetben hosszú távú tolerancia alakul ki (Bradley et al. alapján).
4. ábra * A kevert kiméra állapot szerepe a tolerancia kialakításában - A
"kevert hematopoetikus kiméra" állapot kialakulását követően a tímuszt mind az
allogén donor (D), mind a befogadó szervezet, a recipiens (R) saját dendritikus
sejtjei telepítik be. A donor és a recipiens eredetű csontvelői T-limfocita
előalakok közül mindazok, amelyek a kétféle eredetű dendritikus sejt által
bemutatott fehérjék peptidjeit felismerik, így az allo-reaktív T-limfociták is
(A) a tímuszban zajló negatív szelekciós lépések eredményeként programozott
sejthalállal elpusztulnak (deléció). Így a perifériás nyirokszervekbe és a
keringésbe nem kerülnek ki autoreaktív T-limfociták, ezáltal az ugyanabból a
donorból származó szöveti sejtek allo-antigénjeivel szemben a befogadó
szervezetben hosszú távú tolerancia alakul ki (Bradley et al. alapján).