Őssejtek
Kopper László
az orvostudomány doktora, egyetemi tanár
Hajdú Melinda
PhD-hallgató, Semmelweis Egyetem, I. Patológiai és Kísérleti Rákkutató Intézet
Tumorőssejtek
Őssejtek és daganatsejtek
A humán fötális szövetekből olyan embrionális őssejteket lehet izolálni,
amelyek különböző - mindhárom embrionális csíralemezben található -
differenciált sejttípus kialakítására képesek (Thomson et al., 1998). Ennek
felismerése teremtette meg a szövet- vagy szervgyártás gondolatát, számos
etikai problémával együtt. Mérföldkövet jelentett annak igazolása, hogy a már
differenciált szövetekben található ún. szomatikus, vagy felnőtt őssejtek
plasztikusak, azaz nemcsak egy sejtvonal képzésére kötelezték el magukat, hanem
olyan sejtek is differenciálódhatnak belőlük, amelyek adott őssejt eredeti
szövetében nem fordultak elő. Ez a transzdifferenciálódás (például csontvelői
őssejtből májsejt, vesesejt, szívizomsejt, idegsejt stb. kialakulása) (Alison
et al., 2003; Eglitis et al., 1997; Orlic et al., 2001) az eredetitől eltérő
mikrokörnyezetben történik, amikor az új környezet hatására olyan genetikai
program aktiválódik, amely a származási helyen nem működött. Az új környezetet
részben az itt levő sejtek (például sztrómasejtek) által termelt, részben a
sejtek közötti mátrixban található növekedési és/vagy differenciálódási
faktorok jelentik elsősorban. Az ezekkel kialakuló kapcsolat határozza meg az
őssejtben kialakuló programot, amely transzkripciós faktorokon keresztül hozza
meg a sejt döntését - az őssejtek esetében az elhatározást a proliferáció és
differenciáció felé (Preston et al., 2003).
Az őssejtek két alapvető tulajdonsággal rendelkeznek: egyrészt képesek
megújítani önmagukat, másrészt képesek bizonyos sejttípusok vagy sejttípus
kialakítására. A többes szám nem véletlen, hiszen a differenciálódási képesség
lehet totipotens (a megtermékenyített petesejt, a zigóta képes létrehozni az
embriót és a placenta trofoblasztjait), pluripotens (a csíralemezek majd minden
sejtjét), multipotens (bizonyos lokalizációban több sejttípust) és unipotens
(egy sejttípust). Az említett képességek például aszimmetrikus osztódás révén
egy őssejtet és egy differenciálódásra elkötelezett sejtet eredményeznek,
fenntartva így adott szövet egyensúlyát. (Persze az is elképzelhető, hogy két
őssejt vagy két differenciált sejt keletkezzen.) Őssejt valószínűleg minden
szervben található, talán a szív kivételével. A legtöbb szövetben az összes
sejt egy-két százalékát jelentik.
A daganatokkal kapcsolatban már évtizedekkel ezelőtt felvetődött az
őssejtkérdés. Megfigyelték, hogy: a.) az őssejtek és a tumorsejtek hasonló
tulajdonságokkal rendelkeznek korlátlan proliferációs és szövetspecifikus
differenciációs képességük tekintetében; b.) a kolóniaképző (klonogén)
potenciál, az önmegújító képesség és a differenciálódási képesség a tumorsejtek
csak egy meghatározott populációjának jellemzője; és c.) néhány daganatos
sejtben terminális differenciációt - azaz a proliferációs képesség elvesztését
- lehetett előidézni természetes differenciációs faktorokkal vagy exogén
vegyületekkel. Az 1970-es években a vizsgálati rendszereket, zömmel a normális
vérképző (hemopoetikus) őssejtek módszertanát felhasználva, az ún. klonogén
esszék (stem cell assay) - in vitro: például agar-kolónia teszt, in vivo:
lépkolónia-teszt, tüdőkolónia-teszt - jelentették, amelyekkel azt vizsgálták,
hogy a daganatsejtek hányad része képes új daganatsejtcsoport,
daganatsejtkolónia kialakítására. Ezek a módszerek később összefonódtak a
metasztáziskutatással is, hiszen például az intravénásan adott daganatsejtek
által létrehozott tüdőmetasztázisok (mesterséges metasztázisok) a klónképző
képességet és a metasztatizáló képességet egyaránt jelezték. E két jelenség
közötti kapcsolat nyilvánvalóan feltételezhető, ám a kísérletek ezen a szinten
meg is rekedtek.
Hosszúra nyúlna az őssejt és a metasztatizáló sejt közötti hasonlóság elemzése.
Kulcskérdés mindkét esetben a mikrokörnyezet meghatározó szerepe, gondoljunk
például a szervspecifikus metasztázisok problémájára. Különösen kérdésessé
tette a klonogenitási/metasztatizálási vizsgálatokat annak felismerése, hogy a
daganatsejtek vagy a célszerv (vagy az egész szervezet) manipulálásával, azaz a
környezet megváltoztatásával (például besugárzás, immunszuppresszió,
citotoxikus károsítás) a klónképző/metasztázisképző képesség is módosítható. A
rengeteg in vitro és in vivo kísérlet ellenére a tumorban az őssejtek jelenléte
ma is nyitott kérdés.
A normális őssejtek és a daganatsejtek közötti kapcsolatot elsősorban három
szempontból vizsgálhatjuk:
a.) mennyiben hasonló vagy eltérő az őssejtek és a daganatsejtek önmegújító
képességének szabályozása;
b.) keletkeznek-e daganatsejtek őssejtekből;
c.) léteznek-e daganatos őssejtek?
Az önmegújító képesség szabályozása
Az őssejtek szabályozottan újulnak meg és szolgálnak a differenciált sejtek
forrásául, biztosítva az adott igények között az adott szövet szerkezetéhez és
funkciójához szükséges sejtmennyiséget. Az őssejtek azonban nem egyformák. A
csontvelőben számos őssejttípus található (hosszú életű hemopoetikus őssejt,
rövid életű hemopoetikus őssejt, multipotens progenitorsejtek), amelyek
lépcsőzetesen egyre kevesebb sejttípus kialakulásáért felelősek, egyben - ahogy
nevük is jelzi - az élettartamuk is eltérő. Bár a különböző őssejtek
fenotípusát elég jól ismerjük, a szabályozásukról keveset tudunk.
Mivel a daganatsejtek is rendelkeznek önmegújító képességgel, ezért valószínű,
hogy ennek szabályozása hasonló az őssejtekéhez. A végtelenített önmegújító
képességet (halhatatlanságot, immortalizációt) számos, eddig csak részleteiben
ismert mechanizmus biztosítja. Az egyik a telomeráz aktivitása, amely
meggátolja a kromoszómák osztódások során bekövetkező rövidülését és a kritikus
hossz elérése után a sejt pusztulását. Ilyen vagy hasonló mechanizmus
elengedhetetlen az őssejtek számára, de a daganatok kialakulásában is fontos
szerephez juthat. Valóban, a daganatok jelentős részében magas telomeráz
aktivitást lehet kimutatni. (Ez természetesen általánosítás, hiszen - sajnos
nagyon ritkán - előfordulhat, hogy a daganatsejtek nem növekednek tovább, hanem
differenciálódnak, sőt a daganat spontán visszafejlődhet. Igaz, utóbbinak lehet
egészen más oka is, például a vérellátás elégtelensége.) A másik fontos
szabályozási lépés a túlélés biztosítására az apoptózis gátlása, különösen
azokban a sejtrendszerekben, amelyekben a keletkezett sejtek túlélési jelek
nélkül elpusztulnak (mint például a limfoid rendszer). Ebből a szempontból
példa a BCL-2 túltermelése, amit számos - közöttük igen sok szolid - daganatban
megfigyeltek. (Elsők között a follikuláris limfómákban, a t:14,18 transzlokáció
következtében írták le.) Kiderült, hogy a magas BCL-2 expresszió a hemopoetikus
őssejtek számát is növeli (Domen et al., 2000). Ma már tudjuk, hogy a különböző
sejtekben igen sokféle antiapoptotikus stratégia érvényesülhet, amelynek csak
egyik - bár igen fontos - tagja a BCL-2 és rokonsága. Az apoptózis gátlása a
szabályozás szintjén szorosan összekapcsolódik a sejt túlélését meghatározó
programmal, a különböző túlélési tényezőkkel (például AKT). Ezek túltermelése
éppen az apoptózis gátlásán keresztül vezethet adott sejt és leszármazottainak
halhatatlansághoz, akkor is, ha ez a sejt normális körülmények között ezt a
képességét elvesztette (volna). Nem kétséges, hogy túlélési jelekre a normális
őssejteknek is szükségük van.
A daganatok keletkezésével kapcsolatba hozott más jelutak is szerepet
játszhatnak az őssejtek szabályozásában: például a Notch, a Sonic hedgehog
(SHH) és a WNT jelutak (Reya et al., 2001). Feltételezik, hogy ezek hibái
(mutációi) számos daganat kialakulásában szerepet játszanak. E jelutak
jelentősége a hemopoetikus őssejtek önmegújításában bizonyítottnak tekinthető,
sőt egyre több adat szól amellett, hogy más sejttípusok őssejtjeit is
szabályozzák. Egy nemrégiben felfedezett protoonkogénről, a Bmi-1-ről pedig
kimutatták, hogy működése éppúgy szükséges a normális hematopoetikus őssejtek
proliferációjához, mint a proliferáló leukémiás sejtkészlet fenntartásához
(Lessard et al., 2003).
Ezen említett jelátviteli utak (Notch, Hedgehog, WNT) az evolúció során
nagymértékben konzerválódott mechanizmusoknak tekinthetők. Alsóbbrendű
élőlényekben (Drosophila, C. elegans) - itt fedezték fel őket - a morfogenezist
befolyásolják. Emlősökben a fejlődés különböző stádiumaiban levő sejtalakok
proliferációját és differenciációját szabályozzák, biztosítva az egyensúlyt az
őssejtek és a progenitor sejtek, illetve az érett alakok között. (Természetesen
arról nincs szó, hogy más jelutak ne működnének, csak éppen ezeket
előszeretettel hozzák kapcsolatba az őssejtekkel.)
WNT-jelút. Fontos tényező a sejt sorsának szabályozásában. A sejtfelszínről a
sejtmagba szállítja a jeleket, ehhez b-kateninre van szüksége. Ha nincs
megfelelő jel (például hiányzik a ligand vagy a receptor), akkor egy komplex
(axin, APC - adenomatosus polyposus coli gén terméke, és a glikogén szintáz
kináz 3 b együttese) lebontásra ítéli a b-katenint. A WNT-jel jelenlétében ez a
komplex inaktiválódik, a b-katenin bejut a sejtmagba, és egy DNS-hez kötődő
fehérje segítségével aktiválja a megfelelő célgéneket. A WNT-b-katenin út
hibáit számos daganat esetében a kialakulás és/vagy a progresszió szempontjából
fontos tényezőnek tartják. Például transzgén egerek epidermális őssejtjeiben
mutatták ki, hogy a WNT-jelút folyamatos aktiválása daganat kialakulásához
vezethet. A b-katenin egyik partnerfehérjéjének, a TCF-4-nek (T-cell factor-4)
aktiválását a vastagbélrák keletkezéséhez vezető szabályozási zavar korai
eseményének tekinthetjük. A TCF-4-et kódoló TCF712 gén hiányában nem sikerül
fenntartani a bolyhokat "tápláló" kripták proliferatív kompartmentjét, ami azt
jelenti, hogy a TCF-4 a normál bélben részt vesz a kriptában levő őssejtek
működésének szabályozásában.
Notch-jelút. A Notch-családba négy sejtfelszíni receptor és legalább öt
sejtfelszíni ligand tartozik. A ligand bekötődésekor a receptor proteolitikusan
hasad, és az intracelluláris domén a sejtmagba transzlokálódik. Ott a CBF-1
(C-Promoter Binding Factor-1) fehérjével komplexet képezve transzkripciós
aktivátorként működik. Legismertebb célgénjei a HES-családba tartoznak
(Hairy/Enhancer of Split). A HES-gének által kódolt fehérjék olyan bázikus
helix-loop-helix transzkripciós faktorok átíródását gátolják, amelyek a sejtek
differenciálódását szabályozzák. A Notch-jel részt vesz abban a döntésben, hogy
a progenitor sejtek mekkora része kötelezze el magát egy megadott fejlődési
irányba és mekkora része maradjon elkötelezetlen, egyben alkalmas arra, hogy
különböző sejttípusok differenciálódjanak belőle (Kojika et al., 2001). Szerepe
van a neurális őssejtkészlet szabályozásában (Preston et al., 2003). A
hematopoetikus rendszer különböző fejlődési stádiumban lévő sejtjén
megtalálhatók a Notch-receptorok és -ligandok, befolyásolva többek között a
hematopoetikus őssejtkészlet fenntartását és a T lymphocyták
differenciálódását. A Notch-rendszer kóros működése - eddigi ismereteink
szerint - T sejtes leukémiák és emlőtumorok kialakulásáért lehet felelős
(Kojika et al., 2001).
Hedgehog-jelút. A Hedgehog jelátviteli út az ontogenezis során a korai
mesoderma fejlődéséért felelős. Az utat a molekula aktiválhatja sejt-sejt
kapcsolat révén és szolubilis ligandként is. Receptora a Ptc (Patched),
amelyhez valószínűleg az Smo (Smoothed) fehérje is kapcsolódik. Ligand
hiányában a Ptc a Smo-t gátolja, míg ligandkötéskor ez a gátlás megszűnik. A
Smo aktivációja olyan folyamatokat indít el, amelyek során a Gli családba
tartozó transzkripciós faktorok aktiválódnak, és a Ptc, a WNT, valamint a
Noggin - a TGF-b szupercsaládba tartozó BMP-4 (bone morphogenetic protein)
gátló fehérjéje - transzkripcióját módosítják (Bhardwaj et al., 2001).
Emlősökben a Sonic hedgehog a BMP-4 molekulán keresztül a primitív
hematopoetikus sejtek proliferációját szabályozza (Bhardwaj et al., 2001). A
jelátviteli út hibája medulloblastoma és basalsejtes carcinoma patogenetikai
tényezője lehet.
Fentiek arra szolgáltatnak példákat, hogy az őssejtek és a daganatsejtek
döntéseiben hasonló szabályozási elemek vehetnek részt. Mindez persze csak
nagyon indirekt bizonyíték arra, hogy a daganatsejtek és az őssejtek igen
közeli "rokonok" lennének.
Daganatsejtek őssejtekből
Ha a szabályozásban találhatunk közös utakat, és ezeknek az utaknak a hibája a
daganatkialakulásban a felhalmozódó génhibák között fontos tényező lehet, akkor
felvetődik a kérdés: nem az őssejtekből alakulnak-e ki a daganatok? Az egyik
érv az igenlő válasz mellett az, hogy az őssejtek már rendelkeznek az
önmegújítás képességével, így valószínűleg "egyszerűbb" ezt a képességet
megtartani, mint egy már differenciált sejtben a halhatatlanság programját újra
aktiválni. A másik érv szerint az őssejtek sokkal hosszabb életűek, mint a
differenciált sejtek, ezért sokkal könnyebben "gyűjtik össze" - sokszor
éveken vagy évtizedeken keresztül tartó expozíció során - a szabályozás
csődjéhez vezető génhibákat. Nem kizárható természetesen, hogy a korlátozottabb
képességű progenitorsejtek a karcinogenezis célsejtjei, de ebben az esetben a
szabályozóutak aktiválásával meg kell szerezniük az őssejtekhez hasonló
önmegújító képességüket, bár ezt - génhiba formájában - örökül is kaphatják az
őssejtektől.
A vérképző rendszerben mindkét lehetőségre van példa, arra is, hogy az őssejt,
és arra is, hogy a progenitorsejt a daganatkeletkezés célpontja.
Az AML egyik gyakori kromoszóma-rendellenessége a t:8,21, amelynek
eredményeként a leukémiás sejtekben AML1-ETO fehérjék jelennek meg.
Remisszióban levő beteg normális csontvelői hemopoetikus őssejtjeiben is ki
tudták mutatni ezt a génhibát. Sem ezek az őssejtek, sem leszármazottjaik nem
voltak leukémiásak, és in vitro normális mieloeritroid sejtekké
differenciálódtak (Miyamoto et al., 2000). Ez azt is jelentheti, hogy a
normális őssejtek már rendelkeztek ezzel a mutációval, de további mutációkra
volt szükség a leukémia kialakulásához. Ebben a vizsgálatban a normális
hemopoetikus őssejtek fenotípusa CD34+CD38-Thy-1+ volt, míg a leukémiás
blasztoké CD34+ CD38-Thy-1-. Eszerint a leukémiás transzformáció vagy a Thy-1-
progenitorsejtek után történt, vagy az őssejtek vesztették el Thy-1 expresszáló
képességüket.
A génhibák progenitorsejtben való felhalmozódására példa az a kísérlet,
amelynek során a myeloid progenitorsejtek expresszióját befolyásolták hMRP-8
promoterrel. Ha ezekben a transzgén egerekben a BCL-2 fokozott expresszióját
idézték elő, akkor hasonló kórkép alakult ki, mint a krónikus myelomocitás
leukémia, de akut leukémia nem. Ha viszont ehhez a FAS expresszió elégtelensége
is társult (azaz mindkét apoptózisút hibássá vált, s ezért a sejtek nem tudtak
elpusztulni), az egerek 15 %-ában AML alakult ki (Traver et al., 1998). (A 15 %
kétségtelenül bizonyító erejű, ám azt nem tudjuk, hogy a fennmaradó 85 %-ban
milyen további változások vezetnének AML-hez. Mindebből még azt a
következtetést is levonhatjuk, hogy a molekuláris eseményeket illetően egyre
több adattal rendelkezünk; a sejtszintű válaszról, kölcsönhatásaikról, az ennek
nyomán - akár in vitro is - kialakuló heterogenitásról még keveset tudunk.)
Ebbe a kérdéskörbe tartozhat például a metaplázia jelensége is, amely
rendszerint krónikus szövetkárosítás és regeneráció következménye, és a
differenciálódás programjának megváltozását jelenti. Feltételezhető, hogy ez a
változás a megváltozott környezeti tényezők hatására az adott szövetet vagy
sejttípust fenntartó őssejtekben jön létre. A programváltást előidéző károsító
tényezők (ilyen például a dohányzás a légutakban: a csillószőrös
hengerhámsejtek helyett laphámsejtek differenciálódnak) az őssejtekben további
génhibákat indukálva vezetnek a daganatsejtek megjelenéséhez.
Daganatőssejtek
A daganatot olyan abnormis szövetnek tekinthetjük, amely egy sejtből és
leszármazottaiból alakul ki a génhibák folyamatos felhalmozódása és különböző
epigenetikai változások következtében. Ez a szövet különböző differenciáltságot
mutató, fenotípusosan heterogén sejtekből áll. (Persze a heterogenitás mindig
attól függ, hogy milyen paraméterek szempontjából vizsgáljuk.) Míg azonban a
normális őssejtekben szabályos az organogenezis programja, ez a
daganatsejtekben hibás. Ennek ellenére a hasonlóság felveti azt a kérdést, hogy
a daganatban minden sejt rendelkezik-e a "szövetet létrehozó" képességgel vagy
nem, azaz vannak-e daganatos őssejtek vagy nincsenek. (Itt most nem említjük a
daganatok progresszióját meghatározó olyan tényezőket, amelyek alapvetően
befolyásolják a beteg sorsát, és amelyekkel kapcsolatban hasonló kérdéseket
lehet feltenni: például minden daganatsejt alkalmas-e metasztázisok
létrehozására, vagy csak bizonyosak, és ha az utóbbi az igaz, akkor milyen
geno- és/vagy fenotípusos változások biztosítják ezt a képességet. A tárgynál
maradva: őssejtek-e a metasztázisokat létrehozó sejtek?)
Egér myeloma multiplex és leukémiasejtekkel kapcsolatban figyelték meg először
azt, hogy in vitro a rosszindulatú sejteknek csak egy kis része (1:10000-1:100)
képes nagyfokú proliferációra, azaz lágy agarban kolóniaképzésre. Az in vivo
vizsgálatok is azt mutatták, hogy a transzplantált leukémiás sejteknek csak
egy-négy százaléka hoz létre lépkolóniát (Reya et al., 2001). Ennek a
jelenségnek természetesen két magyarázata lehet: vagy az összes daganatsejt
rendelkezik tumort létrehozó képességgel, de adott körülmények között (agarban,
lépben) ez a tulajdonság csak a sejtek bizonyos részében jelenik meg, vagy
pedig a daganatos sejteknek csak meghatározott hányada rendelkezik korlátlan
proliferációs potenciállal.
Humán AML esetében azt találták, hogy a leukémiás sejtek között valóban létezik
valamilyen hierarchia. Kimutatták, hogy az immunhiányos NOD/SCID (non-obese
diabetic/severe combined immunodeficient) egerekbe transzplantált humán
AML-sejteknek csak a CD34+CD38- populációja képes a betegséget átvinni a
recipiensekbe. A következtetés: ebben az AML-sejteknek mindössze 0,2 %-át
alkotó populációban halmozódnak fel a leukémiát "létrehozni" képes sejtek (Reya
et al., 2001).
A hemopoetikus eredetűekhez hasonlóan a szolid tumorok is heterogének, és
sejtjeik klónképző képessége ugyancsak alacsony. Erre vonatkozóan ugyancsak
rengeteg "klasszikus" adattal rendelkezünk. Ebben az esetben - in vivo
vizsgálatok esetén - a heterogenitás azonban nemcsak a daganatsejtek közötti
fenotípusos különbözőségeket jelenti, hanem azt is, hogy a daganatban a
daganatsejtek mellett stromasejtek is jelen vannak, sokszor elég nagy számban.
Egy újabb kísérlet során emlőrákos szövetekben sikerült egy olyan
sejtpopulációt elkülöníteni, amelyben feldúsulnak a tumorképzésre képes sejtek.
A daganatszövetből többféle fejlődési vonalra jellemző markerek segítségével
eltávolították a normális sejteket, majd a visszamaradt sejteket fenotipizálták
CD44, CD24 (adhéziós molekulák), B38.1 (emlő- és ováriumrákokra specifikus
marker) és ESA (17-1A, epitel-specifikus antigén, adhéziós molekula)
segítségével, a különböző fenotípusú sejteket pedig NOD/SCID egerekbe oltották.
Tumorképzésre csak a populáció két százalékát kitevő ESA+CD44+CD24- sejtek
voltak képesek. Ezek a sejtek több passzázs után sem vesztették el tumorigén
képességüket, az átoltás után létrejött daganat fenotípusos heterogenitása
pedig az eredeti tumorhoz volt hasonló. Az ettől eltérő fenotípusú sejtek
elenyészően kis százalékban tudtak daganatot létrehozni a recipiensekben. A
tumorigén potenciállal rendelkező és nem rendelkező sejtek morfológiai alapon
nem voltak elkülöníthetők (Dick, 2003).
Az őssejtek a daganatterápia területén is ígéretes lehetőségeket rejtenek
magukban, amelyeket talán hasznosíthatunk a jövőben. Károsodott sejteket,
szöveteket lehetne velük pótolni - ahogy azt a vérképző elemek esetében már
régóta teszik a hematopoetikus őssejtátültetéssel -, de fel lehetne használni
őket arra is, hogy a tumorba anyagot juttassanak, legyen az citotoxikus
gyógyszer vagy a daganatsejtekre ható, génterápiával modulált termék. A
neurális őssejtek esetében figyelték meg, hogy kiterjedt migrációs képességgel
rendelkeznek. Állatkísérletekben ezek az őssejtek a nagy malignitású
agydaganat, a glioblastoma multiforme köré vándorolnak a normál szöveteken
keresztül, és ott stabilan expresszálják a bevitt transzgén terméket.
Valószínű, hogy a tumorőssejtek létére csak olyan kísérleti rendszerek
szolgáltathatnak meggyőző bizonyítékot, amelyek az egyes sejtek szintjén
képesek vizsgálni a tumorképző képességet. Ez egyelőre nehéz feladatnak tűnik,
de a normális őssejtek geno- és fenotípusának egyre jobb megismerése reményekre
jogosít a daganatok tekintetében is. Ezt a kérdést azért is el kellene dönteni,
mert alapvetően befolyásolhatja a daganatok kezelését. Ha ugyanis léteznek
daganatos őssejtek, akkor csupán ezeket kell kiirtani, hisz a többi daganatsejt
korlátozott proliferációs képességgel, élettartammal rendelkezik. A probléma
"csak az", hogy a daganat progressziója során őssejtképességekkel rendelkező
sejtek állandóan keletkezhetnek, ezek azonosítása, de főként kialakulásuk
megakadályozása nem kis kihívás. A terápiának azt is figyelembe kellene vennie,
hogy az őssejtfunkcióhoz megfelelő mikrokörnyezetre van szükség, így ennek
megváltoztatása, a daganatsejtek számára előnytelen "talaj" biztosítása
(gondoljunk Stephen Paget elméletére: seed and soil) a daganatnövekedés gátja
lehet.
Kulcsszavak: őssejt, tumor
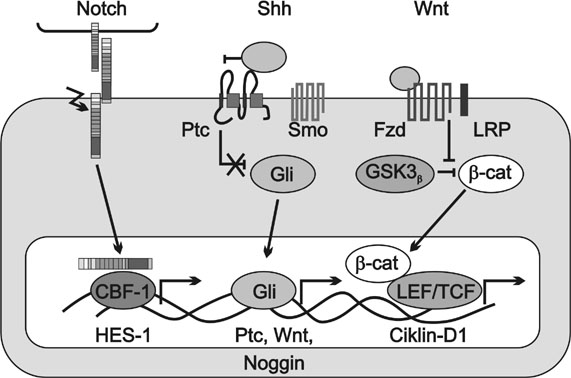 1. ábra * A Notch, a Sonic hedgehog és a WNT jelátviteli utak. Ezek a
mechanizmusok fontos szerepet játszanak az őssejt-proliferáció, a
differenciáció során. Ha a jelátviteli utak szabályozása felborul, a
daganatkeletkezés tényezői lehetnek. (Shh - Sonic hedgehog; CBF-1 - C-Promoter
Binding Factor; HES-1 - Hairy/Enhancer of Split-1; Ptc - Patched; Smo -
Smoothed; Gli - Gli transzkripciós faktorok, Fzd - Frizzled, a WNT receptora;
LRP - low density lipoprotein receptor-related protein; GSK3b -
glikogénszintáz-kináz 3 b; b-cat. - b-catenin; LEF - lymphocyte
enhancer-binding factor; TCF - T-cell factor.)
1. ábra * A Notch, a Sonic hedgehog és a WNT jelátviteli utak. Ezek a
mechanizmusok fontos szerepet játszanak az őssejt-proliferáció, a
differenciáció során. Ha a jelátviteli utak szabályozása felborul, a
daganatkeletkezés tényezői lehetnek. (Shh - Sonic hedgehog; CBF-1 - C-Promoter
Binding Factor; HES-1 - Hairy/Enhancer of Split-1; Ptc - Patched; Smo -
Smoothed; Gli - Gli transzkripciós faktorok, Fzd - Frizzled, a WNT receptora;
LRP - low density lipoprotein receptor-related protein; GSK3b -
glikogénszintáz-kináz 3 b; b-cat. - b-catenin; LEF - lymphocyte
enhancer-binding factor; TCF - T-cell factor.)
Irodalom
Alison, M. R. Poulsom, R. Jeffery, R., Dhillon A. P. Quaglia, A. Jacob, J.,
Novelli, M. Prentice G. Williamson J. - Wright N. A. (2000): Hepatocytes from
Non-hepatic Adult Stem Cells. Nature 406, 257
Bhardwaj, G., Murdoch, B., Wu, D., Baker, D. P.-., Williams, K. P., Chadwick,
K. Ling, L. E. Karanu, F. N. Bhatia, M. (2001): Sonic Hedgehog Induces the
Proliferation of Primitive Human Hematopoietic Cells via BMP Regulation.Nature
Immunology. 2, 172-180
Dick, E. (2003) Breast Cancer Stem Cells Revealed. Proceedings of the National
Academy of Sciences of the USA. 100, 3547-3549
Domen, Jos - Weissman I. L. (2000): Hematopoietic Stem Cells Need Two Signals
to Prevent Apoptosis; BCL-2 Can Provide One of These, Kit/C-Kit Signaling the
Other. Journal of Experimental Medicine. 192, 1707-1718
Eglitis, M. A. - Mezey Éva (1997): Hematopoietic Cells Differentiate into Both
Microglia and Macroglia in the Brains of Adult Mice. Proceedings of the
National Academy of Sciences of the USA. 94, 4080-4085
Hitoshi, S. Alexson, T. Tropepe, V. Donoviel, D. Elia, A. J. Nye, J. S. Conlon,
R. A. Mak, T. W. Bernstein, A. Kooy D. (2002): Notch Pathway Molecules Are
Essential for the Maintenance, But Not the Generation, of Mammalian Neural Stem
Cells. Genes and Development. 16, 846-858
Kojika, S. Griffin, J. D. (2001) Notch Receptors and Hematopoiesis.
Experimental Hematology. 29, 1041-1052
Lessard, . Sauvageau, Guy (2003): Bmi-1 Determines the Proliferative Capacity
of Normal and Leukaemic Stem Cells. Nature 423, 255-260
Miyamoto, T. Weissman, I. L. Akashi, Koichi (2000): AML1/ETO Expressing
Nonleukemic Stem Cells in Acute Myelogenous Leukemia With 8;21 Chromosomal
Translocation. Proceedings of the National Academy of Sciences of the USA 97,
7521-7526
Orlic, D., Kajsturo, J., Chimenti, S., Jakoniuk, I., Anderson, S. M., Li, B.,
Pickel, J. - Mckay, R., Nadal-Ginard, B., Bodine, D. M., Leri, A. And Anversa,
P. (2001): Bone Marrow Cells Regenerate Infarcted Myocardium. Nature 410,
701-704
Preston, S. L., Alison, M. R., Forbes, S. J., Direzke, N. C., Poulsom, R.
Wright, N. A.(2003): The New Stem Cell Biology: Something for Everyone. Journal
of Clinical Pathology - Molecular Pathology. 56, 86-96
Reya, T., Morrison, S. J., Clarke, M. F. - Weissman, I. L. (2001): Stem Cells,
Cancer, and Cancer Stem Cells. Nature 414, 105-111
Spradling, A., Drummond-Barbosa, D. Kai, Toshie (2001): Stem Cells Find Their
Niche. Nature 414, 98-104
Thomson, J. A., Itskovitz-Eldor, J., Shapiro, S. S., Waknitz, M. A., Swiergiel,
J. J., Marshall, V. S. - Andjones, J. M. (1998): Embryonic Stem Cell Lines
Derived from Human Blastocysts. Science 282, 1145-1147
Traver, D., Akashi, K., Weissman, I. L. Lagasse, E. (1998): Mice Defective in
Two Apoptosis Pathways in the Myeloid Lineage Develop Acute Myeloblastic
Leukemia. Immunity 9, 47-57
<-- Vissza a 2004/3 szám tartalomjegyzékére
<-- Vissza a Magyar Tudomány honlapra
[Információk] [Tartalom] [Akaprint Kft.]
 1. ábra * A Notch, a Sonic hedgehog és a WNT jelátviteli utak. Ezek a
mechanizmusok fontos szerepet játszanak az őssejt-proliferáció, a
differenciáció során. Ha a jelátviteli utak szabályozása felborul, a
daganatkeletkezés tényezői lehetnek. (Shh - Sonic hedgehog; CBF-1 - C-Promoter
Binding Factor; HES-1 - Hairy/Enhancer of Split-1; Ptc - Patched; Smo -
Smoothed; Gli - Gli transzkripciós faktorok, Fzd - Frizzled, a WNT receptora;
LRP - low density lipoprotein receptor-related protein; GSK3b -
glikogénszintáz-kináz 3 b; b-cat. - b-catenin; LEF - lymphocyte
enhancer-binding factor; TCF - T-cell factor.)
1. ábra * A Notch, a Sonic hedgehog és a WNT jelátviteli utak. Ezek a
mechanizmusok fontos szerepet játszanak az őssejt-proliferáció, a
differenciáció során. Ha a jelátviteli utak szabályozása felborul, a
daganatkeletkezés tényezői lehetnek. (Shh - Sonic hedgehog; CBF-1 - C-Promoter
Binding Factor; HES-1 - Hairy/Enhancer of Split-1; Ptc - Patched; Smo -
Smoothed; Gli - Gli transzkripciós faktorok, Fzd - Frizzled, a WNT receptora;
LRP - low density lipoprotein receptor-related protein; GSK3b -
glikogénszintáz-kináz 3 b; b-cat. - b-catenin; LEF - lymphocyte
enhancer-binding factor; TCF - T-cell factor.)