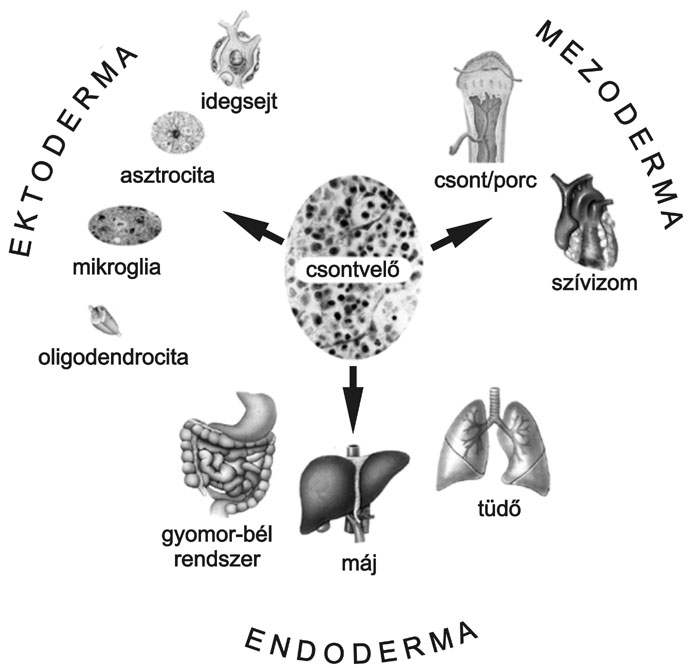
 1. ábra * Az ábra az új adatok alapján összefoglalt lehetőségeket szemlélteti,
melyben a csontvelőből különböző - fejlődéstanilag más dermatomából származó -
szövetek is képződhetnek.
1. ábra * Az ábra az új adatok alapján összefoglalt lehetőségeket szemlélteti,
melyben a csontvelőből különböző - fejlődéstanilag más dermatomából származó -
szövetek is képződhetnek.
"...több vagyok a soknál, mert az őssejtig vagyok minden ős" József Attila
Az utóbbi években mind a tudományos, mind a népszerűsítő irodalomban nap mint nap hallunk az őssejtekről és a velük kapcsolatos reményeinkről. Mi is az őssejt? A megtermékenyített petesejt osztódása után alakul ki a blasztocita, egy sejtekkel körülvett üreg, melynek egyik pólusán lévő sejttömegből lesz az embrió. Ez a sejtmassza embrionális őssejtekből áll, melyeket totipotensnek képzelünk. Ez azt jelenti, hogy ezekből az őssejtekből bármilyen szövet kialakulhat. Az embrionális fejlődés során három sejtréteg alakul ki: a külső ektoderma sejtjei a bőrt és az idegrendszert fogják létrehozni; a középső sejtrétegből (mezoderma) képződik majd a csontrendszer, az izmok, és a vérképző rendszer; a belső (endoderma) sejtréteg pedig a gasztrointesztinális rendszert és a tüdőket fogja kialakítani. A három dermalis rétegben lévő őssejtek "multipotensek", ami azt jelenti, hogy az adott dermális határokon belül képesek bármilyen sejtté alakulni. Eddig azonban úgy hittük, hogy ezek a sejtek a "dermális" határokat sosem léphetik át: egy izomsejtből soha nem lehet már bélsejt és fordítva. Őssejteket nemcsak a fejlődésben lévő, hanem a felnőtt, kifejlett organizmusokban is találunk. Tekintettel arra, hogy tudjuk, hogy szöveteink regenerálódnak, az őssejtek jelenléte felnőtt szervezetben önmagában nem meglepő. Régóta tudjuk, hogy a vérsejtek folyamatosan újraképződnek a csontvelőben lévő differenciálatlan sejtekből. Egészen az utóbbi időkig azonban úgy hittük, hogy a felnőtt szervezetben lévő szöveti őssejtek csak az adott szövet sejtjeit képesek újratermelni - így differenciálódási lehetőségük jóval szűkebb a dermális őssejtekénél.
Az elmúlt négy évben azonban sok adat látott napvilágot különböző tudományos folyóiratokban, melyek arra mutattak, hogy a természet nem minden esetben követi a fejlődéstanban megtanult szigorú szabályokat. Az új elképzelésnek, hogy felnőtt szöveti őssejtek képesek teljesen új irányba differenciálódni és áttörni a dermális gátat, sok támogatója és ellenzője van a szakmában. A jelenséget transzdifferenciálódásnak nevezték el, ami tehát azt jelenti, hogy például egy ektodermális szöveti őssejt környezeti hatásra képes olyan szöveti sejtté differenciálódni, amely a fejlődés során nem ektodermából (hanem mesodermából vagy endodermából) származott (1. ábra).
Az új teóriát ellenzők körébe tartoznak azok, akik az embrionális őssejtek terápiás felhasználásán dolgoznak - mivel ha igaznak bizonyul az, hogy szöveti (felnőtt) őssejtek használhatók regenerációra, az embrionális őssejtkutatás politikai és tudományos támogatása jelentősen csökkenne. Itt mindenekelőtt szeretnénk megjegyezni, hogy az őssejtek (bármilyen eredetűek is legyenek) terápiás felhasználása még egyáltalában nem bizonyított. Jelenleg nincs rá megbízható tudományos adat, hogy bármilyen őssejt képes pótolni sérülés vagy betegség következtében elpusztult szövetet, és így egyetlen fajta őssejt sem látszik jobbnak a többinél. Az embrionális őssejtkutatás tehát éppúgy megérdemli a támogatást, mint a szövetspecifikus felnőtt szervezetben található őssejteké. Az utóbbiakkal kapcsolatos kutatás azonban még gyerekcipőben jár - alapos tanulmányozásuk csupán néhány éve kezdődött meg.
Aki a szakmai irodalmat olvassa, nehezen igazodik el az adatokban, melyek a felnőtt őssejtek differenciálódási lehetőségeit vizsgálják. A zavarosság oka részben az, hogy különböző kutatócsoportok különböző oldalról közelítik meg a problémát, és a kép még nem állt össze. A kérdések közül a legfontosabbak egyike, hogy előfordul-e fiziológiásan transzdifferenciálódás. Vajon a vizsgált őssejtek átprogramozódnak-e, vagy a bennük lévő genetikus anyag összeolvad egy meglévő (már differenciált) sejt magjával, és ez a magfúzió a magyarázata a sejt karakterváltozásának? Akár a transzdifferenciálódás, akár a fúzió előfordul-e olyan mértékben, aminek terápiás haszna lehet, és ha igen, tudjuk-e a folyamatot irányítani?
A fenti kérdések tükrében nézzük meg a csontvelőben található őssejteket. Ezek a sejtek a legújabb adatok szerint nemcsak a vérsejteket képezik újra, hanem képesek minden szövet sejtjeihez hozzájárulni - beleértve az agyat is. Ezt úgy bizonyították be, hogy egerekbe kétféle csontvelősejtet fecskendeztek be: vagy olyan őssejteket, melyekhez genetikusan zöld fluoreszcens festéket kötöttek (Brazelton, 2000); vagy nőstény állatba hím állatból származó csontvelőt juttattak, és az Y kromoszómát használták nyomkövetésre (Mezey, 2000). A genetikusan jelölt sejtekkel potenciálisan problematikus lehet, hogy a nyomkövetésre használt zöld fluoreszcens festék expressziója nem stabil (Mezey, 2003). Az Y kromoszóma igen megbízható marker, azonban technikailag nehéz a vizualizálása, valamint az Y kromoszómát tartalmazó sejtek karakterének egyidejű azonosítása. A nehézség ellenére azonban ez kivitelezhető, és megbízható adatokat szolgáltat. További kérdést vet fel az a tény, hogy sem a fluoreszcens, sem a hím csontvelő nem lett egészséges (kontroll) állatoknak beadva. Ennek oka az, hogy annak érdekében, hogy az új csontvelősejtek megtapadjanak és osztódjanak, a fogadó állat saját csontvelejét gyengíteni kell. Ezt általában besugárzással érik el (Brazelton, 2000; Goodell, 2001; Krause, 2001; Nakano, 2001; Theise, 2000; Wagers, 2002), vagy olyan genetikailag előállított egér használatával, mely fehérvérsejtek nélkül születik (Mezey, 2000). Jelenleg még nem tudhatjuk, hogy a besugárzás és/vagy a genetikai manipulálás befolyásolja-e a kapott eredményeket.
Amikor a transzplantáció után csontvelőből származó sejteket találunk a különböző szövetekben, újabb nehézséget jelent a csontvelősejtek markereinek további azonosítása az adott szövetspecifikus sejtekkel. Az agyban például nem elég kimutatni az Y kromoszómát, hanem idegsejtekre jellemző fehérjék kimutatásával azt is be kell bizonyítani, hogy ugyanaz a sejt (vagy sejtmag) tartalmazza az Y kromoszómát, mint a specifikus (idegsejt-specifikus) fehérjét. Ennek egyértelmű kimutatása csak konfokális mikroszkóp segítségével lehetséges, mert ez kizárja, hogy egymás fölött lévő struktúrák átfedése okozná a kolokalizációt. Más szövetekben a feladat könnyebb lehet. A száj nyálkahártyasejtjeit szét lehet kenni egy mikroszkóp tárgylemezére, és a sejteket így egyenként lehet megvizsgálni. Ezt a módszert használtuk laboratóriumunkban, amikor szájnyálkahártya sejteket gyűjtöttünk olyan, korábban leukémiás nőbetegektől, akik betegségük során férfi csontvelőátültetésben részesültek. Bár hasonló betegek agyában már korábban kimutattuk (Mezey, 2003) igen kis százalékban (0,3%) a csontvelőből származó Y kromoszóma-tartalmú sejtek jelenlétét, mi is meglepődtünk azon, hogy az Y kromoszómát tartalmazó (azaz a beültetett csontvelőből származó) differenciált szájnyálkahártya-sejtek száma a betegekben 0,8-12,7 % között mozgott (Tran, 2003). Ezekben a sejtekben egyidejűleg meg tudtuk festeni az X és az Y kromoszómákat, és közel tízezer sejt megvizsgálása azt mutatta, hogy csak igen elvétve (két sejt a tízezerből) vannak diploid sejtek, amiknek a sejtmagjában a normális kromoszómaszám kétszerese van meg, tehát valószínűleg két sejt (egy szájnyálkahártyasejt és egy csontvelősejt) fúziójából jöttek létre, és nem a csontvelősejt "átprogramozódásának" a következményei. Ez a kísérlet azt mutatta, hogy emberben a fúzió (legalábbis a szájnyálkahártyában) igen ritka, és azt bizonyította, hogy felnőtt őssejtek valóban képesek átváltozni olyan sejtekké, melyek a fejlődés során más dermális rétegből eredtek. Ez természetesen nem azt jelenti, hogy a sejtmagfúzió jelentőségével nem kell számolni. Tudjuk, hogy a sejtfúzió kétségtelenül élettani jelenség. A májszövetben például ismert, hogy néha a sejtek több mint fele diploid - azaz fúzió eredménye. A közelmúltban két kutatócsoport tanulmányozta a genetikailag fumarylacetoacetát-hydroláz enzim hiányában szenvedő egereket (Vassilopoulos, 2003; Wang, 2003). Ezek az egerek kezelés nélkül elpusztulnak. Amikor azonban egészséges (a hiányzó enzimet tartalmazó) csontvelővel transzplantálják őket, képesek egészséges életre. Ezekben a transzplantált egerekben a májsejtek nagy százaléka az egészséges csontvelősejtek és a beteg májsejtek fúziójának eredményeképpen jött létre. Ezen kísérlet értékelésekor érdemes elgondolkodnunk a máj különleges szerepén. Mivel a máj elsődleges szerepe a méregtelenítés, a májsejtek folyamatosan károsodásnak vannak kitéve. Amennyiben nem tudják a DNS-üket jó hatásfokkal és gyorsan megjavítani, könnyű elképzelni, hogy nagyszámú mutáció jönne létre, és előbb-utóbb az onkogének mutációjának rákos elfajulás lenne a következménye. Ha azonban feltételezzük, hogy fúzió által egy-egy létszükséges génből nem kettő, hanem négy, nyolc vagy akár tizenhat kópia is lehet egy májsejten belül, akkor már valószínűtlen, hogy ugyanaz a gén ugyanolyan módon mutálódik mindegyik kópiában, tehát így nem jön létre rákos burjánzás. Más szóval a májsejteknél a fúzió az önvédelmi rendszer szerves része lehet. Ennek tükrében azt mondhatjuk, hogy míg ismerten multiploid sejtek esetében a magfúzió természetes mechanizmus lehet, addig olyan szöveteknél, melyek diploidok maradnak egy életen át (ide tartozik a legtöbb magasabbrendű állati szövet), nem valószínű a fúzió, hanem a sejtek folyamatos újraképződésében a keringő őssejtek transzdifferenciálódása játszhat szerepet.
A közelmúltban David Anderson (Anderson, 2001) javasolta, hogy mielőtt transzdifferenciálódásról számolnának be, a kutatók győződjenek meg arról, hogy a kísérletek a következő három feltételt kielégítik-e: (1) a használt őssejtek klonálisak, (2) használat előtt nem voltak in vitro körülmények között tenyésztve és (3) az új (például transzdifferenciált) sejttípus teljes mértékben funkcionális az új környezetben. Ezeknek a feltételeknek talán nemcsak elméleti jelentőségük van. A klonális sejtek használata valószínűleg nagyban megnövelné az esetleges terápia hatásosságát. Mindenki egyetért azzal, hogy fontos lenne tudni, pontosan melyik fajta csontvelő-őssejtekből származnak neuronok, gliasejtek, izomsejtek. Az a feltétel azonban, mely nem engedi a beültetés előtti szövettenyészet használatát, már nem egyértelműen elfogadható. Elképzelhető ugyanis, hogy a szövetekből izolált sejteket először tenyészetben dedifferenciálni kell, vagy esetleg előkészíteni a szükséges irányba való fejődést (például neurális vagy izomsejt) különböző ismert (vagy még nem ismert) anyagok használatával. Erre egy példa Ingvild Mikkola és csoportjának kísérlete (Mikkola, 2002), amikor már teljesen kifejlett B limfocitákat szövettenyészetben kezelve elérték azt, hogy a sejtek dedifferenciálódtak, majd képesek voltak egy másik sejt (makrofág) irányába fejlődni. A lényeges kérdés nem szükségszerűen az, hogy fiziológiásan mi történik, hanem az, hogy mi lehetséges - esetleg még olyan környezeti és vegyi hatások segítségével is, amiket mesterségesen hozunk létre. A harmadik feltétellel egyet kell értenünk, hiszen a sejtek funkcionális volta elengedhetetlen ahhoz, hogy terápiásan szöveti regenerációra használhatóak legyenek. Annak bizonyítása azonban, hogy a csontvelőből származó idegsejtek működőképesek, nem egyszerű feladat. Míg szövettenyészetben lehetséges elektrofiziológia segítségével kimutatni, hogy a sejtek idegsejtként viselkednek, ezt "in vivo" nem lehet vizsgálni - mivel jelenleg még nem tudjuk a beépült sejteket így felismerni. Ha el tudjuk érni, hogy nagyságrendekkel több sejt épüljön be, és váljon neuronná, akkor lehetségessé válna egy-egy rendszer funkciójának vizsgálata. Valószínű, hogy a nehézségek a különböző szövettípustól függően különbözőek. A közeljövő feladata az, hogy kiderítsük, mely szöveteket tudjuk (és mely szöveteket nem tudjuk) őssejtek segítségével regenerálni; tudunk-e megfelelő állatmodelleket létrehozni, és tudjuk-e optimalizálni az őssejtek kezelését és beadását úgy, hogy sikeres terápiás eszközökké válhassanak.
Kulcsszavak: felnőtt őssejt, csontvelő-őssejt, transzplantáció, fúzió, transzdifferenciálódás
 1. ábra * Az ábra az új adatok alapján összefoglalt lehetőségeket szemlélteti,
melyben a csontvelőből különböző - fejlődéstanilag más dermatomából származó -
szövetek is képződhetnek.
1. ábra * Az ábra az új adatok alapján összefoglalt lehetőségeket szemlélteti,
melyben a csontvelőből különböző - fejlődéstanilag más dermatomából származó -
szövetek is képződhetnek.
Irodalom
Anderson, David J. - Gage, Fred H. - Weissman, Irving L. (2001): Can Stem Cells Cross Lineage Boundaries? Nature Medicine. 7, 4, 393-395.
Brazelton, Timothy R. - Rossi, F. M. - Keshet, G. I. - Blau, H. M. (2000): From Marrow to Brain: Expression of Neuronal Phenotypes in Adult Mice. Science. 290, 5497, 1775-1779
Goodell, Margaret A. - Jackson, K. A. - Majka, S. M. - Mi, T. - Wang, H. - Pocius, J. - Hartley, C. J. - Ma-jesky, M. W. - Entman, M. L. - Michael, L. H. - Hir-schi, K. K. (2001): Stem Cell Plasticity in Muscle and Bone Marrow. Annals of the New York Academy of Sciences. 938, 208-218.; Discussion 218-220
Krause, Diane S. - Theise, N. D. - Collector, M. I. - Henegariu, O. - Hwang, S. - Gardner, R. - Neutzel, S. - Sharkis, S. J. (2001): Multi-Organ, Multi-Lineage Engraftment by a Single Bone Marrow-Derived Stem Cell. Cell. 105, 369-377
Mezey Éva - Chandross, K. J. - Harta G. - Maki, R. A. - Mckercher, S. R. (2000): Turning Blood Into Brain: Cells Bearing Neuronal Antigens Generated in Vivo From Bone Marrow. Science. 290, 5497, 1779-1782
Mezey Éva - Key, S. - Vogelsang, G. - Szalayova, I. - Lange, G. D. - Crain, B. (2003): Transplanted Bone Marrow Generates New Neurons in Human Brains. Proceedings of the National Academy of Sciences of the USA. 100, 1364-1369
Mezey Éva - Nagy A. - Szalayova, I. - Key, S. - Bratincsák A. - Baffi J. - Shahar, T. (2003): Comment on “Failure of Bone Marrow Cells to Transdif-ferentiate Into Neural Cells in Vivo". Science. 299, 1184.; Author Reply: 1184
Mikkola, Ingvild - Heavey, B. - Horcher, M. - Busslinger, M. (2002): Reversion of B Cell Commitment Upon Loss of Pax5 Expression. Science. 297, 5578, 110-113
Nakano, K. - Migita, M. - Mochizuki, H. - Shimada, T. (2001): Differentiation of Transplanted Bone Marrow Cells in the Adult Mouse Brain. Transplantation. 71, 1735-1740
Theise, Neil D. - Badve, S. - Saxena, R. - Henegariu, O. - Sell, S. - Crawford, J. M. - Krause, D. S. (2000): Derivation of Hepatocytes from Bone Marrow Cells in Mice After Radiation-Induced Myeloablation. Hepatology. 31, 235-240
Tran, Simon - Pillemer, S. R. - Dutra, A. - Barrett, J. - Brownstein, M. J. - Key, S. - Pak, E. - Leakan, R. A. - Yamada, K. M. - Baum, B. J. - Mezey E. (2003): Human Bone Marrow-Derived Cells Differentiate into Buccal Epithelial Cells in Vivo Without Fusion. The Lancet. 361, 9363
Vassilopoulos, George - Wang, Pei-Rong - Russell, David W. (2003): Transplanted Bone Marrow Regenerates Liver by Cell Fusion. Nature. 422, 6934, 901-904
Wagers, Amy J. - Sherwood, R. I. - Christensen, J. L. - Weissman, I. L. (2002): Little Evidence for Developmental Plasticity of Adult Hematopoietic Stem Cells. Science. 297, 5590, 2256-2259
Wang, Xin - Willenbring, H. - Akkari, Y. - Torimaru, Y. - Foster, M. - Al-Dhalimy, M. - Lagasse, E. - Finegold, M. - Olson, S. - Grompe, M. (2003): Cell Fusion Is the Principal Source of Bone-Marrow-Derived Hepatocytes. Nature. 422, 897-901