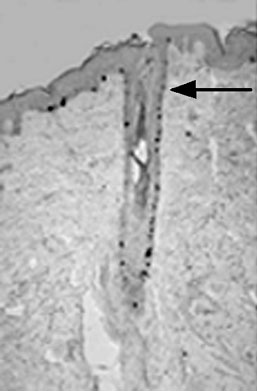
 1. ábra * A szőrtüsző és a hám osztódó sejtjei Ki67 ellenanyaggal jelölve
fekete pontokként látszanak az immunhisztokémiai eljárással készült szövettani
metszeten. Nyíl jelöli a szőrtüsző kitüremkedését, ahol keratinocita őssejtek
találhatók.
1. ábra * A szőrtüsző és a hám osztódó sejtjei Ki67 ellenanyaggal jelölve
fekete pontokként látszanak az immunhisztokémiai eljárással készült szövettani
metszeten. Nyíl jelöli a szőrtüsző kitüremkedését, ahol keratinocita őssejtek
találhatók.
Bevezetés
A bőrünket kívülről takaró elszarusodó fedőhám (epidermisz) fő szerkezeti alkotó sejtje a hámsejt (keratinocita). A születéskor már kifejlődött emberi epidermiszt a sejtek fénymikroszkópos megjelenése alapján öt rétegre oszthatjuk: alapi sejtes réteg (stratum basale vagy stratum germinativum), tüskéssejtes réteg (stratum spinosum), szemcséssejtes réteg (stratum granulosum), fénylő réteg (stratum lucidum) és a szaruréteg (stratum corneum). A hámsejtek ektodermális eredetűek, az embrionális fejlődés során az ébrényi epiderma sejtjeiből alakulnak ki a bőr függelékszervei is: a szőrtüsző, a faggyú- és verejtékmirigy.
Az epidermisz és a szőrtüsző az élet során folyamatosan megújuló szöveteink közé tartozik, a normális szöveti egyensúly állapotában az alsó réteg sejtjei folyamatosan osztódnak, a felsőbb rétegekbe jutva differenciálódnak, majd magjukat vesztett elszarusodott keratintestekként leválnak a felszínről, illetve a szőrtüsző esetében kialakítják a szőr- illetve hajszálat, mely idővel szintén elhagyja a testfelszínt. A felnőtt bőrfelszínt érő külső behatásokra kialakuló hámsejtvesztést az alapi réteg sejtjei gyorsan pótolják, és a kialakult új hám nem különbözik a régitől, ellentétben például a felnőtt kötőszövet sérüléseivel, ahol az újraképződés során az eredetitől különböző hegszövet képződik.
Az osztódó hámsejtek szöveti szerveződése
A 70-es évek elejéig az epidermisz osztódni képes bazális sejtrétegét (stratum germinativum) homogén sejtpopulációnak tekintették, melyben a sejtek azonos eséllyel osztódnak és/vagy differenciálódnak (Leblond et al., 1964). Későbbi vizsgálatok során kiderült, hogy a hám keratinocitái jellegzetes oszlopos elrendeződést alkotnak, melynek alján ritkán osztódó sejtek, felette gyors egymásutánban osztódó sejtek, e felett pedig nem osztódó sejtek helyezkednek el. Egy-egy ilyen oszlopot epidermális proliferatív egységnek neveztek el (Mackenzie, 1969). Triciummal jelölt timidint használva a sejtosztódás vizsgálatára, kiderült, hogy a legbazálisabban elhelyezkedő hámsejtek között a felvett timidint hosszú ideig megtartó sejtek találhatók, míg a jelzett anyagot felvett osztódó sejtek fentebb elhelyezkedő csoportjában folyamatos gyors osztódások során kihígul a jelölés (Bickenbach, 1981). A jelzett timidint hosszan megtartó (label retaining) sejtek a szőrtüszők között elhelyezkedő (interfollikuláris) epidermiszben valóban egy-egy epidermális oszlop alatt helyezkednek el. Hasonló, a jelölt timidint hosszan megtartó sejttípust a nyálkahártyában, a cornea limbus területén és a szőrtüszőben a szőremelő izom tapadásánál elhelyezkedő kitüremkedés (bulge) területén azonosítottak (1. ábra) (Potten and Booth, 2002).
1982-ben Robert M. Lavker és Tung-Tien Sun a humán epidermisz bazálisan elhelyezkedő sejtjei között két morfológiailag és funkcionálisan különböző sejttípust írtak le, az egyik ritkán osztódó (a jelölt timidint hosszan megtartó), sima felszínű, egyszerű citoplazmájú sejt, a másik gyors egymásutánban osztódó, felszínén kitüremkedéseket viselő, komplexebb citoplazmájú sejttípus (Lavker-Sun, 1982). Az epidermisz lassan, illetve ritkán osztódó, a jelzett timidint hosszan megtartó sejtjeit a hámképződés őssejtjeinek (stem cells), a gyors egymásutánban osztódó sejteket pedig átmeneti osztódó (transiently amplifying) sejteknek nevezték el.
Keratinocita őssejtek a tenyészetben
A humán keratinocita in vitro tenyésztésének kidolgozását követően a tenyésztett sejtek között is legalább két, funkcionálisan és morfológiailag különböző osztódásra képes sejttípust lehetett azonosítani. A tenyészetben nagyszámú és hosszú életű kolóniákat képeznek a kisméretű hámsejtek (holoklónok), míg rövidebb életű, kisebb számú kolónia képződik a nagyobb méretű hámsejtekből (paraklónok) (Barrandon-Green, 1985).
Magunk többparaméteres áramlásos citometriás módszerrel vizsgálva a normál epidermiszből frissen szeparált sejteket két, a béta1 integrin és a keratin1/10 kifejeződés alapján jól elkülöníthető sejtpopulációt találtunk, amelyben a sejtek osztódtak. A béta1 integrin kifejeződés minden osztódó hámsejtre jellemző. A legbazálisabban elhelyezkedő hámsejtek, melyek a keratin 1/10-et nem fejezik ki, jellemzően kisméretűek, citoplazmájuk egyszerű, és alacsony az osztódási rátájuk. Jóval nagyobb számú osztódó sejt van azon hámsejtek között, melyek már kifejezik a keratin 1/10-et, de még béta1 integrin pozitívak. Ezek a sejtek nagyobb méretűek, és citoplazmájukban több szerkezeti elem van. A keratin 1/10 kifejeződés az epidermiszben azokban a sejtekben jelenik meg, melyek a bazális membrántól elválva elhagyják a hám legalsó sejtrétegét (2. és 3. ábra) (Bata-Csörgő et al., 1993).
Adott tenyésztési körülmények között a tenyészet kolóniái kizárólag keratin 1/10 negatív sejtekből alakulnak ki. A tenyészet kolóniáit képező hámsejtekre jellemző, hogy nagyon erősen kifejezik a béta1 integrint (Bata-Csörgő et al., 1995).
A hámsejtek, tenyészetben, megfelelő körülmények között többrétegű, az élő szövethez nagyon hasonló hámot képesek kialakítani. Kisméretű bőrmintából nagykiterjedésű, a kötőszövetbe terjedő bőrhiányok pótlására alkalmas saját (autolog) hámszövetet lehet tenyészteni. Ha a tenyésztési körülményeket úgy változtatjuk, hogy a sejteket nem hagyjuk többrétegű hámmá differenciálódni, talán még hatékonyabban fedhetők a sebek hámsejt-szuszpenzióval. Saját vizsgálataink szerint a hajas fejbőrről vett bőrből rövidebb idő alatt jóval több hámsejt tenyészthető, mint a comb vagy a lágyék területéről vett azonos méretű bőrdarabból. A hajas fejbőrről vett bőr hámsejtei között kb. 20 %-kal nagyobb a keratin 1/10 negatív sejtek aránya (Szabad et al., közlésre benyújtva).
Fiona M. Watt és munkatársai a béta1 integrint erősen kifejező hámsejteket azonosítottak a szőrtüszők között elhelyezkedő epidermiszben is (Jones et al., 1995). Ezek a sejtek gyorsan és erősen tapadtak az epidermális bazális membránt alkotó bizonyos fehérjékhez, és hosszabb életű kolóniákat képeztek a tenyészetben, mint a béta1 integrint kevésbé erősen kifejező sejtek.
Az utóbbi években a keratin 19, valamint az alfa6 integrin erős és egyidejűleg a CD71 (transzferrin receptor), illetve egy proliferációval asszociált sejtfelszíni marker (10G7) gyenge kifejeződését, valamint a p63 transzkripciós faktor kifejeződését találták jellemzőnek olyan hámsejtekre, melyek az ép hámszövetben alig osztódnak, ugyanakkor a tenyészetben hosszú életű kolóniaképzésre képesek (Potten-Booth, 2002). Legutóbb egy amerikai munkacsoport arról számolt be, hogy a szőrtüsző kitüremkedésénél található alfa6 integrint erősen kifejező sejtek magukon hordozzák a CD34-et, a csontvelői őssejtek jellegzetes markerét (Trempus et al., 2003).
A hámsejteket tenyészetben specifikus génnel megjelölve, majd a sejteket a szövetbe visszaültetve igazolható, hogy a hámsejtek között vannak olyanok, melyek a hámszövetet teljes vastagságában oszlopszerűen képesek újraképezni (Mackenzie, 1997).
A hám őssejtjeinek további jellemzése
A folyamatosan megújuló szövetek őssejtjeiről feltételezik, hogy elvben végtelen számú sejtosztódás lehetőségével bírnak, ugyanakkor fiziológiás körülmények között alig osztódnak (Lajtha, 1979). Tenyésztési körülmények között a hámsejtek osztódási kapacitása, bár igen nagy, mégis véges. Ugyanakkor az élő hámszövet őssejtjeinek még a véges osztódási kapacitását sem bizonyították. Számos adat szól amellett, hogy az őssejttulajdonság megtartásához a sejt közvetlen környezetéből folyamatosan kapott megfelelő jelek szükségesek. Úgy tűnik, hogy az epidermális őssejtpopuláció fenntartásában a bazális hámsejteknek az alattuk elhelyezkedő membránhoz történő tapadása alapvető jelentőséggel bír. A membránt alkotó fehérjék a sejtek béta1 integrin receptoraival kapcsolódva a mitogén által aktivált protein kinázon (MAPK) keresztül mint jelátviteli úton szabályozzák az epidermális őssejtpopuláció fenntartását (Zhu et al., 1999).
A béta1 integrin esszenciális szerepet játszik a hámszövet és a szőrtüsző normális kialakításában is. A béta1 integrin hámsejtekben való kiütése egérben a szőrtüsző és a közötte elhelyezkedő hámszövet súlyos rendellenességeit eredményezi (Brakebusch et al., 2000; Raghavan et al., 2000). A felnőtt szervezet legtöbb szomatikus sejtjére jellemző, hogy osztódása során a kromoszómavégek DNS-e (teloméra) rövidül. A feltehetően korlátlan szaporodóképességgel rendelkező sejtekben (ősivarsejt, embrionális sejtek, immortalizált és tumorsejtek) a telomeráz enzim megakadályozza a kromoszómavégek rövidülését. Érett, egészséges szervezetben az ivarsejteken kívül csontvelőből, köldökzsinór- és perifériás vérből származó sejtekben (csontvelői őssejtek), valamint a hám bazális sejtjeiben tudtak telomeráz aktivitást kimutatni (Härle-Bachor-Boukamp, 1996). Sejttenyészetben telomeráz aktivitást a hám őssejt-típusú sejtjei mutatnak, ezek az erősen tapadó, alfa6 integrint erősen kifejező és a tenyészetben jó kolóniaképző képességgel bíró sejtek. Úgy tűnik, hogy a hámszövetben a különböző tumorképződést kialakító manipulációk célsejtjei is azok a sejtek, melyeket egyéb tulajdonságai alapján a hámszövet őssejtjeinek gondolunk (Morris, 2000).
A szőrtüsző kitüremkedésénél elhelyezkedő keratinocita őssejtek többféle bőrstruktúrát (a szőrtüszők között elhelyezkedő hámszövet sejtjeit, a szőrtüsző és a faggyúmirigy sejtjeit) képesek újraformálni, ilyen értelemben a differenciálódási irányuk többágú (pluripotensek), de arra nincs egyelőre bizonyíték, hogy a hám őssejtjei más szöveti sejtek kialakulásának lehetőségével is bírnának (totipotens).
Összefoglalás
A hámszövetben tehát vannak és többé-kevésbé jellemezhetőek is azok a hosszú életű sejtek, melyek normális körülmények között ritkán osztódnak, ugyanakkor képesek önmagukat és a hámszövetet nagyrészt alkotó különböző differenciáltsági fokú hámsejteket reprodukálni mind az élő szövetben, mind pedig a tenyésztőedényben. A hámszövet őssejtjeinek hasznosítása, ha nem is a mindennapi és a legoptimálisabb technika alkalmazásával, már az orvosi gyakorlatban is alkalmazásra kerül a hámszövet pótlásakor. Ezek a sejtek génterápiás beavatkozások lehetőségét is hordozzák, elsősorban olyan genetikai hibák javításának lehetőségét, melyek magát a hámszövetet érintik. A keratinocita őssejtek a tenyészetben tapadási és klónképző képességük alapján szétválaszthatók, ezek a sejtek a beléjük különböző módszerekkel bevitt javított géneket befogadják és hosszú ideig kifejezik (Ortiz-Urda et al., 2002).
Kulcsszavak: hámsejt, ektoderma, epidermális proliferatív egység
 1. ábra * A szőrtüsző és a hám osztódó sejtjei Ki67 ellenanyaggal jelölve
fekete pontokként látszanak az immunhisztokémiai eljárással készült szövettani
metszeten. Nyíl jelöli a szőrtüsző kitüremkedését, ahol keratinocita őssejtek
találhatók.
1. ábra * A szőrtüsző és a hám osztódó sejtjei Ki67 ellenanyaggal jelölve
fekete pontokként látszanak az immunhisztokémiai eljárással készült szövettani
metszeten. Nyíl jelöli a szőrtüsző kitüremkedését, ahol keratinocita őssejtek
találhatók.
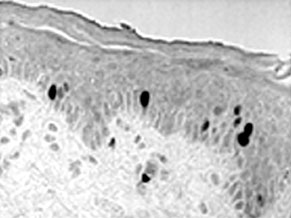 2. ábra * Az ép hám Ki67 ellenanyaggal jelölt osztódó sejtjei (fekete pontok).
A legalsó sejtrétegben a sejtek nagyobb része nem osztódik.
2. ábra * Az ép hám Ki67 ellenanyaggal jelölt osztódó sejtjei (fekete pontok).
A legalsó sejtrétegben a sejtek nagyobb része nem osztódik.
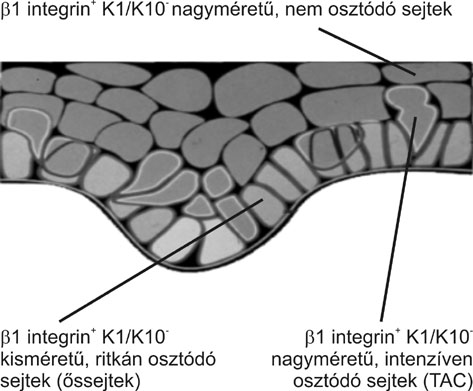 3. ábra * A szőrtüszők között elhelyezkedő hám sejtjeinek karakterizálása a
béta1 integrin és keratin1/10 kifejeződés alapján, áramlásos citometriás
meghatározással
3. ábra * A szőrtüszők között elhelyezkedő hám sejtjeinek karakterizálása a
béta1 integrin és keratin1/10 kifejeződés alapján, áramlásos citometriás
meghatározással
Irodalom
Barrandon, Yann - Green, Howard (1985): Cell Size as a Determinant of the Clone-Forming Ability of Human Keratinocytes. Proceedings of the National Academy of Sciences of the USA. 82, 5390-5394
Bata-Csorgo Zsuzsanna - Hammerberg, C. - Voorhees, J. J. - Cooper, K. D. (1993): Flow Cytometric Identification of Proliferative Subpopulations within Normal Human Epidermis and the Localization of the Primary Hyperproliferative Population in Psoriasis. The Journal of Experimental Medicine. 178, 1271-1281
Bata-Csorgo, Zsuzsanna - Hammerberg, C. - Voorhees, J. J. - Cooper, K. D. (1995): Kinetics and Regulation of Human Keratinocyte Stem Cell Growth in Short-Term Primary Ex Vivo Culture. Cooperative Growth Factors from Psoriatic Lesional T Lymphocytes Stimulate Proliferation among Psoriatic Uninvolved, But Not Normal, Stem Keratinocytes. The Journal of Clinical Investigation. 95, 317-327
Bickenbach, Jackie R. (1981): Identification and Behavior of Label-Retaining Cells in Oral Mucosa and Skin. Journal of Dental Research. 60 , Spec No C, 1611-1620
Brakebusch, Cord - Grose, R. - Quondamatteo, F. - Ramirez, A. - Jorcano, J. L. - Pirro, A. - Svensson, M. - Herken, R. - Sasaki, T. - Timpl, R. - Werner, S. - - Fassler, R. (2000): Skin and Hair Follicle Integrity Is Crucially Dependent on Beta 1 Integrin Expression on Keratinocytes. The EMBO Journal. 19, 3990-4003
Härle-Bachor, Cosima - Boukamp, Petra (1996): Telomerase Activity in the Regenerative Basal Layer of the Epidermis Inhuman Skin and in Immortal and Carcinoma-Derived Skin Keratinocytes. Proceedings of the National Academy of Sciences of the USA. 93, 6476-6481
Jones, P. H. - Harper, S. - Watt, Fiona M. (1995): Stem Cell Patterning and Fate in Human Epidermis. Cell 80, 83-93
Lajtha, Laszlo G. (1979): Stem Cell Concepts. Differentiation. 14, 23-34
Lavker, Robert M. - Sun, Tung-Tien (1982): Heterogeneity in Epidermal Basal Keratinocytes: Morphological and Functional Correlations. Science. 215, 1239-1241
Leblond, C. P. - Greulich, R. C. - Marques-Pereira, J. P. (1964): Relationship of Cell Formation and Cell Migration in the Renewal of Stratified Squamous Epithelia. Advances in Biology of Skin. 5, 39-67
Mackenzie, I. C. (1969): The Ordered Structure of the Stratum Corneum of Mammalian Skin. Nature. 222, 881-882
Mackenzie, I. C. (1997): Retroviral Transduction of Murine Epidermal Stem Cells Demonstrates Clonal Units of Epidermal Structure. Journal of Investigative Dermatology. 109, 377-383
Morris, Rebecca J. (2000): Keratinocyte Stem Cells: Targets For Cutaneous Carcinogens. The Journal of Clinical Investigation. 106, 3-8
Ortiz-Urda, Susana - Thyagarajan, B. - Keene, D.R. - Lin, Q. - Fang, M. - Calos, M. P. - Khavari, P. - Stable A. Nonviral Genetic Correction of Inherited Human Skin Disease. Nature Medicine. (2002): 8, 1166-1170
Potten, Cristpher S. - Booth, Catherine (2002): Keratinocyte Stem Cells: A Commentary. Journal of Investigative Dermatology. 119, 888-899
Raghavan, Srikala - Bauer, C. - Mundschau, G. - Li, Q. - Fuchs, E. (2000): Conditional Ablation of Beta1 Integrin in Skin. Severe Defects in Epidermal Proliferation, Basement Membrane Formation, and Hair Follicle Invagination. The Journal of Cell Biology. 150, 1149-1160
Szabad Gábor - Koreck A. - Kenderessy Szabó A. - Varga J. - Kemény L. - Dobozy A. - Bata-Csorgo Z. Hairy Scalp, the Ideal Donor Site for Keratinocyte Transplantation. Közlésre benyújtva
Trempus, Carol S. - Morris, R. J. - Bortner, C. D. - Cotsarelis, G. - Faircloth, R. S. - Reece, J. M. - Tennant, R. W. ( 2003): Enrichment for Living Murine Keratinocytes from the Hair Follicle Bulge with the Cell Surface Marker CD34. Journal of Investigative Dermatology. 120, 501-511
Zhu, Alan Jian - Haase, Lingo - Watt, Fiona M. (1999): Signaling Via Beta1 Integrins and Mitogen-Activated Protein Kinase Determines Human Epidermal Stem Cell Fate in Vitro. Proceedings of the National Academy of Sciences of the USA. 96, 6728-6733