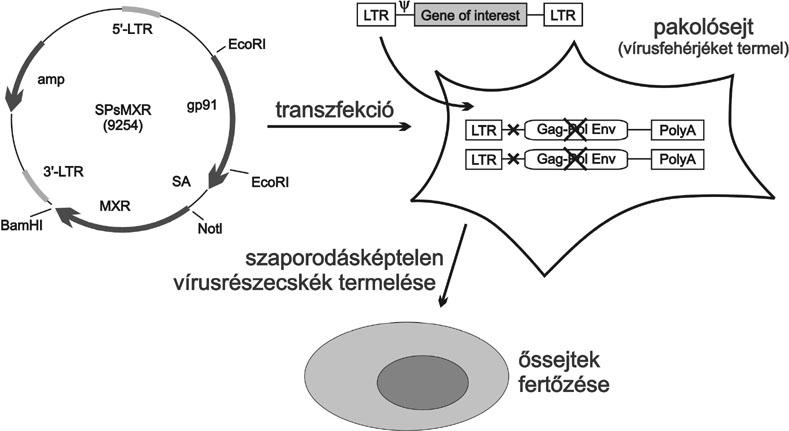
 1. ábra * Módosított retrovírusok előállítása génterápia céljára
1. ábra * Módosított retrovírusok előállítása génterápia céljára
A korábbi fejezetekben többször is olvashattak az őssejtek nagyfokú szaporodóképességéről és sokirányú differenciálódásáról. Ezek a sejtek megfelelő átalakulás vagy sejtfúzió után képesek a szervezet valószínűleg minden sejtjét pótolni. E fontos sajátságukból következik kiemelt jelentőségük a jövőben alkalmazásra kerülő gyógyítási módszerek között. Ilyen eljárásnak tekinthető a génterápia is.
Génterápiának nevezzük azokat az eljárásokat, melyek során a beteg sejtjeinek genetikai állományán végrehajtott módosítás eredményezi a gyógyulást, és ezért alapjaiban különböznek minden klasszikusan alkalmazott gyógyító eljárástól. A jelenlegi humán génterápiás kísérletek mindegyike testi sejteket céloz. Az emberi ivarsejteken végrehajtható genetikai változtatások számos etikai kérdést vetnek fel, így végzésük a legtöbb országban nem engedélyezett. A fejlesztés alatt álló, testi sejteken végrehajtandó eljárások többsége a betegből kivett sejteket a szervezeten kívül, steril körülmények között kezeli, majd visszajuttatja a betegbe (ex vivo génterápia). A másik fő eljárástípus esetében a beteg megfelelő szövetébe (például a szívbe, agyba) in vivo juttatják be a helyileg ható, géntartalmú kezelőanyagot.
A kívánt eredmény eléréséhez a kiválasztott célsejtbe kódoló DNS-szakaszokat (géneket) kell bejuttatni, amelyek ott fejtik ki hatásukat. A hatás többféle lehet: például a bevitt génről termelődik egy olyan fehérje, amely a betegből korábban kórosan hiányzott, vagy máskor a termelt fehérje megöli a hibás sejteket. Megint más esetben, a bevitt génről átíródó termék immunaktiváló hatású, amely segíti a szervezetet a betegség leküzdésében (Strach, 1999).
A terápiás génmódosítás eszköze a kitűzött céltól függ. Számos gyógyító eljárásnál egy élettani folyamat átmeneti létrejötte eredményezi a kívánt hatást, de annak tartós fennállása már káros lehet a szervezetre nézve. Ilyen például az immunstimulálás daganatos sejtek elpusztítására, vagy sejtölő hatású citokintermelés beindítása génbevitellel. Minthogy a gyógyítást segítő anyag termelődésére csak átmenetileg van szükség, a génbejuttatás eszközei lehetnek például: liposzómába zárt DNS, finom eloszlású fémszemcsékhez kötött gén (gene gun), illetve módosított (rekombináns) adenovírussal megvalósítható génbevitel, amelyek mind átmeneti génbevitelt eredményeznek (Robbins, 1997). Ezeknél az eljárásoknál a bejuttatott DNS-szakasz nem, vagy csak elenyésző mértékben épül be a beteg sejtjeinek kromoszómájába. Ugyanakkor ezek a technikák igen nagyméretű DNS-szakaszok bevitelét is lehetővé teszik. Külön érdemes kiemelni a módosított adenovírusoknak azt az előnyös tulajdonságát, hogy nyugvó, nem-osztódó sejteket is képesek megfertőzni, és bejuttatni a terápiás gént. Ez a tulajdonság nagy előnyt jelent például az idegsejtek gyógyításában (Strach, 1999).
A fent felsoroltakkal ellentétben, számos más betegségnél, ahol a hiányzó fehérje termelésének kiváltása (például hemofiliában vagy veleszületett immunhiányos betegségekben) a terápiás cél, a gén kromoszómába történő beépülése szükséges (Williams - Smith, 2000). Ehhez választható eszközök lehetnek a különböző módosított vírusok, így az adeno-asszociált vírusok és retrovírusok. Ez utóbbiak terápiás célú átalakításáról a későbbiekben még részletesen is szólunk. Olyan kórképeknél, amelyek gyógyítása tartós génmódosítást igényel, a célsejt megválasztása is kritikus: sokáig a szervezetben maradó, esetleg hosszú életű sejtet érdemes génkezelni. Jelenlegi ismereteink szerint e kritériumoknak legjobban megfelelő célsejtek szervezetünkben az őssejtek lehetnek. Nem meglepő tehát, hogy a génterápiás kutatások kiemelt jelöltjei ezek a sejtek.
Meg kell vallani, hogy egyelőre a sokat ígérő elméletek gyakorlati megvalósítása mélyen a várakozások alatt marad, még napjainkban is csak kísérleti szakaszban tart. Bár 2003 nyarán közel négyszáz klinikai vizsgálat van folyamatban vagy zárult le, rutinszerűen alkalmazott módszerként egyelőre egyik sem használható (lásd Gene Therapy Trials www.wiley.co.uk/wileychi/genmed/clinical/). A vizsgálatok több mint a fele rákban szenvedő betegek génterápiás gyógyítását célozza, míg a korábbi célkitűzések elsősorban örökletes betegségek korrigálására irányultak. A világ fejlett országaiban szinte mindenhol megindult kutatásokat, a klinikai kipróbálások igen magas költségei miatt, multinacionális gyógyszergyárak és biotechnológiai cégek finanszírozzák, amelyek a nagyszámú beteg várható kezelésének reményében szívesebben áldoznak a fejlesztésre.
A génterápiás kísérletek első szakasza laboratóriumi körülmények között könnyen tenyészthető sejtvonalakon, majd betegekből nyerhető sejteken, steril tápedényekben történik, ezt nevezzük in vitro szakasznak. Ezután a sikeres eljárást kisállat- (többnyire egér) modelleken próbálják ki (in vivo, vagy más néven pre-klinikai vizsgálat), majd a módszer klinikai kipróbálásának szakaszai következhetnek.
A következő oldalakon a jelenleg leghatékonyabbnak gondolt, őssejteket célzó és remélhetőleg tartós gyógyulást kínáló génterápiás erőfeszítések eszközeiről, megvalósítási módszereiről, eredményeiről próbálunk rövid képet adni. A megoldandó feladatokat két kérdéskörben tárgyaljuk: az egyik a génbevitel eszközének megválasztása, míg a másik a célsejt (őssejt) előkészítése és fenntartása a génbeviteli folyamat során. Ezek után röviden ismertetjük néhány emberi gyógyításra már felhasznált, ilyen eszközzel végzett génterápiás vizsgálat eredményeit.
Őssejteken alkalmazható génbeviteli eljárások - a terápiás gén beépülése a kromoszómába
Minthogy a sejtek DNS-állományához csak több védőhártya és DNS-t lebontó mechanizmus "leküzdése" után lehet hozzáférni, nem elhanyagolható problémát jelent a gyógyító DNS-szakasz bejuttatása a célsejtbe, majd a "vendég"-gén beépítése a gazdasejt kromoszómájába. A probléma megoldásához legalkalmasabbnak tűnő eszközök retrovírusok módosításával jöttek létre.
A retrovírusok örökítő anyaga RNS, amelyről szaporodásuk egyik fázisában a vírusban előforduló enzim, a reverz transzkriptáz segítségével a megtámadott sejtben DNS szintetizálódik. A vírus genom ebben a szakaszban épül be a megfertőzött sejt kromoszómájába, azaz a DNS-láncba. A beépülés eredményeként a továbbiakban a gazdasejt fehérjéi mellett átíródnak a vírus által bevitt génen kódolt, így a gyógyulást eredményező fehérjék is. A természetben előforduló retrovírusok közé tartoznak igen súlyos betegségek okozói, például a rákos megbetegedések egy részéért felelős onkoretrovírusok és a szerzett immunhiányos betegséget (AIDS) okozó lentivírusok. Az előbbiek csak akkor képesek beépülni a megfertőzött sejt kromoszómájába, amikor a gazdasejt magja éppen osztódik, míg az utóbbiak a nyugvó sejtek magjába is beépülnek.
A vírusok molekuláris felépítésének megismerése lehetővé tette génbevitel céljára történő laboratóriumi átalakításukat. Számos virológus kutatócsoport olyan "művírusokat" hozott létre, amelyek lehetőséget kínálnak arra, hogy mint egy páncélautóba, a vírusokba ültessük a beteg sejtjeibe bejuttatni kívánt gént, így a páncél védelmet jelentsen a sejt többféle védőapparátusával szemben. Természetesen kívánalom, hogy a "jármű" a szállítás elvégzése után ne fejtsen ki káros hatást, és saját "anyagai" minél kevésbé szennyezzék a sejtet (Miller - Garcia, 1991).
Az onkovírusok esetében (ilyen például az egérleukémiát okozó vírus, a MoMuL) a vírus átalakítását oly módon sikerült megvalósítani, hogy a vírus saját örökítő állományának nagy részét DNS-technikák segítségével eltávolították, ennek helyére mód nyílik az előre megtervezett DNS-szakaszok beillesztésére. A bejuttatás ún. vektor segítségével történik (1. ábra).
A kiiktatott vírus-gén szakaszok között van a vírus szaporodásáért felelős rész is, amelynek hiányában a "páncélautó" már nem képes saját magát reprodukálni. A vírusrészecske keletkezéséhez szükséges más, nélkülözhetetlen fehérjéket kódoló génszakaszokat külön-külön "gyártó"-egységekkel (külön vektorokról) termeltetik, hogy a vírus, még valamilyen technikai hiba esetében se tudjon újra összeállni, és vad-típusú, betegséget okozó mikroorganizmussá alakulni.
A vírusrészecskék gyártása egy erre a célra kialakított segédsejtben, az úgynevezett pakolósejtben történik. Mint a neve is mutatja, ez a sejt termeli egyebek közt a vírus csomagolására alkalmas vírus burokfehérjét, valamint a korábban már emlegetett reverz transzkriptáz enzimet. A vírustermelő sejteket laboratóriumi vagy akár üzemi körülmények között is jól lehet tenyészteni, szaporítani. Az általuk előállított fehérjék azonban csak abban az esetben állnak össze vírusrészecskévé, ha a pakolósejtbe juttatunk egy, ún. "pakoló szekvenciát" is tartalmazó DNS-darabkát (vektort). Ehhez a DNS-szakaszhoz kapcsolódnak a termelt vírusfehérjék, fertőzni képes, de szaporodásképtelen vírusrészecskét alkotva. A pakoló szekvencia mellett a vektor arra is lehetőséget kínál, hogy egy, kettő vagy esetleg három, a vírussal bejuttatni kívánt gént "ültessünk" a páncélautóba. A pakolósejt ezután a tenyésztőmédiumba választja ki a vírusrészecskéket, ahonnan azok összegyűjthetők és a gyógyítandó sejtek fertőzésére használhatók. Léteznek olyan pakolósejt-típusok, amelyek a beléjük juttatott vektorokat stabilan megtartják, és hosszú hónapokon keresztül hasonló tulajdonsággal rendelkező, vírustartalmú tápoldatok előállítására alkalmasak. Nagyszámú ilyen termelő sejtből, aprólékos munkával ki lehet válogatni (sejtklónozás), majd folyékony nitrogén alatt tartósan tárolni lehet a legjobb vírussűrűség előállítására alkalmas pakolósejteket. A megfelelő tulajdonságú, sok oldalról ellenőrzött pakolósejteket üzemi méretekben, bioreaktorokban tenyésztik, nagytisztaságú sejttenyésztő médiumban, így a betegből kivett őssejtek fertőzésére közvetlenül alkalmasak. A vírus-"készítmény" igen érzékeny és rövid életidejű, néhány óra alatt szobahőmérsékleten a módosított vírusok többsége inaktívvá válik, - 80 °C-on azonban hónapokig tárolhatók.
A lentivírusok molekuláris biológiai átalakítása és a belőlük létrehozott, módosított vírusok termeltetése elvileg hasonlóan történik. Ugyanakkor ezekhez jelenleg nem állnak rendelkezésre megfelelő pakolósejtek, ezért az eljárás kevésbé biztonságos, és jól reprodukálható. Azon előnyös tulajdonságuk azonban, hogy a lentivírusok genomja a nyugvó sejtek magjába is hatékonyan beépül, génbeviteli hasznosításuknak komoly jövőt jósol. A vad-típusú vírus véletlenszerű keletkezésének minél biztosabb kizárása fogja megnyitni az utat a módosított lentivírusok klinikai kipróbálása előtt.
A retrovírusok terápiás alkalmazásánál komoly megfontolást igényel az a tény, hogy genomjuk és így az általuk bejuttatott terápiás gén kromoszómába történő beépülése is véletlenszerű. Így a "vendég" gén átíródása nem megfelelően szabályozott, és kedvezőtlen helyre történt beépülése esetén tönkreteheti más, egy szomszédos gén szabályozott működését is. A kérdéskör taglalására egy klinikai eredmény ismertetésekor még röviden visszatérünk (Baum - Dullmann, 2003).
Az őssejtek kinyerése, előkészítése és fenntartása a génbeviteli folyamat során. Az őssejtek visszajuttatása a betegbe
A jelenleg folyamatban levő kutatások túlnyomó többsége az ún. vérképző, hematopoetikus őssejteket választja célsejtnek. A magas hatásfokú génbevitel eléréséhez fontos a célsejt minél tisztább kinyerése, ezért jelenleg a legtöbb génterápiás centrumban egy felületi antigén, a CD34 segítségével történik a célsejtek tisztítása. Ez a fehérje, amelynek funkcióját nem ismerjük, az ellene előállított antitest segítségével azonosítható. A génterápia szempontjából fontos tudnunk, hogy nyugvó állapotban ezek a sejtek igen ritkán osztódnak, és nagyobb számban csak a köldökzsinórvérben vagy a csontvelőben találhatók (ezekben a szövetekben előforduló sejtek kb. 1 %-a CD34 pozitív).
Ezek az ismeretek vezettek a CD34+ sejtek kinyerési módszerének bevezetéséhez, amelynek elve röviden a következő: a gyógyítandó beteget néhány napon keresztül olyan, a vérsejtek által termelt citokinnel (granulocita kolónia stimuláló hormon - G-CSF) kezelik, amelynek hatására a csontvelőből és más szöveti raktárakból nagy számban kerülnek a vérkeringésbe CD34+ sejtek. A kezelés végén a fehérvérsejteket aferezissel (leukaferezis) összegyűjtik. A leukaferezis során a beteg vérét zárt rendszeren keresztül áramoltatják, és különválasztják az előre megválasztott típusú fehérvérsejteket. A módszer funkcióképes, ép állapotban őrzi meg a kívánt sejteket, míg a többi véralkotó elemet azonnal visszajuttatják a betegnek. Így több milliárd fehérvérsejt kinyerésére kínálkozik lehetőség, amelyekből egy CD34-szeparátor berendezés képes elkülöníteni a CD34+ sejteket. Az elkülönítés elvét a 2. ábra szemlélteti (Dynal Biotech).
Az ábrán látható, hogy a fehérvérsejteket tartalmazó edénybe (az ábrán a klinikumban használt vérvételi zsákot kémcső helyettesíti) CD34 antitesttel bevont, fémmagot tartalmazó apró gyöngyöket juttatnak. A gyöngyök megkötik a CD34-et kifejező sejteket, majd a fehérvérsejt tartalmú készítményt mágneses térbe helyezik, ahol a gyöngyök és a hozzájuk kötött sejtek a mágneshez tapadnak (persze a cső, illetve zsák belsejében maradva). Kiszívják a nem-kötődött sejteket az edényből, majd mosások után a tiszta CD34+ sejtek összegyűjthetőek és gyógyászati célra alkalmazhatóak.
Retrovírussal történő génterápia végzéséhez az így kinyert sejteket 24-48 órán keresztül citokineket tartalmazó tápfolyadékban tartják, hogy a sejtek a nyugalmi állapotot elhagyják és osztódni kezdjenek (Lotem, - Sachs, 2002). Számos munka foglalkozik napjainkban is az optimális citokin-elegy megválasztásával. Az őssejtek transzplantáció utáni megtapadása szempontjából igazán kívánatos az eredeti sejtalak változatlan megtartása lenne. Mivel azonban az onkoretrovírusok, amelyeket a gének bejuttatására leggyakrabban használnak, csak osztódó sejtek megfertőzésére képesek, szükség van a kismértékű, lassú osztódás elérésére, miközben a differenciálódás megakadályozása is kívánatos. A módszerben jelenleg általánosan használt citokinek egy része a sejtek életben maradásához nélkülözhetetlen (stem cell factor - SCF), más része az osztódást stimulálja (IL-3, IL-6), míg az Flt3-ligand a differenciálódás mérséklését szolgálja. A CD34+ sejtek fenntartása és előkezelése egyszerűbb lentivírus-alapú génbevitel esetében, minthogy a lentivírusok nyugvó sejteket is fertőznek.
A citokin-eleggyel előkezelt, CD34+ sejteket tartalmazó műanyag zsákokba bejuttatják a korábban leírt módon előállított és tesztelt, módosított retrovírusokat, amelyek hordozzák a terápiás célú génszakaszt. Adalékanyagok jelenlétében, amelyek a vírusfertőzés elősegítését szolgálják, a sejt- és vírustartalmú keveréket néhány órán keresztül együtt tenyésztik, majd a műveletet kétszer-háromszor friss vírussal megismétlik. A fertőzés végén a vírusokat eltávolítják a sejtek környezetéből, és a sejteket haladéktalanul visszajuttatják a betegbe. Ez utóbbi lépés megegyezik a csontvelő/őssejt átültetés menetével. A csontvelőátültetéshez hasonlóan a sejtek a csontvelőbe vándorolnak, és ott megtapadnak. Így néhány hét elteltével a bevitt, génmódosított sejtekből indulhat meg a vérképzés.
A teljes ex vivo génterápia folyamatát a 3. ábra foglalja össze.
Összefoglalva, a folyamat lényege a következő lépésekből áll: a betegből, megfelelő előkészítés után, viszonylag nagyszámú őssejtet tartalmazó fehérvérsejtet nyernek (A), amelyekből egy erre a célra szolgáló berendezéssel kiválasztják a CD34+ sejteket (B). A CD34+ sejteket, műanyag zsákokban nevelve, módosított retrovírus-fertőzésnek vetik alá (C). A vírusok eltávolítása után a sejteket, az autológ csontvelő transzplantációs folyamatnak megfelelően, visszajuttatják a betegek vérkeringésébe (D). A bejuttatott sejtek egy része a csontvelőben megtapadva új, egészséges vérképzést generál.
Sok vita és kutatás tárgyát képezi az a kérdés, vajon a CD34+ sejtek jelentik-e az optimális, őssejtként használható génterápiás sejtet, valamint, hogy a leírt hosszadalmas folyamat végén visszaadva a betegnek, ezek a sejtek képesek-e megtapadni a csontvelőben. Felmerül a kérdés, hogy a CD34+ sejteket tekinthetjük-e hematopoetikus őssejteknek, hiszen az igazán ősi, azaz minden irányban differenciálódni képes sejteken valószínűleg nincs rajta a CD34 antigén. Ennek hiányában azonban a sejteket még nehezebb jellemezni, elválasztásuk más vérsejtektől pedig egyelőre szinte lehetetlen.
A génbeviteli eljárások ma ismert módszereihez nélkülözhetetlennek tűnik a célsejtek dúsítása, hiszen az új, terápiás gént kifejező sejtek a beadás után a beteg sejtjeivel elvegyülve erősen meghígulnak. A megoldást az kínálhatja, ha a gyógyító gén mellé sikerül egy olyan segédgént is bevinni, amely szaporodási előnyt vagy szelekciós lehetőséget biztosít a meggyógyított sejtek számára. Ezért számos laboratóriumban, köztük saját intézetünkben is, ilyen módszerek kidolgozása a cél.
Az arány javításának egyik módszere lehet, ha a sejteket ellenállóvá tesszük valamilyen toxikus szerrel, például citosztatikummal szemben. A leírt génbevitel, majd őssejt-traszplantáció után, a beteget a megfelelő gyógyszeres kezelésnek alávetve, a génkezelt sejtek aránya ebben az esetben jelentősen megnövelhető. Ilyen lehetőséget nyújt az ún. multidrog rezisztencia fehérjék kifejeztetése a célsejtekben. Ebben az esetben a módosított vírussal nemcsak a terápiás gént visszük be a CD34+ sejtekbe, hanem egy citosztatikum-rezisztenciát eredményező fehérjét kódoló gént is. Ha az első terápiás eljárás befejeződése után az eredmények nem elég kedvezőek, vagy hónapokkal, illetve évekkel később a gyógyító hatás fokozása lenne kívánatos, a beteget olyan típusú citosztatikum kezelésnek vethetjük alá, amely saját csontvelői sejtjeire mérgező. Ugyanakkor a génkezelt sejteket a segédgénről kifejeződő fehérje megóvja a citosztatikummal szemben.
A csontvelőátültetéshez kapcsolt génterápia néhány klinikai eredménye
A nagy számban közzétett laboratóriumi és állatkísérletes eredmények ellenére eddig mindössze egyetlen sikeres klinikai szintű génterápiás kísérletről tudunk. Alain Fischer és munkatársai 1999 márciusától kezdődően Párizsban kezeltek tizenegy veleszületett, súlyos immunhiányos betegségben szenvedő (SCID - severe combined immunodeficiency) gyermeket (Cavazzana-Calvo - Hacein-Bey, 2000). Ennek a betegségnek az az ismérve, hogy a beteg vérében kevés és kizárólag éretlen limfocita kering, melyek funkcióképtelenek. A SCID-ben szenvedő gyermekek, hacsak teljesen steril körülmények közt nem nevelik őket, súlyos fertőzésekben már néhány éves korban meghalnak.
A betegség korábbi egyetlen kezelését a HLA-azonos donorból származó csontvelőátültetés jelentette. Ha egy beteg ilyen rokonnal nem rendelkezett, sorsa megpecsételődött. A francia munkacsoport ilyen, SCID-ben szenvedő gyermekeket kezelt génterápiás módszerrel, beleértve egy olyan kis pácienst is, akin korábban, idegen donorból vett őssejtekkel már sikertelen csontvelőátültetést hajtottak végre. A francia csoport módszerének lényege megegyezett a fentebb ismertetett eljárással. A betegséget okozó hibás gén egészséges változatát módosított onkoretrovírus segítségével juttatták a betegekből kinyert CD34+ sejtekbe. A sejtekről eltávolították a vírusrészecskéket, majd visszajuttatták a módosított sejteket az immunhiányos gyerekekbe. Az eredmények igen látványosak voltak. A betegek teljesen tünetmentessé váltak, limfocitaszámuk normalizálódott, közösségbe is kerültek.
A kimagaslóan jó eredmény az egész génterápiás közösség számára, de az alapkutatóknak is tanulságként szolgált. Azt sugallta, hogy a SCID kórképe meggátolja a sejtek érését és számbeli növekedését. Így ha a hibát kijavítják, az egészséges sejtek túlnövik a betegeket, más szóval a génterápia növekedési, szaporodási előnyt biztosít az egészséges sejteknek. Hasonló klinikai vizsgálatokba kezdett több más génterápiával foglalkozó kutatócsoport is, és hasonlóan kedvező eredményekről számoltak be.
A rózsaszínnek tűnő égboltra 2002 nyarán kezdtek sötét felhők gyülekezni, amikor előbb egy, majd később még egy gyógyultnak hitt SCID-es gyermeken, másfél-két évvel a génterápiás kezelés után, leukémia-szerű tünetek jelentkeztek (Fischer - Hacein-Bey, 2002). Az egész világról érkezett segítő ötlet és módszer a probléma tisztázására, de a klinikai génterápiás próbálkozásokat a vizsgálatok befejezéséig mindenhol leállították, a munka megtorpant. 2003 elejére sikerült több oldalról igazolni, hogy mindkét leukémiássá vált gyermek vérében olyan homogén sejtszaporulat jelent meg, amely a terápiás gén "szerencsétlen" helyre történt beépüléséből fakad. Minthogy a SCID esetében igen nagymértékű a génkorrigált sejtek szaporodási előnye a betegekkel szemben, elégséges, ha ötvenezer vagy akár százezer sejtből egyben előfordul, hogy a bejuttatott új gén tönkreteszi egy másik, rákkeltő gén szabályozását. Ez a jelenség történt mindkét gyermeknél, mégpedig ugyanaz az onkogén aktiválódott.
Szerencsére jelenleg mindkét gyermek állapota kielégítő, és várható, hogy számos új megfontolás és megkötés mellett, a hatóságok ismét engedélyezni fogják a klinikai génterápiás vizsgálatok folytatását. Meggondolandó, hogy a konvencionális terápiák, illetve gyógyszerek többsége is okozhat mellékhatást, és ennek ellenére használják azokat. Természetesen a betegek figyelmét fel kell hívni a lehetséges veszélyekre, és ha alternatíva kínálkozik, meg kell fontolni, hogy a lehetőségek közül melyik kezelési mód jelenthet a betegre nézve kisebb veszélyt (Baum - Dullmann, 2003).
Kulcsszavak: génterápia, örökletes betegségek gyógyítása, szaporodásképtelen retrovírus, CD34+ sejtek, sejtek fertőzése módosított vírussal
 1. ábra * Módosított retrovírusok előállítása génterápia céljára
1. ábra * Módosított retrovírusok előállítása génterápia céljára
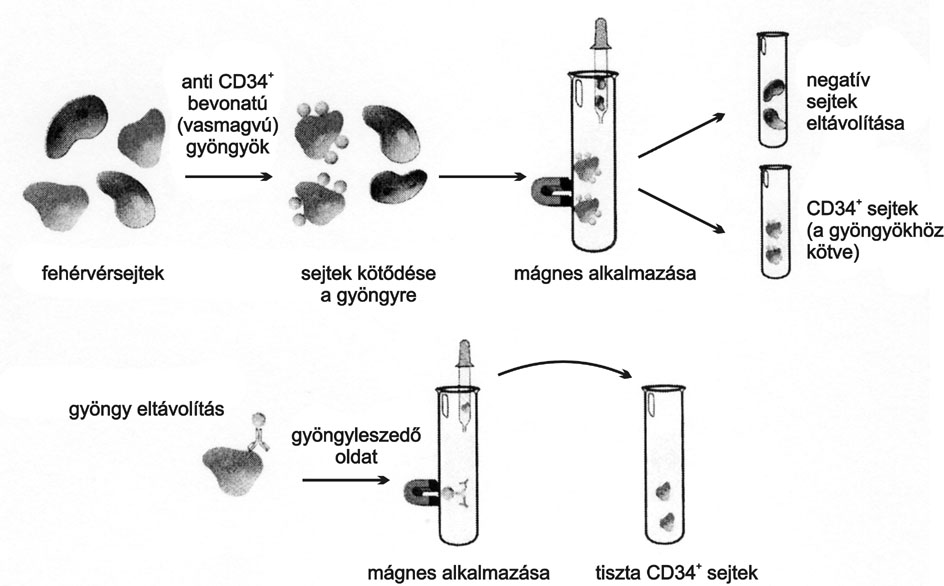 2. ábra * A CD34+ sejtek szeparálásának módszere
2. ábra * A CD34+ sejtek szeparálásának módszere
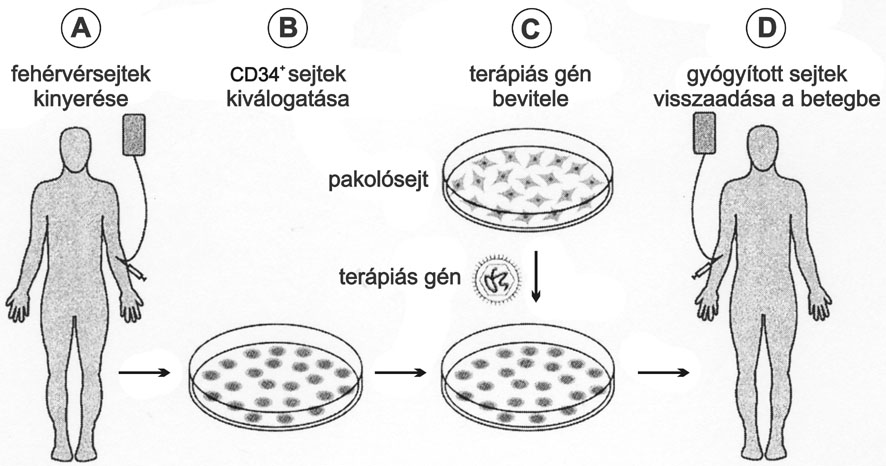 3. ábra * Csontvelőátültetést kiegészítő génterápiás kezelés folyamata
3. ábra * Csontvelőátültetést kiegészítő génterápiás kezelés folyamata
Irodalom
Baum, Christopher - Düllmann, Jochen (2003): Side Effects of Retroviral Gene Transfer into Hematopoietic Stem Cells. Blood. 101, 2099-2114
Cavazzana-Calvo, Marina - Hacein-Bey, Salima (2000): Gene Therapy of Human Severe Combined Immunodeficiency (SCID)-X1 Disease. Science. 288, 669-672
Fischer, Alain - Hacein-Bey, Salima (2002): Gene Therapy of Severe Combined Immunodeficiencies. Nature Reviews Immunology. 2, 615-621
Lotem, Joseph - Sachs, Leo (2002): Cytokine Control of Developmental Programs in Normal Heamtopoiesis and Leukemia. Oncogene. 21, 3284-3294
Miller, A. Dusty - Garcia, J. Victor (1991): Construction and Properties of Retrovirus Packaging Cells Based on Gibbon Ape Leukemia Virus. Journal of Virology. 65, 2220-2224
Robbins, Paul D. (1997): Gene Therapy Protocols. Humana Press, Totowa, USA
Strachan, Tom - Read, Andrew (1999): Human Molecular Genetics. Bios Scientific Publishers, Oxford
Williams, David A. - Smith, Franklin O. (2000): Progress in the Use of Gene Transfer Methods to Treat Genetic Blood Diseases. Human Gene Therapy. 11, 2059-2066