 1. ábra
1. ábra
A növényekben nincs humorális immunitás, azaz a növényeknek nincs a magasabbrendű állatokéhoz hasonló keringési rendszerük, és így immunokompetens, mobilis immunsejtjeik sincsenek. Itt minden sejt lokálisan képes a védekezésre, ha a támadás bekövetkezik.
Vannak a növényi rezisztenciának (immunitásnak) a magasabbrendű állatok immunitásához hasonló típusai, illetve mechanizmusai. A növényvilágban is van általános, több patogénnel vagy patogéntörzssel szemben érvényesülő nem-specifikus rezisztencia, létezik igen specifikus, csak egyetlen vagy néhány patogéntörzssel szemben ható ellenállóképesség, és van szisztemikusan érvényesülő szerzett rezisztencia is.
A rezisztencia molekuláris mechanizmusában is vannak hasonlóságok. Újabb eredmények szerint kétségtelennek tűnik, hogy a rezisztenciagének (R) termékei mint receptorok felismerik a kórokozók avirulencia (Avr)-géntermékeit, aminek következtében ún. szignál-transzdukciós lánc indul be. Ez a lánc védekezési mechanizmusok kialakításában kulminál, amelyeknek lényege a patogén gátlása vagy elölése. Az R gének által kódolt proteinek legjellemzőbb családja a nukleotidkötőhellyel plusz leucingazdag ismétlésekkel jellemezhető fehérjék (NB-LRR) családja. Az NB-LRR fehérjék többségében olyan domainek vannak, amelyek homológiát mutatnak az ecetmuslica (Drosophila melanogaster) immuno-receptorával, azaz a Toll receptor domainnel, mások pedig az emlősök interleukin (IL)-1 receptorával.
A növények baktériumos fertőzése esetében a kórokozó hrp génjei olyan effektor-fehérjéket is kódolnak, amelyek hasonlóak az állatpatogén baktériumok III. típusú szekréciós fehérjéihez. Ezek az effektorfehérjék a sejtközötti járatokból csatornát képeznek a növényi sejtekbe (szekréciós apparátus), amelyen keresztül a baktérium avr géntermékei bejutnak a növényi sejtbe, és ott kölcsönhatásba lépnek az ellenálló növény R géntermékeivel. Az eredmény a hiperszenzitív típusú rezisztencia. Végül érdekes hasonlóság van a növényi és állati védekezés biokémiai mechanizmusában is. Régen feltett kérdés, hogy mi a közvetlen hatása az R gén működésének a támadó patogénnel szemben. Milyen mechanizmus gátolja vagy öli meg a kórokozót? Feltűnő, hogy mindkét esetben a fertőzés hatására felszaporodnak a szabad gyökök, a O2ˇŻ, OHˇ, NOˇ és a reaktív H2O2. Ezek a reaktív káros gyökök és vegyületek gátolhatják vagy ölik a patogéneket, de apoptózist okozhatnak a gazdasejtekben is.
A helyi rezisztencia két formában érvényesül: általános rezisztenciaként, amely többféle kórokozó vagy több patogéntörzs ellen hat, és specifikus rezisztenciaként, amely esetben egyes növényfajták csupán egy-egy kórokozó törzzsel szemben mutatnak ellenállóságot.
Általános, nem specifikus rezisztencia
Újabban vált ismeretessé, hogy baktériumfertőzések ellen is létezik általános rezisztencia. Erről a jelenségről részletesen egy másik tanulmány beszél. A gombafertőzések ellen ható általános rezisztencia két formájáról érdemes megemlékezni. Az egyik lassú kórokozó-sporulációban nyilvánul meg. Ez a rezisztenciaforma elsősorban rozsdagomba-fertőzésekkel kapcsolatban vált ismeretessé. A mechanizmus jelenleg ismeretlen. A másik említésre méltó általános rezisztenciaformát az árpa lisztharmatgomba okozta betegségével kapcsolatban tanulmányozták. Az mlo géntől függő ellenállóképesség a gomba mindegyik rasszával (törzsével) szemben érvényesül, azaz általános hatású, és évtizedek óta hasznosnak bizonyult. Vagyis ebben az esetben az ellenálló képesség igen tartós. Jellemzője még ennek a rezisztenciaformának az, hogy nem hiperszenzitív típusú, vagyis szabad szemmel semmilyen tünet nem látható az ellenálló, fertőzött leveleken. Saját kísérleteink azt mutatták, hogy ha valamilyen reaktív oxigénformát pótolunk a szövetekhez, a hiperszenzitív reakció (HR) itt is megjelenik. A H2O2 vizes oldatát, amely 50 mM-os volt, két-három nappal a fertőzés után permeteztük a levelekre (Hafez - Király, 2003).
Az abiotikus és biotikus stresszek szöveti elhalásokat (nekrózisokat) okoznak a megtámadott növényi szervekben. Az elhalások általában az oxigén szabad gyökök, illetve egyéb reaktív oxigénfajták (ROS) káros hatásának következményei. Mi már régebben kimutattuk (Barna et al., 1993), hogy a nagy antioxidáns kapacitással rendelkező dohányok rezisztensek többféle stressz okozta betegségtünettel (károsítással) szemben. Tehát a nagy antioxidáns kapacitással rendelkező növényfajták multirezisztenciát eredményezhetnek.
A fertőzött, beteg növényben képződő reaktív oxigénfajták, főként a hidrogén-peroxid (H2O2), nemcsak a gazdanövényt károsíthatják, hanem a kórokozó ellen is hathatnak. Korábban már kimutattuk (Király et al., 1997), hogy a baktériumokat borító és védő extracelluláris poliszaccharida (EPS) burok véd a hidrogén-peroxid ölő, illetve károsító hatásával szemben is.
Specifikus rezisztencia (növényfajta/patogén törzs-specificitás)
Extrém ellenállóképesség ("immunis" reakció)
Igen érdekes eset az ún. "extrém rezisztencia", más, nem egészen releváns elnevezéssel az "immunis" reakciót mutató rezisztencia. Ez a specifikus rezisztenciaforma nem kapcsolódik a HR-hez, azaz nem jelennek meg a tipikus nekrotikus foltok a rezisztens növényi szerveken. Egyik igen alaposan tanulmányozott példa a burgonya Rx génje által meghatározott extrém ellenállóképesség, amely a burgonya X vírusa ellen hatásos (Bendahmane et al., 1999). Egy további jól ismert példa a következő: az ún. "immunis" reakciót mutató búzafajták egyes rozsdarasszokkal szemben teljesen tünetmentes reakciót fejtenek ki, HR nélkül.
Hiperszenzitív reakció
Ez a legismertebb és a leginkább vizsgált formája a növényi ellenállóképességnek. A fertőzés helyén néhány sejt, azaz igen kis szöveti rész hirtelen elhal (nekrózis). A kórokozó nem tud szaporodni, nem tud elterjedni a növényben, mert igen hatásos gátlást szenved. A hiperszenzitív típusú ellenállóképesség jelenségét a pázsitfűfélék rozsdabetegségeivel kapcsolatban fedezte fel H. M. Ward (1902) már több mint száz éve.
A hiperszenzitív reakció (HR) specifikussága igen fontos jellemző. Ebben az esetben bizonyos gazdanövénytörzsek ("fajták") ellenálló képességéről van szó, bizonyos kórokozó törzsekkel ("rasszokkal") szemben. Az ellenállóság tehát rassz-specifikus, azaz nem érvényesül minden patogén rasszal szemben, hanem csak egyetlen vagy néhány rasszal szemben. Gyakorlati, növénynemesítési szempontból éppen ez a hátránya ennek a rezisztenciaformának.
A HR típusú rezisztencia akkor valósul meg, ha a növényben lévő rezisztenciagén (R) kapcsolatba kerül a kórokozó ún. avirulencia (Avr) génjével. Valójában a géntermékek reagálnak egymással az utóbbi évekig alig ismert módon. A végeredmény a növény ellenállósága. Ez a rezisztencia "gén-gén kapcsolati hipotézisének" (gene-for-gene hypothesis, Flor, 1971) lényege. Kérdés, hogy a HR (azaz túlérzékenységi nekrózis) szerepet kap-e az ellenálló képességben, vagy csak jelzi a rezisztenciát. A régebbi felfogás szerint a növény "feláldozza" néhány sejtjét, és az elhalt sejtekben a biotróf patogén nem jut tápanyagokhoz. Ez az elképzelés azonban a nekrotróf kórokozók elleni HR esetében nem állja meg a helyét. Itt az a kérdés merül fel, hogy a HR, azaz a növény nekrózisa az ellenálló képesség oka vagy következménye? Mi már régebben, egy gombakórokozóval szembeni HR-rel kísérletezve arra a következtetésre jutottunk, hogy a HR nem oka, hanem következménye a burgonya rezisztenciájának (Király et al., 1972). Újabban ugyanerre a következtetésre jutottak baktériumos betegségek (Yu et al., 1998) és vírusbetegségek (Bendahmane et al., 1999; Cole et al., 2001; Schoelz et al., 2003) rezisztenciájával kapcsolatban is: a HR típusú sejtelhalás és a patogén gátlása két különböző reakciója a rezisztens növénynek.
A hasonlóság mellett azonban különbségek is észlelhetők a növényi és állati szabadgyök-mechanizmusban. Az állati fagocitózis esetében a szuperoxid (O2ˇŻ) reagál a nitrogén-monoxiddal (NOˇ), amikor baktériumölő peroxinitril gyök (ONOOŻ) képződik. A növényekben a HR-rel kapcsolatos szabadgyök-képződés viszont úgy zajlik le, hogy a O2ˇŻ dizmutációja révén keletkezett H2O2 reagál a NOˇ-dal. Ekkor bekövetkezik a HR-rel kapcsolatos sejthalál a növényi sejtekben és feltehetően a kórokozók sejtjeiben is. A ONOOŻ gyök a növényekben nem idéz elő nekrózist.
Géncsendesítés
Itt tulajdonképpen egy természetes vírusrezisztencia-formáról van szó. A géncsendesítés jelenségére akkor derült fény, amikor a kutatók egyes transzgenikus növények esetében azt észlelték, hogy a növénybe átvitt transzgén feltűnően gyengén fejeződik ki. Az esetek többségében a csendesített gén ugyan átíródik, de a messenger RNS degradálódik: ez a poszttranszkripciós géncsendesítés (PTGS). Meglepő, hogy a csendesítés mechanizmusa nemcsak a mesterségesen átvitt transzgénre hat, hanem a növény eredeti, endogén homológ génjére is, amelynek hatását a transzformációval erősíteni akarták. Ez a tény a molekuláris növénynemesítés szempontjából olykor jelentős hátránnyal járhat.
Ha a víruskórokozó genetikai anyagának egy részét (például a köpenyfehérje gént vagy a vírus replikáz gént) transzformációval bejuttatták a növénybe, a transzgenikus növény rezisztens lett a vírus fertőzésével szemben (RNA-mediated virus resistance). Ez a rezisztencia csak olyan rokon vírustörzsek ellen hatásos, amelyek szekvenciahomológiát mutatnak azzal a vírussal, amelyből az átvitt transzgénszekvencia származott. A géncsendesítés és a vírus RNS-től függő rezisztencia tehát egy jelenség két változata: mindkét esetben a "messenger elöléséről" van szó (lásd Király, 1999; 2002).
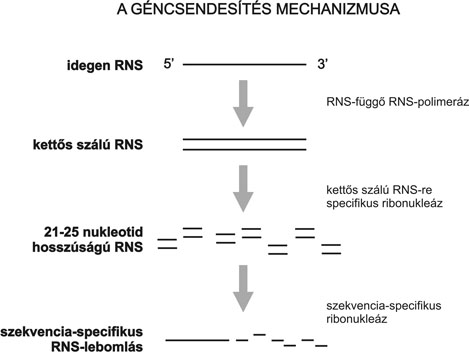
Ha a növény felismeri, hogy az idegen transzgén mRNS vagy az idegen vírus RNS mennyisége egy küszöbértéken felül már túlságosan nagy, beindul az RNS degradálás (azaz a rezisztencia). A degradálás mechanizmusa szerint (1. ábra) az RNS-től függő RNS-polimeráz antiszenz RNS molekulákat hoz létre, amelyek szekvenciahomológiát mutatnak a transzgén mRNS-sel, illetve a vírus RNS-sel.
 1. ábra
1. ábra
Ez lehetővé teszi azt, hogy kettős szálú RNS-struktúrák jöjjenek létre. Ezeket a struktúrákat a növény nem ismeri, ezért ribonukleázokkal degradálja őket.
Egy hazai kutatócsoport (Szittya et al., 2002) újabban egy különleges géncsendesítési mechanizmusra hívta fel a figyelmet. Kimutatták, hogy egy vírussal fertőzött növényben előforduló defektív, interferáló vírus RNS géncsendesítés segítségével gátolja saját vírusa (a helper vírus) tüneteit és replikációját.
Összefoglalva tehát, a géncsendesítés lényege az, hogy a növény nem ismeri a kettős szálú RNS-struktúrákat, és ezeket ribonukleázokkal degradálja. A géncsendesítés jelenségét tovább komplikálja az az újabban felismert tény, hogy a növényi vírusok géncsendesítést gátló fehérjéket expresszálnak, és így hozzájárulnak a vírustünetek módosításához (lásd Silhavy - Burgyán, 2004).
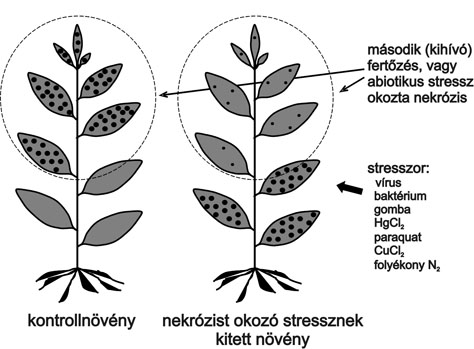
A bevezetőben már említés történt arról, hogy létezik olyan rezisztenciatípus is, amely esetben a növény egyes részei ugyan megbetegednek, de a távoli, betegségtüneteket nem mutató növényi részek nem betegednek meg egy következő, újabb fertőzés után sem (szisztemikus hatás). Ez valójában szerzett rezisztenciát (immunitást) jelent, és emlékeztet a magasabbrendű állatvilág körében észlelt immunmemóriára (2. ábra).
 2. ábra
2. ábra
Ezt a szerzett rezisztenciát csak olyan fertőzések és stresszek képesek indukálni a távoli, egészséges növényi részekben, amelyek sejt- illetve szöveti nekrózist idéznek elő a fertőzött vagy stresszelt növényben. Emiatt helyesen nem immunmemóriáról, hanem stresszmemóriáról kell beszélnünk. Egy első, szöveti elhalásokkal járó stressz rezisztenciát idéz elő a szomszédos vagy akár a távoli szövetekben is egy újabb (második) stresszel szemben. A kórokozó nem gátlódik szükségszerűen, de azokban a szövetekben, amelyekben a fertőzés utáni nekrotizálódás visszaszorul, a nekrotróf patogének nem tudnak szaporodni.
A szisztemikus szerzett rezisztencia jelenségét Ross (1961) írta le először a dohány mozaikvírus nekrotikus tüneteket előidéző fertőzésével kapcsolatban. A mechanizmusra később derült fény. Két kutatólaboratórium szinte egyszerre közölte azt a felismerést, hogy a szisztemikus szerzett rezisztenciával rendelkező levelekben a szalicilsav felhalmozódik még a második fertőzés előtt. A szalicilsav felhalmozódása a távoli levelek szerzett rezisztenciáját előidéző első fertőzés után is észlelhető az egyébként fogékony növényi részekben.
Az elmúlt néhány évben kísérleteink alapján arra a következtetésre jutottunk, hogy a szalicilsav rezisztenciát előidéző hatása tulajdonképpen azon alapszik, hogy a szalicilsavat felhalmozó, illetve a szalicilsavval kezelt szövetekben az antioxidánsok (szuperoxid dizmutáz, glutation reduktáz, glutation-S-transzferáz) aktivitása, illetve mennyisége (glutation) megnövekszik (Fodor et al., 1997). A fokozott antioxidáns aktivitás csökkenti a sejtek nekrotizálódását. Újabban azt is kimutattuk, hogy azokban a transzgenikus dohányokban, amelyekben a szalicilsav nem tud felhalmozódni, mert katechollá alakul, és amelyekben a rezisztencia sem fejlődik ki, az antioxidánsok aktivitása nem változik a szisztemikus rezisztencia indukálásának hatására, hanem egyes antioxidáns enzimek aktivitása még csökken is (Király et al., 2002). A szalicilsav elsődleges szerepe a rezisztencia indukálásánál tehát abban van, hogy az antioxidánsok serkentése által detoxifikálja a káros reaktív oxigénfajtákat.
Kulcsszavak: növénykórtan, betegség ellenálló képesség, növényvédelem, rezisztencia-nemesítés
Irodalom
Barna Balázs - Ádám Attila - Király Zoltán (1993): Juvenility and Resistance of a Superoxide-tolerant Plant to Diseases and Other Stresses. Naturwissenschaften. 80, 420-422
Bendahmane, Abdelhafid - Kanyuka, Konstantin - Baulcombe, David C. (1999): The Rx Gene from Potato Controls Separate Virus Resistance and Death Responses. Plant Cell. 11, 781-791
Cole, Anthony B. - Király, L. - Ross, K. - Schoelz, J. E. (2001): Uncoupling Resistance from Cell Death in the Hypersensitive Response of Nicotiana Species to Cauliflower Mosaic Virus Infection. Molecular Plant - Microbe Interactions. 14, 31-41
Flor, Harold H. (1971): Current Status of the Gene-for-Gene Concept. Annual Review of Phytopathology. 9, 275-296
Fodor J. - Gullner G. - Ádám A. L. - Barna B. - Kőmíves T. - Király Z. (1997): Local and Systemic Responses of Antioxidants to Tobacco Mosaic Virus Infection and to Salicylic Acid in Tobacco. Plant Physiology. 114, 1443-1451
Hafez, Yasser M. - Király, Z. (2003): Role of Hydrogen Peroxide in Symptom Expression of Barley Susceptible and Resistant to Powdery Mildew. Acta Phytopatologica et Entomologica Hungarica. 38, 227-236
Király Lóránt (1999): The Silencing of (Trans)Genes - A Mechanism of Virus Resistance in Plants. Acta Phytopatologica Et Entomologica Hungarica. 34, 263-275
Király Lóránt (2002): (Transz)gének csendesítése - A vírusrezisztencia egyik formája növényekben. I. Két biológiai jelenség - egy mechanizmus. Növénytermelés. 51, 223-231. II. Molekuláris mechanizmus és gyakorlati alkalmazások. Növénytermelés. 51, 331-343
Király Zoltán - Barna Balázs - Érsek T. (1972): Hypersensitivity as a Consequence, Not the Cause, of Plant Disease Resistance to Infection. Nature. 239, 215-219
Király Zoltán - El-Zahaby, H. M. - Klement Zoltán (1997): Role of Extracellular Polysaccharide (EPS) Slime on Plant Pathogenic Bacteria in Protecting Cells to Reactive Oxygen Species. Journal of Phytopathology. 145, 59-68
Király Z. - Barna B. - Kecskés A. - Fodor J. (2002): Down-Regulation of Antioxidative Capacity in a Transgenic Tobacco Which Fails to Develop Acquired Resistance to Necrotization Caused by TMV. Free Radical Research. 36, 981-991
Ross, A. F. (1961): Systemic Acquired Resistance Induced by Localized Virus Infections in Plants. Virology. 14, 340-358
Schoelz, James E. - Palanichelvam, K. - Cole, A. B. - Király L. - Cawly, J. (2003): Dissecting the Avirulence and Resistance Components That Comprise the Hypersensitive Response to Cauliflower Mosaic Virus in Nicotiana. In: Stacey, G. - Keen, N. T. (Eds.): Plant-Microbe Interactions. Vol. 6. APS Press, St. Paul, Minn. USA, 259-283
Silhavy Dániel - Burgyán József (2004): Effects and Side-Effects of Viral RNA Silencing Suppressors on Short Rnas. Trends in Plant Science. 9, 76-83
Szittya György - Molnár A. - Silhavy, D. - Hornyák Cs. - Burgyán J. (2002): Short Defective Rnas of Tombusviruses Are Not Targeted But Trigger Post-Transcriptional Gene Silencing Against Their Helper Virus. Plant Cell. 14: 359-372
Ward, H. M. (1902): On the Relations Between Host and Parasite in the Bromes and Their Brown Rust, Puccinia Dispersa (Erikss.). Annals of Botany. 16, 233-315.
Yu, I-ching - Parker, Jane - Bent, Andrew F. (1998): Gen-for-Gene Resistance Without the Hypersensitive Response in Arabidopsis Dndl Mutant. Proceedings of the National Academy of Sciences of the USA. 95, 7819-7824