A baktériumos növénybetegségek gazdasági kártétele nem olyan jelentős, mint akár a vírusos, akár a gombás betegségeké. Jelentőségük azonban az utóbbi évtizedben felértékelődött, mert a molekuláris fitopatológiai kutatásokban a baktérium-növény kapcsolat tanulmányozása módszertanilag könnyebb, és ennek köszönhetően a védekezési mechanizmusok megismerésében számos új eredmény született. Ezért szeretném én is e modellen keresztül bemutatni a növényi immunrendszer patológiai, fiziológiai és molekuláris mechanizmusait. Jelenleg még a kezdetén vagyunk annak, hogy megértsük ennek az elegáns és sokszínű védekezési mechanizmusnak minden részletét.
A növénykórokozó baktériumok szinte valamennyi gazdasági növényünket képesek megbetegíteni, különböző tüneteket (nekrózisokat, foltosodásokat, lágyrothadásokat, hervadásokat, tumorokat stb.) okozva. Ezek a tünetek azonban már csak akkor jelentkeznek, amikor a kórokozónak sikerült áttörnie a növény védekezési mechanizmusait, vagy különböző "trükköket" alkalmazva kikerülnie azokat. A patogenitásnak döntő kritériuma a kórokozó tömeges felszaporodása, ezért a hatékony és azonnali válaszreakció a kórokozó kezdeti megfékezésére a gazdaszervezet túlélése szempontjából alapvető fontosságú.
A növényi szervezet védekezési rendszerének alapvető jellemvonása
A növényi immunrendszer lényege is abban áll, hogy képes megkülönböztetni egymástól a saját és a nem saját (vírus, baktérium, gomba stb.) idegen anyagokat, illetve sejteket, és a felismerés után beindítani a védekezési rendszert, amivel az idegent hatástalanítja. Minden olyan esetben, amikor ez a felismerés késlekedik vagy elmarad, a betegség súlyos formái jelentkeznek. A növények esetében is, az állati immunrendszerhez hasonlóan, kétféle védekezési rendszert különíthetünk el: (1) általános (eredendő) nem specifikus rezisztencia, ami az állatvilágban természetes (veleszületett) immunitásnak felel meg, továbbá (2) a kórokozókra fajlagos ún. specifikus (hiperszenzitív) rezisztencia, amely az állatvilágban az adaptív (szerzett) immunrendszerrel analógnak tekinthető. A növényeknél az előbbi tünetmentes, az utóbbi sejt-, illetve néhány sejtre kiterjedő nekrózissal jár. Még mielőtt ezeket a védekezési mechanizmusokat részletesen tárgyalnánk és összehasonlítanánk, fel kell hívni a figyelmet a növényi és állati szervezet funkcionális jellegéből adódó alapvető különbözőségre is. Ez a különbözőség elsősorban abból adódik, hogy míg az állatvilágban védekezésre specializálódott sejtek (makrofágok, limfociták stb.) végzik el az aktív védekezést, addig a növényvilágban ilyen specializálódott sejtek nincsenek, hanem minden egyes növénysejt önmaga védekezik. A növényvilágban szintén ismeretlen a humorális (antigén-antitest) és egyéb, például citokinek termelésével kapcsolatos védekezési mechanizmus. Ennek elsődleges oka, hogy a növényekben nincsen olyan keringési rendszer, amely ezeknek a védekező sejteknek és anyagoknak a fertőzés helyére történő szállítását végezné (Klement, m. a.).
A baktériumok a növényi bőrszövetet közvetlenül nem tudják áttörni (ez csak egyes kórokozó gombák tulajdonsága), így a levél felületén landoló és tanyázó nagyszámú mikroorganizmus leginkább természetes úton, a harmat- és esőcseppek segítségével mosódik be a növény természetes nyílásain, elsősorban a nyitott légzőnyílásokon keresztül a levelek és hajtások sejtközötti járataiba, vagy közvetlenül sérüléseken, sebzéseken át fertőzi a szöveteket. Itt a növényi sejtbe történő behatolást a szilárd sejtfal meggátolja, ezért a növénykórokozó baktériumok mindig csak a sejtközötti járatokban szaporodnak, ahol a sejteket körülvevő intercelluláris folyadékban bőven megtalálják a növekedésükhöz és kezdeti szaporodásukhoz szükséges tápanyagokat.
Módszert dolgoztunk ki a levelek sejtközötti folyadékának kinyerésére, és azt tapasztaltuk, hogy ebben a fluidban patogének és nem patogének egyaránt jól szaporodnak. Az élő növényben azonban csak az adott növényre kompatibilis kapcsolatban levő kórokozó képes szaporodni. Ez arra enged következtetni, hogy az élő növénysejt a számára idegen mikroorganizmust felületi molekulái alapján képes felismerni, és terjedését meggátolni. Ez a gátlás alapvetően az általános, nem specifikus rezisztenciának köszönhető, amely minden növényben a fajtól függetlenül, eredendően működik: felismeri az idegent, és néhány órán belül kifejleszti azt a mechanizmust, amivel elpusztítja az idegent anélkül, hogy saját maga fenotípusosan károsodna. Ezért ez a védekezési mechanizmus még sejtszinten is tünetmentesen játszódik le. Ennek köszönhető, hogy észre sem vesszük ezeknek a mikrobáknak a támadását, és valószínűleg az is ennek köszönhető, hogy az általános rezisztencia felismerése ezidáig késlekedett.
A fertőzést követő védekezés kezdetben még csak egy-egy növénysejtre korlátozódik, ezért számunkra sokszor láthatatlan, érzékelhetetlen. Ezért a kutatásban nagy fellendülést hozott a baktériumoknak a sejtközötti járatokba való injektálási módszere, amelynek segítségével elértük, hogy az injektált levélszövet minden egyes sejtje egy időben érintkezzen legalább egy-egy kórokozóval, és ezáltal a folyamatokat kiterjedtebb, szöveti szinten szinkronizáltan követhettük (Klement et al., 1963). E módszer alkalmazásának másik fontos eredménye volt a baktériumos hiperszenzitív reakció (HR) felismerése és szöveti szinten történő megjelenítése (Klement et al., 1964), továbbá annak a lehetősége, hogy olyan baktérium transzpozon mutánsokat is bevezethettünk a növénybe, amelyek elveszítették hiperszenzitív reakciót kiváltó tulajdonságukat és egyben kórokozó képességüket. Ezzel vált lehetővé más, HR-től független védekezési mechanizmusok, például az általános rezisztencia feltárása is (Klement et. al., 2003). E két fontos védekezési mechanizmus jellemzőit az 1. táblázat mutatja be.
Általános (eredendő) rezisztencia Az általános rezisztencia patológiai jelentősége
A növényi immunitás megismerésének első fázisában a kutatók elsősorban a hiperszenzitív reakció és az azzal kapcsolatos szisztemikus szerzett rezisztencia feltárásával foglalkoztak, és csak az utóbbi évtizedben fordultak egyre nagyobb érdeklődéssel az általános, nem specifikus (innate) rezisztencia megismerése felé. Ezen a területen is úttörő munkát végeztek a magyar kutatók. Itt elsősorban kell megemlíteni Lovrekovich László és Farkas Gábor (1965) munkásságát, akik először igazolták kísérletileg az általános rezisztencia létét. Később, a 70-es évek végén Burgyán és Klement (1979) bizonyították, hogy az általános rezisztenciának (amit ők lokális indukált rezisztenciának hívtak) egy korai (early induced resistance: EIR) és egy késői formája (late induced resistance: LIR) különíthető el. Az EIR a fertőzést követő néhány óra alatt kifejlődik, de aránylag rövid ideig tartó védelmet ad. Ennek a szerepét veszi át a LIR, amely viszont több, 6-7 napig is tart. Mivel az általános rezisztencia tünetmentes, jelenlétét csak közvetve tudjuk érzékelni, nevezetesen egy második fertőzés gátlásával, vagy a HR nekrózis elmaradásával. Ezek a jelenségek is a baktériumszaporodás gátlására utalnak.
Jelentősége nemcsak patológiai, hanem általános biológiai szempontból is érdekes, mert az eddigi vizsgálatok szerint elsősorban ennek a mechanizmusnak köszönhető, hogy a szaprofita mikroorganizmusok az élő növényt nem tudják elárasztani és táplálékul felhasználni. Ha azonban a növény kedvezőtlen környezetben vagy rossz fiziológiai állapotban van (hideg vagy meleg hatás, öregedés, stb.), elveszti ezt a képességet, és akkor a szaprofiták és opportunista patogének is fokozatosan felszaporodnak, és a növény halálát okozhatják.
Ez a védekezési mechanizmus lokális, mert csak a baktériumsejttel érintkező növénysejtben alakul ki. Nem specifikus, mert az eddig vizsgált valamennyi növényben működik, és számos mikroorganizmus, patogének és szaprofiták egyaránt indukálják.
Az általános rezisztenciát nemcsak a szaprofitonok, hanem a gazdanövényre nézve idegen patogén (inkompatibilis) baktériumok is indukálják, sőt, a patogenitását vagy virulenciáját vesztett mutánsok is. Érdekes, hogy a gazdanövénynek megfelelő (kompatibilis) kórokozó elölt formája az általános védekezést megindítja, az élő, virulens formája viszont semlegesíti. Ennek is köszönhető, hogy a valódi patogének a kompatibilis gazdanövényben szaporodásra képesek (lásd később).
Az általános rezisztencia gyors kifejlődését és hatásosságát a fertőzött növény fiziológiai állapota és a környezeti körülmények jelentősen befolyásolják. Ez elsősorban a levél korától függ. Idősebb levelekben az általános rezisztencia lelassul, a sárguló levelekben már nem is működik. Szélsőséges időjárási körülmények között hasonló gátlás érzékelhető. Általában fiatal, jól fejlődő növényekben, ahol az intenzív fehérjeszintézis biztosított, az általános rezisztencia 1-2 óra alatt kifejlődik, idősebb levelekben ez 4-6 órát igényel, sárguló levelekben pedig már nem működik (Klement et al., 2003).
Az általános rezisztencia fiziológiai és molekuláris kifejlődése
Az általános rezisztencia fenotípusosan nem jelenik meg, de elektronmikroszkóposan a baktériumsejttel érintkező sejtfalrészek megvastagodása, papillaképződés és baktériumsejt becsomagolását előidéző hártyaképződés látható, ami a baktériumsejt becsomagolásához és pusztulásához vezet (Ott et al.,1997). Ezeken a helyeken erős peroxidáz és H2O2 festődés figyelhető meg (Bozsó et al., 2004). Ez a folyamat erősen hasonlít az állati szervezetben lezajló fagocitózishoz.
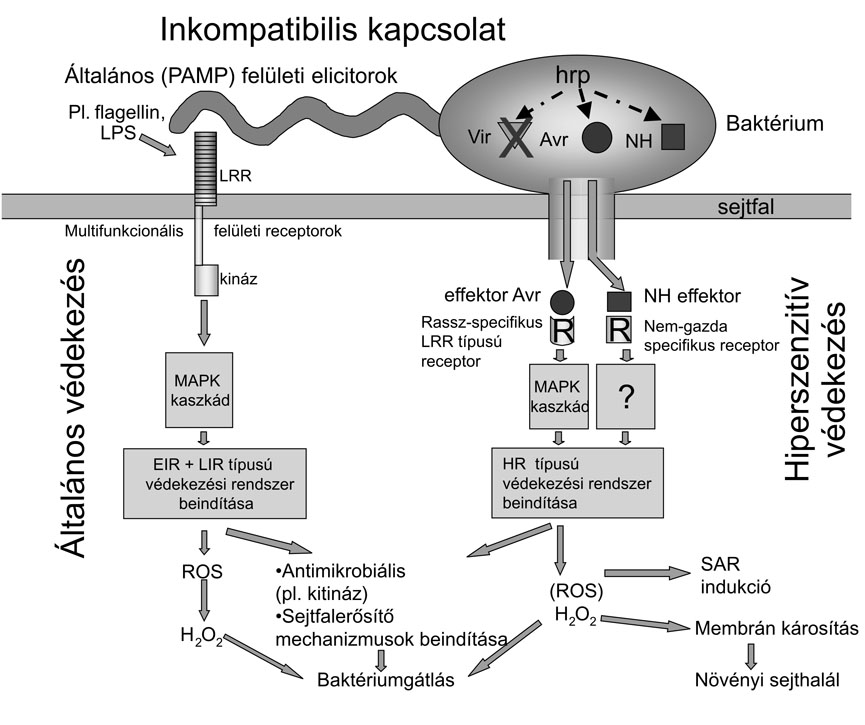
A növényi védekezés beindításának első lépése az idegen felismerése, amelyet a növények és az állatok egyaránt úgy oldanak meg, hogy érzékelő molekulákat, ún. jelfogókat, más szóval receptorokat fejlesztettek ki. Ezek a receptorok az állatvilágban ismert Toll receptorokhoz hasonló módon leucin-rich-repeat (LRR) régiókat tartalmaznak. A jelfogó receptorok vagy a növénysejt felületén, vagy a sejten belül helyezkednek el (1. ábra).
Az extracelluláris LRR receptorok a növények általános védekezési mechanizmusának jelfogói. Ezzel szemben az intracelluláris LRR receptorok, amelyeket R (rezisztencia) géneknek nevezünk, a hiperszenzitív védekezési mechanizmusra jellemzőek.
A multifunkcionális felületi receptorok képesek felismerni a mikroorganizmusok felületén általánosan meglévő, az evolúció folyamán megőrzött és fennmaradt molekuláris mintázatokat (1. ábra). Ezeket a mintázatokat összefoglaló néven PAMP-nak (pathogen associated molecular patterns) nevezik. A pathogen associated megjelölés nem teljesen helyes, mert nemcsak a patogének, hanem a szaprofitonok is hasonló felületi molekulákat hordoznak. Ide tartozik például a baktérium falát alkotó lipopoliszaharid (LPS) vagy LPS-fehérje komplex, vagy a bakteriális flagellin, amely a csillókat felépítő fehérje monomerje, és feltételezhetően más molekulák is. Mindezekre a felületi molekulákra jellemző, hogy a baktériumsejt általánosan előforduló konzervatív (eredendő) elemei, amelyek az evolúció során is megőrződtek. Ezeket a növényi reakciót kiváltó anyagokat elicitoroknak is nevezzük. Növényekben paradicsom, lúdfű (Arabidopsis) csíranövényben és sejtkultúrával végzett kísérletek feltárták, hogy a Pseudomonas syringae pv. tomato flagellinje hatékony elicitorként működik. A receptormolekulát is klónozták (Gómez-Gómez-Boller, 2002), amely szerkezetileg nagyon hasonlít az emlős és Drosophila-receptorokhoz, amelyeknek sejten kívüli domenjében leucingazdag ismétlődés (LRR) van. A felületi receptorokhoz tartozó sejten belüli kinázrészek szintén közös kiindulási alakra, közös ősre vezethetők vissza. Laboratóriumunkban Szatmári Ágnes is azonosított Arabidopsisban ilyen receptor-kináz (RLK) gént, melynek megnövekedik a sejtmagbeli átíródása patogenitását vesztett mutáns baktériummal való fertőzés hatására.
A sejtfelszíni receptorok azonnal üzenetet küldenek a sejt belsejébe a mikroorganizmus jelenlétéről. Ez a sejten belüli üzenetküldés a mitogén aktivált protein kinázok (MAPK) kaszkádjain keresztül történik. (1. ábra). A kaszkád egymást foszforiláló kinázokból áll (MAPKKK, MAPKK és MAPK), amelyek akkor lépnek működésbe, ha a receptor felől jelzés érkezik. Eddig két növényi MAPK kaszkádot derítettek fel részletesen, egyet a dohányban és egyet az Arabidopsisban. E teljes útvonal feltérképezésével lehetőség nyílt a Drosophilában és az emlősökben zajló folyamatokkal való összehasonlítására, amelyekkel meglepő párhuzam mutatkozik (Asai et al., 2002).
Az eddigiekben a betolakodó idegen felismeréséről és a sejt belsejében történő üzenetküldésről volt szó. Most nézzük a sejtek válaszát, védekezési reakcióját a kórokozó ellenében.
Király Zoltán dolgozatában már említette, hogy a reaktív oxigénformák (ROS) termelődésének a növényi védekezésben is nagy jelentőségük van. Erre először a hiperszenzitív reakcióval kapcsolatban derült fény, de laboratóriumunk eredményei azt mutatták, hogy az általános rezisztenciában is alapvetőek, bár a mennyiség és a sebesség eltérő lehet (Bozsó et al., 1999). Vizsgálataink szerint az általános rezisztenciára jellemző korai indukált rezisztenciában (EIR) elsősorban a hidrogén-peroxid (H2O2) molekulának van jelentősége. Mivel a baktérium a növénysejtbe nem jut be, az idegen lokalizálását az érintkezés helyénél a sejten kívül, a sejtközötti járatokban kell megoldani. A H2O2 kórokozóra való hatása még nem teljesen ismert, de a kísérleteink azt bizonyítják, hogy a baktériumok szaporodása korlátozódik, a baktériumszám csökken, és a patogenitásért felelős hrp gének aktivitása is lecsökken (Bozsó et al., 1999). Ez a folyamat gyakran együtt jár növényi sejtvastagodással és papillaképződéssel, valamint a sejtfalból kiinduló hártyaképződéssel, amely a baktériumsejt becsomagolását, immobilizációját eredményezi (Ott et al., 1997). Feltételezhető, hogy a becsomagolt térben a H2O2 koncentrációja megnő, és így toxikus hatása felerősödik.
Nem ismert még pontosan, hogy milyen további tényezők játszanak szerepet a baktériumgátlásban az általános védekezési rendszer eredményeként. Laboratóriumunkban Ott Péter és Varga Gabriella legutóbb kimutatta, hogy egyes kitinázok a patogenitását vesztett élő vagy hővel elölt patogének, valamint szaprofitonok fertőzésére is megjelennek, egy első vonalbeli gyors válasz (4-6 óra) részeként. A növényi kitinázokat a kórokozó gombák elleni védekezés egyik tényezőjének tartják. Ismert néhány kitináz megjelenése vírusfertőzés és stresszérzékenység esetében is. Hogy milyen szerepük lehet a baktérium közvetlen gátlásában, az jelenleg még kérdéses.
A hiperszenzitív védekezés patológiai jelentősége
A növényeknek a gyors sejtelhalással kapcsolatos védekezési mechanizmusát hiperszenzitív védekezési reakciónak (HR) hívjuk. A baktériumok elleni védekezés első leírása ötven évvel ezelőtt laboratóriumunkból származik (Klement, 1963; Klement et al., 1964). A hiperszenzitív reakciót csakis a patogén baktériumok képesek indukálni, szaprofitonok nem. A patogén baktériumok az általános védekezési mechanizmust - annak ellenére, hogy szintén indukálják - gyakran "átlépik", és így sejtnekrózist okoznak (Bozsó et al., 1999). Az elhalás mértéke egy sejt nekrózisától a nagy szöveti elhalásokig terjedhet, attól függően, hogy a növény-baktérium kapcsolat milyen mértékű inkompatibilitással vagy kompatibilitással bír. Amennyiben egy adott kórokozó nem a saját gazdanövényét fertőzi, hanem egy más növényfajt (például a bab kórokozó a dohányt), akkor a nekrózis csak a baktériummal érintkező egy-két növénysejtre terjed ki. Ilyenkor a fertőzés csak mikroszkopikus szinten látható. Ha ez a kórokozó a saját gazdanövényének a rezisztens változatát fertőzi, akkor a rezisztencia fokától függően a kórokozó kezdeti szaporodása miatt több sejtre is kiterjedő, gyakran még szabad szemmel is látható apró foltokat okoz, de a tipikus betegség nem fejlődik ki. Ezeket inkompatibilis kapcsolatoknak hívjuk, szemben a kompatibilis kapcsolattal, amikor a kórokozó a saját gazdanövényének fogékony fajtáját fertőzi. Ilyenkor a nekrózis később kialakuló, folyamatosan növekvő, nagy kiterjedésű szöveti elhalásokat okoz, és végül kifejlődik a betegség.
A kórokozó és növénysejt intim kapcsolatára utal, hogy már egy baktériumsejt is képes megindítani a növényi sejthalált okozó HR-t. Érdekes megfigyelés az, hogy minél távolabbi a kapcsolat a patogén és növény között, annál kevesebb baktériumsejtre van szükség a sejtnekrózis indukálásához. Idegen faj esetében ehhez egy-tíz baktériumsejt elegendő. A gazdanövény rezisztenciafokától függően ennél több baktériumsejt is szükséges növénysejtenként a HR indukálásához. Vagyis ez annyit jelent, hogy a gazdaidegen fajban a felismeréshez már egy baktériumsejt is elég, a saját gazdanövény rezisztens fajtájában azonban a felismerés késik, így a baktériumok még néhány osztódásra képesek, mielőtt a növény észrevenné őket. Fogékony kapcsolatban ez az idő elegendő ahhoz, hogy az újonnan születő baktériumsejtek EPS burokkal (lásd később) álcázzák magukat, és így a felismerés hiányában tovább szaporodjanak és betegséget okozzanak. Ennek következményeit később tárgyaljuk.
Azért beszélünk inkompatibilis vagy kompatibilis kapcsolatról, mert a kölcsönhatás mindkét szereplője, tehát a növény és a kórokozó is meghatározza a kapcsolat milyenségét. A kórokozók is, ennek megfelelően, új patotípusokat vagy rasszokat fejleszthetnek ki a túlélés érdekében. Mivel mind a növény ellenállóságát, mind a kórokozó patogenitását és fajtaspecificitását gének határozzák meg, következésképpen a hiperszenzitív védekezési rendszert is a kórokozó és a gazdanövény génjeinek kölcsönös kapcsolatrendszere határozza meg. Ezért nevezzük a hiperszenzitív védekezési reakciót specifikus gene-for-gene rezisztenciának. Ahogyan az evolúció folyamán fokozatosan új fajták alakultak ki, úgy az ember is az újabb és újabb betegség-ellenálló fajták nemesítésével ezt az evolúciós folyamatot felgyorsította, mert az új rezisztens fajta már nyolc-tíz év múlva elveszíti a kórokozóval szembeni rezisztenciáját. Ez azért következhet be, mert a kórokozó patogenitását biztosító gének is olyan mutáción esnek át, amely a gén a génnel szembeni rezisztenciakapcsolatnak már nem felel meg, és így a korábban kialakított rezisztencia elvész.
A HR kevéssé függ a növény fiziológiai állapotától vagy a környezeti körülményektől. Kialakulása három fázisra osztható: 1/ indukciós idő, 2/ latenciafázis, 3/ baktérium és növénysejt kollapszusa (Klement, 1984). A legfontosabb fázis az indukció, amely általában egy-három órát vesz igénybe. Ez alatt a kórokozónak van elsődleges szerepe, mert a hrp gének aktiválása és a III. típusú szekréciós rendszer kiépítése (lásd később) ez idő alatt történik. Csak élő, metabolikusan aktív baktériumsejt képes az indukcióra. A latenciafázis az indukció megtörténtétől a sejtkollapszus kezdetéig tart. Ez még tünetmentes folyamat, és már független a kórokozó jelenlététől. Ez bizonyítható azzal, hogy ha az idukciós idő után a baktériumokat a szövetben elöljük, például antibiotikummal, a sejtkollapszus élő baktériumsejt nélkül is létrejön. Ebben a szakaszban történik az R gének aktiválása, a különböző szignálrendszerek kiépítése, a HR típusú védekezési rendszer beindítása. A harmadik szakaszban látványos fenotípusos változás, a növényi sejt vagy szövet kollapszusa és elhalása következik be. Ez részben annak köszönhető, hogy a keletkezett nagymennyiségű toxikus szabadgyök nemcsak a baktériumok károsításában vesznek részt, hanem a növényi sejtmembránok lipid peroxidációjában is. Ennek köszönhető, hogy a membránok permeabilitása hirtelen, irreverzibilisen megnő, aminek következtében a vakuolumban levő, sokszor toxikus fenolvegyületek a citoplazmába ömlenek. Mindezek a folyamatok gyorsan, a fertőzéstől számított hat-huszonnégy óra alatt fejlődnek ki, így a sejt, illetve a levélszövet kollapszusa látványosan jelenik meg.
Mivel a rezisztens növényben ezek a folyamatok csak egy-egy, a kórokozóval közvetlen érintkező növénysejtben játszódnak le, a sejtnekrózis számunkra legtöbbször rejtve marad, a növény egészségesnek tűnik. Ha azonban nagyobb mennyiségű kórokozót injekciózunk a növény szövetébe, akkor a HR szöveti nekrózis formájában láthatóvá válik (Klement, 1963), és így a folyamat szöveti szinten is vizsgálható.
A hiperszenzitív és egyéb nekrózisok a környező növénysejtekben szalicilsav-képződést indítanak el, amely a szisztemikus szerzett rezisztencia beindításáért felelős. Ez egyfajta nemspecifikus memóriajelzést küld a távoli szövetekbe, amelyek sejtjeit ezáltal felkészíti az esetleges későbbi fertőzések leküzdésére (lásd Király Zoltán dolgozatát).
A HR kialakulása molekuláris szinten
Ezek után nézzük meg, hogyan alakul ki a hiperszenzitív sejt vagy szövetnekrózis molekuláris szinten. Ennek megismerése is csak az injekciós infiltrálási módszer alkalmazásával vált lehetővé, mert minden egyes növénysejt azonos időben, egyszerre fertőzhető, és így a folyamat szöveti szinten szinkronizálható.
A növények specifikus hiperszenzitív rezisztenciáját a rezisztencia- (R) gének vagy termékeik és a kórokozó avirulencia (avr) géntermékek (effektor fehérjék) kölcsönhatása szabja meg. Ez más szóval azt jelenti, hogy a különböző gazdanövényfajtákra specifikus R génjei a kórokozó megfelelően specifikus géntermékeit, az Avr effektor fehérjéit felismerik-e. Amennyiben a felismerés eredményes, akkor a növény hiperszenzitíven reagál (gyors nekrózis), ami egyidejűleg a kórokozó elpusztítását is eredményezi. Amennyiben ez a gyors felismerés nem jön létre (például új patogén rassz vagy új növényfajta találkozásánál), akkor a kórokozó felszaporodhat, és a betegség kialakul. A specificitást a "gén a génnel szemben" (gene-for-gene) (vagyis az avr gén a R-génnel szemben) rendszer biztosítja. Ez szemléletesen kifejezve úgy működik, mint a kulcs a zárban.
A hiperszenzitív rezisztenciánál, mint láttuk, a sejtközötti járatokban élő baktériumsejtben kifejeződő Avr-molekuláknak kölcsönhatásba kell lépniük a növényi sejt belsejében lévő LRR típusú R gén receptorokkal. Ezért a kórokozó baktérium a növénysejttel érintkezve, egy "csatorna" kiépítésével injektálja be effektor fehérjéit a gazdasejt belsejébe (1. ábra). Növénykórokozó baktériumok esetében ezt a feladatot a hrp génegyüttes szabályozza. Érdekes, hogy egyes humán patogén kórokozók (Yersinia, Salmonella, Shigella, E. coli stb.) is a hrp génekhez hasonló (III. típusú szekréciós) rendszert alakítottak ki, és nagymértékben rokon hrp-fehérjéket kódolnak.
Az R gének aktiválása a növény védekezési rendszerét indítja be, amelynek egyik eredményeként nagy mennyiségű toxikus szabad gyök és reaktív oxigénfajta (reactive oxygen species - ROS) keletkezik (1. ábra).
Az így létrejött H2O2 a sejtmembránok lipid peroxidációját okozza. Ezért a membránok permeabilitása irreverzibilisen megnő, ami aztán a megtámadott sejt halálához vezet. Az is feltételezhető, hogy ennek következtében a vakuolumban lévő toxikus fenolvegyületek a citoplazmába ömlenek, ami jelentősen hozzájárulhat a növényi sejthalálhoz. Mivel a plazmamembrán áteresztőképessége is megnő, az ROS és egyéb toxikus anyagok a sejtközötti járatokba is kijutva, az ott lévő patogéneket is károsítják.
Az általános és a hiperszenzitív védekezés lehetséges összefüggései
A növényeknél az általános és a hiperszenzitív védekezés közel egyidőben, párhuzamosan zajlik. Ma még kevés információnk van arról, hogy a két mechanizmus hogyan épül egymásra, vagy netán egymástól függetlenül dolgoznak. Mindenesetre elgondolkoztató, hogy mind az általános, mind a specifikus hiperszenzitív rezisztenciát biztosító receptorok molekuláris felépítése nagyon hasonló (LRR típusú receptor). A receptorok közös molekuláris felépítése arra enged következtetni, hogy a HR típusú rezisztencia az evolúció folyamán az általános rezisztenciából származik. Ebből adódhat, hogy néhány szerző mindkét mechanizmust az általános rezisztencia alatt tárgyalja. Mindenesetre az jellemző különbség, hogy az előbbi a szaprofitonok és patogének közös konzervatív felületi elicitorait ismeri fel, az utóbbi csak a patogének Avr effektor fehérjéit.
Úgy tűnik, hogy a két védekezési típus egymást támogatva és hatásában felerősödve dolgozik. Ezt támasztják alá Bozsó Zoltán és munkatársainak folyamatban lévő genomikai vizsgálatai is, miszerint a Medicago truncatula több száz génjének kifejeződése közös volt az általános és hiperszenzitív rezisztencia kifejlődése alatt, és arányaiban hasonló mennyiségű gén aktiválódott vagy represszálódott az EIR-re vagy a HR-re jellemzően. Ezeket az eredményeket az Arabidopsisszal végzett vizsgálatok is megerősítik. Hasonlóképpen megfigyelhető, hogy az általános rezisztenciára jellemző kitináztermelés a hiperszenzitív védekezés hatására is felerősödik (Varga és munkatársai személyes közlése).
Azonban kísérletileg az is bizonyított, hogy ha fertőzés hatására az általános rezisztenciára jellemző korai indukált rezisztencia (EIR) gyorsabban, már a hiperszenzitív reakció indukciós ideje alatt kialakul, akkor a hiperszenzitív nekrózis nem jön létre, és így a növény tünetmentesen vészeli át a fertőzést (Klement et al., 2003). A növénypatológusok ezt immun típusú védekezésnek vagy extrém rezisztenciának is hívják. Ezekben az esetekben azonban arról van szó, hogy az EIR gyors kifejlődése olyan gyorsan gátolja a patogént és ezáltal a hrp vagy az avr gének aktivitását, hogy a HR indukciója nem jöhet létre. Lehetséges az is, hogy gátolja az Avr effektor fehérjék kapcsolódását az R receptor génekhez, vagy valami más módon gátolja a nekrózis kialakulás folyamatát.
Mindkét védekezési mechanizmusra, a HR-re és az EIR-re egyaránt jellemző a toxikus szabadgyökök, elsősorban a H2O2 felszaporodása. Az általános rezisztenciánál a H2O2 mennyisége még nem éri el azt a szintet, hogy a növénysejtet is károsítaná, viszont a hiperszenzitív védekezésnél ez az érték olyan magas, hogy a növénysejt is elpusztul a baktériumsejttel együtt (programozott sejthalál - PCD).
A védekezési mechanizmusok egymásra épülése jól megfigyelhető a szisztemikus szerzett rezisztencia esetében, amikor is egy korábban nekrózissal járó fertőzéssel szemben a növény tüneti védelmet nyer. Ez a szöveti érzékenyítés azonban nem kórokozó-specifikus, mint az állatoknál a memóriasejtek esetében.
A betegség kialakulása, a kórokozó túlélésének stratégiája
A kompatibilis kórokozónak két, aktív védekezési vonalat kell áttörnie. Az első az általános, a második a hiperszenzitív rezisztencia. Újabban megállapították, hogy a kórokozó a baktériumsejtből III. típusú szekréciós rendszer segítségével olyan effektor fehérjék jutnak a növénybe, amelyek képesek meggátolni az általános rezisztenciát azzal, hogy a jelátvitelben fontos szerepet játszó MAPK kaszkád gátlását okozzák. Ezen szuppresszor fehérjék indukciójáért bizonyos specifikus vir géneket tesznek felelőssé, amelyeknek aktiválását a hrp gének irányítják (2. ábra).
A második, hiperszenzitív védekezési vonal sem működik, mert a patogén olyan új avirulencia génekkel rendelkezik, amelyeknek Avr effektor fehérjéi a hiperszenzitív rendszer mechanizmusát nem tudják beindítani (2. ábra).
A patogének nemcsak új avr géneket hordozó biotípusokat (rasszokat) és az általános rezisztenciát elnyomó szuppresszor fehérjéket hoztak létre, hanem új mechanizmusokat is alkalmaztak létük fenntartása érdekében (2. ábra). Ilyen a növénykórokozó baktériumokra jellemző burokképződés, amely több funkciója mellett a baktérium tömeges szaporodását is biztosítja. A burok egyrészt fizikailag meggátolja a növényi és a baktérium sejtfal közötti közvetlen érintkezést, és ezzel elkerüli a növény védekezési mechanizmusok beindítását. Másrészt ez az extracelluláris burok a növény védekezésekor keletkezett szabad gyökök káros hatásától is megvédi a baktériumsejteket, ami egyben lehetővé teszi a kórokozó tömeges szaporodását is.
Az extracelluláris poliszaharid (EPS) burok azonban csak glukóz jelenlétében tud kialakulni. Sárdi Évával és Hevesi Máriával végzett közös kutatások szerint, amikor már a kórokozó tömeges szaporodása miatt a glukózkészlet a fertőzött szövetben kimerült, glukóz hiányában az újonnan keletkezett baktériumsejtek a burokanyagot nem tudják megtermelni. Az így keletkezett "kopasz" baktériumsejtek a növénysejtekkel közvetlenül érintkezve megindítják a késleltetett hiperszenzitív nekrózist, ami már nagyobb fertőzött szövetrészek halálával jár (szöveti nekrózisok kialakulása). Erről a késleltetett nekrózisról nem sokat tudunk, de a legutóbbi vizsgálatok azt feltételezik, hogy ez a jól ismert általános betegségtünet szintén HR típusú nekrózist okozó NH (non-host - nem gazda) specifikus bakteriális effektor fehérjének köszönhető, amely a nem gazdaspecifikus R génkhez kapcsolódik (2. ábra). Ezek a receptorok indítják meg a HR-hez hasonló lefolyású szövetnekrózisokat. A szöveti nekrózis tehát nem más, mint a növényi szövetben szétterjedt "idegen" (patogén) sejtek elkésett felismerése. Ezért a fertőzött fogékony szövetben a burokkal még nem rendelkező kórokozó mindig előbb jár, mint a hiperszenzitív nekrózis. Ez teszi lehetővé a foltok folyamatos növekedését. - E folyamatnak sok esetben még nincsen vége, mert a HR következtében pusztuló baktériumsejtekből toxinok, káros enzimek szabadulnak ki, amelyek a környező szövetekbe diffundálva további károsítást eredményeznek. Ezek természetétől függően különböző kórtünetek alakulnak ki. Például legtöbb baktériumtoxin klorózist okoz, a pektolitikus enzimek lágyrothadást, a cellulotikus enzimek hervadásokat, a növényi hormont termelő baktériumok tumorokat okoznak, és így további tünetformák alakulnak ki.
Az eddigi eredmények arra engednek következtetni, hogy a növények a baktériumok és kórokozók támadásával szemben, az evolúció folyamán, fokozatosan építették ki védekezési rendszereiket a nem specifikus, általános - (eredendő) védekezéstől a specifikus, hiperszenzitív típusú védekezési mechanizmusig. Nyilván ezzel párhuzamosan a baktériumok is fennmaradásuk érdekében újabb és újabb támadó fegyvert alkalmaznak. Ez a fennmaradásért folyó kölcsönös harc az evolúció folyamán alakult ki, arra inspirálva minket, hogy további részletek ismeretében megtaláljuk azokat a pontokat, ahol eredményesen irányíthatjuk ezeket a molekuláris folyamatokat. A növény és kórokozó genomikájának teljes feltárása erre új távlatokat nyit.
Kulcsszavak: növényi általános rezisztencia, hiperszenzitív reakció, kompatibilis baktérium-növény kapcsolat, molekuláris növénykórtan.
Általános (EIR, LIR) Hiperszenzitív (HR) 1. Kapcsolat Nem specifikus Specifikus 2. Baktérium Szaprofitonok, patogének, Patogének hrp mutánsok, elölt baktériumok 3. Tünet Nincsen Sejtnekrózis 4. Indukció PAMP elicitorok Avr effektor fehérjék 5. hrp gének szerepe III. típusú szekréciós rendszer III. típusú szekréciós rendszer nem működik működik 6. Receptor Extracelluláris LRR Intracelluláris LRR 7. ROS H2O2 O2- + H2O2 a sejtben sejtfalban lokálisan 8. Ion transzport Nincsen ionkicserélődés Ionkicserélődés és glükóz- és glükózkiáramlás a sejtből kiáramlás 9. Kifejlődés 2-6 óra 8-24 óra 10. SAR indukció Nem indukálja a SAR-t Indukálja a SAR-t 11. Kialakulása Az evolúció korai szakaszában Az új fajok és fajták megjelenésekor
1. táblázat * A védekezési mechanizmusok jellemzői

1. ábra * Modell az inkompatibilis baktérium/növény kapcsolatban kialakult védekezési mechanizmusok megértéséhez. Az ábra bal oldalán a baktérium felületi elicitorai (PAMP) által indukált általános rezisztencia (EIR-LIR), a jobb oldalon a patogén baktérium avirulencia (Avr) effektor fehérjék által indukált hiperszenzitív rezisztencia (HR) molekuláris kölcsönhatása látható. Szaprofita/növény kapcsolatban csak az EIR és LIR általános rezisztencia működik. Patogén esetében mind az általános, mind a hiperszenzitív védekezési mechanizmus akcióba lép.
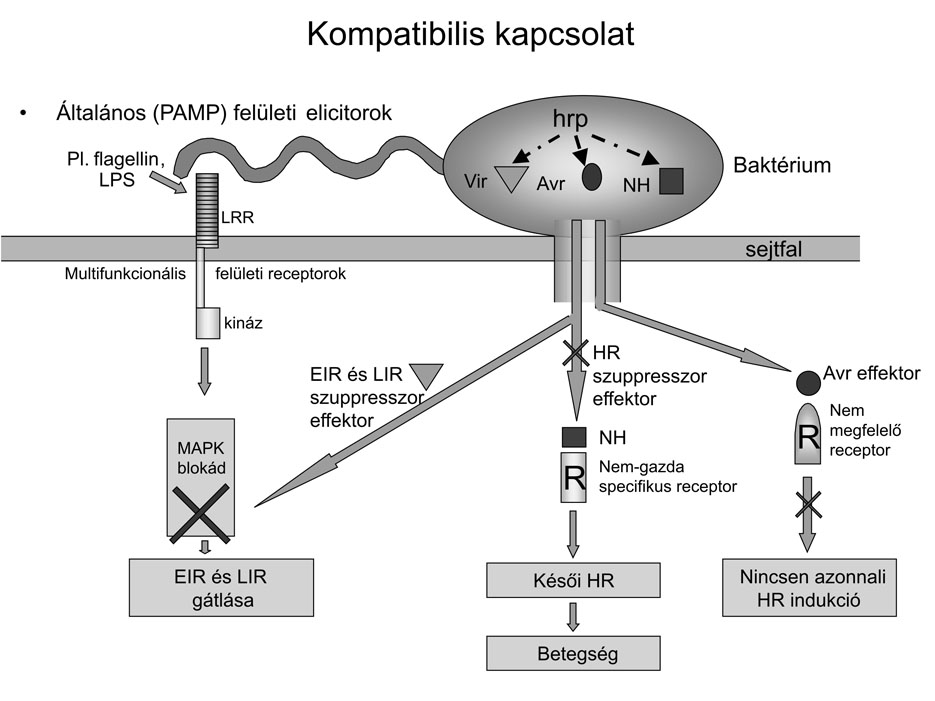
2. ábra * Modell a kompatibilis patogén/növény kapcsolatban a védekezési mechanizmusok gátlásának módjáról. Az általános védekezést a patogén Vir szuppresszor fehérjéi gátolják. A HR típusú védekezés az Avr effektor fehérjék és az R-gének nem-megegyezése miatt nem jön létre.
Irodalom
Ádám, A., Farkas, T., Somlyai, G., Hevesi, M., Király, Z. (1989). Consequence of O2ˇ- Generation During A Bacterially Induced Hypersensitive Reaction in Tobacco: Deterioration of Membrane Lipids. Physiol. Molec. Plant Pathol. 34, 13-26
Aderem, A., Ulevitch, J. (2000). Toll-Like Receptors in the Induction of the Innate Immune Response. Nature. 406, 782-787
Asai. T., Tena, G., Plotnikova, Joulia, Willmann, M. R., Chiu, W-L., Gomez-Gomez, L., Boller, T., Ausubal, F. M., Sheen, J. (2002). Map Kinase Signalling Cascade in Arabidopsis Innate Immunity. Nature. 415, 977-983
Besenyei, E., Bozsó, Z., Ott, Pg., Czelleng, A., Szatmári, Á., Varga, G., és Klement, Z. (2003). A növényi védekezési mechanizmusok elmaradása és az alacsony hőmérséklet szerepe az opportunista patogén, Pseudomonas syringae pv. syringae baktérium kolonizációjára. 49. Növényvédelmi Tudományos Napok, Bp., Február 25-26. P. 87
Bozsó, Z., Ott, P. G., Kecskés, M. L., Klement, Z. (1999). Effect of Heat and Cycloheximide Treatment of Tobacco on the Ability of Pseudomonas Syringae Pv. Syringae 61 Hrp/Hrma Mutants to Cause Hr. Physiological and Molecular Plant Pathology. 55, 215-223
Bozsó, Z., Ott, P. G., Kecskés, M. L., Czelleng A., Klement Z. (2001). Non-Specific Peroxidase and H2O2 Associated Reactions of Tobacco Leaves After Infiltration With Different Hrp/Hrma Mutant of P. Syringae Pv. Syringae 61.In: Plant Pathogenic Bacteria. Proceedings of the 10th International Conference on Plant Pathogenic Bacteria. 195-198. Kluwer Academic Publishers, Dordrecht, the Netherlands
Burgyán, J., Klement, Z. (1979): Early Induced Selective Inhibition of Incompatible Bacteria in Tobacco Plants. Phytopathologica Mediterranea, 18, 153-161
Chang, L., Karin, M. (2001). Mammalian Map Kinase Signalling Cascades. Nature. 410, 37-40
Dangl, J. Z. and Jones J. G. D. (2001). Plant Pathogens and Integrated Responses to Infection. Nature, 411, 826-833.
Erdei A. (2003). A természetes immunitás hatalma. Magyar Tudomány. 4, 422-429
Gómez-Gómez, L., Boller, T. (2002). Flagellin Perception: a Paradigm For Innate Immunity. Trends in Plant Science. 7(6), 251-256
Klement Z. (1990). Infiltration of Plant Tissue. In: Klement, Z., Rudolph, K., Sands, D.C. Szerk. Methods in Phytobacteriology. 389. Akadémiai Kiadó, Budapest
Klement, Z. (1963). Method For the Rapid Detection of the Pathogenicity of Phytopathogenic Pseudomonas. Nature. 199, 299-300
Klement, Z. (1982). Hypersensivity. In Mount and Lacy (Eds.), Phytopathogenic Prokaryotes. 149-177. Academic Press, New York, London.
Klement, Z. (2004). Önvédelem a növényvilágban. Mindentudás Egyeteme 2., Kossuth Kiadó, Budapest (megjelenés alatt)
Klement, Z., Bozsó, Z., Kecskés, M. L., Besenyei, E., Czelleng, A., Ott, P. G. (2003). Local Early Induced Resistance of Plants as the First Line of Defence Against Bacteria. Pest Management Science. 59, 465-474
Klement, Z., Farkas, G. L., Lovrekovich, L. (1964). Hypersensitive Reaction Induced by Phytopathogenic Bacteria in the Tobacco Leaf. Phytopathology. 44, 474-477
Lovrekovich, L., Farkas, G.L. (1965): Induced Protection Against Wildfire Disease in Tobacco Leaves Treated with Heat-Killed Bacteria. Nature, 205, 823-824.
Navarro, L., Zipfel, C., Rowland, O., Keller, J., Robatzek, S., Boller, T. and Jones, J. G. D. (2004). the Transcriptional Innate Immune Response to Flg 22. Interplay and Overlap with Avr Gene-Dependent Defense Responses and Bacterial Pathogenesis. Plant Physiology. 135, 1113-1128.
Ott, P. G., Szabó, L., Balázs, E., Klement, Z. (1997). Submicroscopic Evidence of Bacterially Induced Resistance in Tobacco Leaves. Acta Phytopathologica Et Entomologica Hungarica. 32(3-4), 265-280
Ott, P. G., Varga, G., Szatmári, Á., Bozsó, Z., Klement, É., Medzichradszky, K. F., Klement, Z. (2003): Characterization of Apoplastic Proteins Associated With the Early Induced Resistance (Eir). 11th International Congress on Molecular Plant-Microbe Interactions (Pp. 124) St.-Petersburg, Russia July 18-26.
Shiu, S-H., Bleecker, A. B. (2001). Receptor-Like Kinases from Arabidopsis Form a Monophyletic Gene Family Related to Animal Receptor Kinases. PNAS. 98(19), 10763-10768
Szatmári, Á., Bozsó, Z., Besenyei, E., Czelleng, A., Klement, Z. (2003). Isolation of Genes Related to the General, Non-Specific Defense Reaction of Plants From Tobacco and Arabidopsis. 11th International Congress on Molecular Plant-Microbe Interactions (P. 124) St.-Petersburg, Russia July 18-26