A KÁBÍTÓSZEREK
MOLEKULÁRIS BIOLÓGIAI HATÁSMECHANIZMUSA
Wollemann Mária
az orvostudományok doktora, MTA Szegedi Biológiai Központ Biokémiai Intézet
Wollemann @ nucleus.szbk.u-szeged.hu
Összefoglaló
A tanulmány célja a kábítószerek biológiai hatásmechanizmusának ismertetése és ezen keresztül a hozzászokás és függőség magyarázata.
A kábítószerek többsége az emberi és állati szervezetben egyaránt jelen lévő receptorokon (jelfelfogó) keresztül fejtik ki hatásukat. E receptorok a szervezetekben keletkező természetes ingeranyagok (biogén aminok, aminosavak, peptidek stb.) megkötésére és jeltovábbítására szolgálnak. Szabályozásuk igen finom, többlépcsős, bonyolult mechanizmusokon alapszik. A receptorokra ingerlőleg ható természetes és mesterséges anyagokat agonistáknak, e hatásokat gátlókat pedig antagonistáknak szokták nevezni. A receptorokra ható gyógyszereink többsége antagonista, ezért kevésbé okoznak hozzászokást, mint az agonista hatású gyógyszerek és a kábítószerek, melyeknél gyakori a hozzászokás. A legtöbb kábítószernél ezen kívül még testi és lelki függőség is fellép, vagyis a kábítószerélvezők ellenállhatatlan vágyat éreznek a szer fogyasztására, és amennyiben ahhoz nem tudnak hozzáférni, súlyos megvonási tünetek lépnek fel.
E tüneteknek az a magyarázatuk, hogy a legtöbb kábítószer (ópiátok, kokain, amfetamin, nikotin stb.) különböző mechanizmusokon keresztül növelik az agy egyik ingeranyagának, a dopaminnak a szintjét az ún. örömközpontokban. A belső ingeranyagok hatása nem tartós, mert azokat a szervezet hamar le tudja bontani, ezért ezekhez általában nem alakul ki hozzászokás és függőség. A kívülről bevitt kábítószerek azonban egyrészt nem bomlanak le hasonló gyorsasággal, másrészt a szervezet jelfogói (receptorai) úgy védekeznek e természetellenes hatóanyagokkal szemben, hogy elvesztik érzékenységüket, deszenzitizálódnak a szerre. Ennek az a következménye, hogy egyre többet kell alkalmazni a szerből azonos hatás elérésére, ezt nevezik hozzászokásnak.
E jelenségek molekuláris mechanizmusát részben már felderítették, és ezek ismerete segíti az érdeklődőket abban, hogy ne forduljanak a kábítószerek felé.
Tartalomjegyzék
1. Az ingeranyagok szerkezete és hatása a központi idegrendszerben
a. aminerg transzmitterek
b. aminosav transzmitterek
c. peptid modulátorok
d. zsírsavszármazékok
2. A receptorok szerkezete, lokalizációja és hatásmechanizmusa
a. ioncsatornához kötött receptorok
b. guaninnukleotidához kötött receptorok
3. A transzporterek szerkezete, lokalizációja és hatásmechanizmusa
a. monoamin transzporterek
4. A receptorokra ható drogok
a. ópiátok
b. kannabisz
c. LSD
d. nikotin
5. Az ingeranyagok transzporterére ható drogok
a. kokain
b. amfetamin és származékai
6. A receptorok deszenzitizálása és következményei: védekezési mechanizmusok
a. tolerancia
b. dependencia
c. terápia
7. Következtetések
BEVEZETÉS
Az idegrendszer molekuláris biológiája nem tekint vissza hosszú múltra, ellentétben az élettani és gyógyszertani kutatásokkal, mivel csírái is csak a múlt század második felében, leginkább utolsó harmadában kezdtek kifejlődni, azonban az ingeranyagok felismerése, hatásuk és anyagcseréjük leírása már a múlt század elején megkezdődött. Kezdetben elsősorban csak elektrofiziológiai és farmakológiai tulajdonságaikat ismerték fel, és támadáspontjukat receptornak (jelfogónak) nevezték el a nélkül, hogy kémiai mibenlétüket tisztázták volna.
1. Az ingeranyagok szerkezete,
és hatásuk a központi idegrendszerben
a. A természetes ingeranyagok közül az acetilkolint és az adrenalint fedezték fel először a kolinerg paraszimpatikus, illetve az adrenerg szimpatikus idegek ingerlése közben, majd ezt követte a noradrenalin és dopamin, amelyek szintén a szimpatomimetikus anyagok közé tartoznak. A biogén aminok csoportjába tartoznak még a később leírt hisztamin és szerotonin is.
b. Az ingeranyagok egy másik csoportját képezik az aminosavak; ide tartoznak az aminosavak közül a glutaminsav, az aszparaginsav, a glicin és a gamma-aminovajsav (GAV vagy GABA). Az előző három izgató, míg az utóbbi gátló hatást fejt ki.
c. A húsz természetes aminosavból szintetizált peptid közül is egyre több ingeranyagot írnak le, ezeket először csak modulátoroknak gondolták, később azonban egyre inkább valódi transzmitter hatásúnak ítélték. Itt elsősorban a fájdalom- és örömközpontokra kifejtett hatásuk miatt jönnek szóba, ilyenek az enkefalinok, az endorfinok, a P anyag és a neurokininek.
d. A zsírsav eredetű ingeranyagok közé sorolhatók még az anandamidok és a vanilloidok, melyek többek között az öröm-, illetve a fájdalomközpontokon keresztül fejtik ki hatásukat, de transzmitterként való elfogadásuk még késik.
Az ingeranyagok anyagcseréjébe több helyen lehet beavatkozni elméletileg: a keletkezésük, a lebontásuk és a sejtbe való felvételükön keresztül is befolyásolható a szintjük. A szintézisüket és lebontásukat specifikus enzimek végzik, míg egyesek felvételét a sejtekbe transzporterek biztosítják.
2. A receptorok szerkezete, lokalizációja és hatásmechanizmusa
A receptorok fogalmát John N. Langley vezette be 1907-ben. Nikotint cseppentve az izom felszínére, csak akkor okozott kontrakciót, ha az idegvégződések körül alkalmazta, amit kuraréval – ami gátolja a nikotin izomösszehúzó hatását – sikerült kivédenie. Ebből feltételezte, hogy az idegvégződések egy specifikus anyagot tartalmaznak, amelyet receptornak nevezett el. A receptorok mind a központi, mind a periferiás idegrendszerben előfordulnak a sejtek membránjában vagy az idegvégződéseken. Nemcsak az idegsejteken, de a gliasejtek membránján is vannak receptorok, melyek az idegsejtek ún. támasztószövetét képezik, és anyagcseréjét egészítik ki.
A receptorok kémiai természetének tisztázására jóval később, a XX. század második felében került sor, részben fehérjeemésztési kísérletekkel igazolták, hogy a sejtmembránban lévő receptorok fehérje természetűek, részben biokémiai kísérletekkel mutatták ki, hogy a legtöbb biogén amin egy enzimaktivitást növelő vagy gátló hatással rendelkezik. Ez a receptorhatáshoz kötődő enzim volt az adenilcikláz. Később kiderült, hogy a receptor és az adenilcikláz között még egy vegyület, a guaninnukleotidához kötött G-fehérje foglal helyet, amelynek guanozintrifoszfatáz enzim aktivitása van.
A receptorokhoz kötődő biogén aminok tulajdonképpen ezt az enzimet aktiválják, ennek hatására az adenilcikláz adenozintrifoszfátból egy másik nagy energiájú vegyületet, a ciklikus adenozinmonofoszfátot szintetizálja, amely különböző anyagcsere-folyamatokat indít el. A guaninnukleotidákhoz kötött fehérje három alegységből áll, melyek közül az egyik (alfa-alegység) többféle alakban fordul elő, aszerint, hogy milyen receptorhoz kötődik lehet izgató Gs, vagy gátló Gi/o, ami az adenilcikláz aktivitásának fokozását, illetve gátlását eredményezi. Egy később felfedezett Gq/11 a foszfolipáz C/beta aktiválása révén a sejten belüli kalciumszintet emeli. Az alfa alegységen kívül még béta és gamma alegységek is vannak a G-fehérjében. A receptoroknak két nagy csoportját különböztetik meg a G-fehérjékhez kapcsolt receptorok, melyek száma több száz, illetve újabban már ezer körülinek vélhető, és az ioncsatornákhoz kötött receptorok, melyek az előzőnél egy kisebb csoportot alkotnak.
a. Az ioncsatornához kötött receptorok közül csak néhány érdekel bennünket a droghatás szempontjából, ezek közé tartozik a kationcsatornához kötött nikotinos acetilkolin-receptor, az NMDA-receptor és a szerotonin 5-HT3-receptor, valamint a kloridcsatornához kötött GAV- és glicin-receptorok. Ezek a receptorok többféle fehérje alegységből épülnek fel, melyek az ioncsatorna falát képezik. Az alegységeknek általában négy transzmembrán régiójuk van.
b. A G-fehérjéhez kapcsolt receptorok közül az acetilkolin muszkarinos receptorai, a noradrenalinnal és adrenalinnal reagáló alfa- és bétaadrenerg-receptorok, a dopaminhoz kötött dopaminreceptorok (1. ábra), a szerotoninreceptorok, a hisztamin-receptorok, a metabotrop glutaminsavreceptorok, és a peptidekkel aktiválható receptorokon keresztül ható drogok érdekelnek bennünket leginkább. Ide tartoznak az ópiát- (2. ábra) és a neurokinin-receptorok, a zsírsav származékokra ható receptorok közül az anandamiddal aktiválható kannabisz-receptorok (3. ábra).
A G-fehérjéhez kapcsolt receptorokra jellemző, hogy hét transzmembrán régióból állnak, extracelluláris N-terminális és sejten belüli C-terminális aminosavat tartalmaznak. Az N-terminális régióban találhatók a glikozilálásért felelős, míg a C-terminálisban a deszenzitizálásért felelős aminosavak. A biogén aminok általában a 3-as transzmembrán régióban előforduló aszparaginsavhoz kötődnek, míg a nagyobb molekulájú peptidek az extracelluláris hurkokhoz (4. ábra). A G-fehérjékhez kötődő receptorok képesek egymáshoz kapcsolódni, így különböző „párkapcsolatok” is létrejöhetnek, melyek megváltoztathatják a receptorok eredeti tulajdonságait (5. ábra).
3. A transzporterek szerkezete, lokalizációja és hatásmechanizmusa
A transzporterek fogalmának használata a noradrenalinnak az idegsejtbe való újrafelvételével kezdődött mintegy negyven évvel ezelőtt. Nemsokára hasonló aktív felvételt észleltek szerotoninnal és dopaminnal. Kiderült, hogy a monoaminok enzimatikus lebontása és diffuziója mellett az aktív felvétel játszik döntő szerepet az anyagcseréjükben. Ezen észleletek után olyan gyógyszereket sikerült kifejleszteni, mint az antidepresz-szánsok és a pszicho-stimulánsok, melyek gátolták a felvételt, és ezáltal hatékonynak bizonyultak a depresszió kezelésében.
A kilencvenes évek elején sikerült a transzporterek génjeit klónozni, és ezáltal meghatározni az aminosav-szekvenciájukat, majd immuncitokémiai és hibridizációs módszerekkel megállapítani lokalizációjukat, miszerint az idegrendszerben főleg azoknak az idegsejteknek a membránjában foglalnak helyet, ahol a megfelelő transzmitter képződik. A szerkezeti és lokalizációs vizsgálatok után mutációval, delécióval és hibridizációs kísérletekkel megállapították, hogy a fehérjemolekula mely részei felelősek a felvételért és a gátlásért. A humán dopamin transzporter pl. 620, a noradrenalin 617, a szerotonin 630 aminosavból és mindhárom 12 intramembrán régióból áll. A transzporter mindkét vége intracellulárisan helyezkedik el, így a potenciális glikozilálási helyek a második extracelluláris hurokban helyezkednek el (6. ábra).
a. A monoamin transzporterek klónozása az akkor már ismert szerkezetű gamma-aminovajsav transzporterrel való homológia alapján történt, elsősorban a konzervatív intramembrán régiók alapján. A monoamin transzporterek működéséhez Na+ és Cl-ionokra van szükség, ami a biogén aminokkal együtt aktív transzporttal kerül az idegsejtbe.
A receptorokhoz hasonlóan a monoamin transzporterek is képesek oligomerizálódni, vagyis párkapcsolatokat létesíteni önmagukkal, valamint proteinkinázok hatására foszforilálódni és deszenzitizálódni. Újabban génkiütéses (knock out – K. O.) egereken is tanulmányozták a transzporterek hatását.
4. A receptorokra ható drogok
a. ópiátok
Az ópiátok narkotikus hatása a Távol-Keleten már az ókorban ismert volt. A mákgubó tejnedvéből előállított ópium mintegy negyven alkaloidot tartalmaz. A legfontosabb ezek közül a morfin (7. ábra), a kodein és a papaverin. A morfint az ópiumból már 1805-ben Friedrich Wilhelm Sertürner német gyógyszerész izolálta. Hazánkban Kabay János dolgozott ki egy új módszert a mákszalmából kivont morfin előállítására. A narkósok által leggyakrabban használt ópium alkaloida a heroin (8. ábra), a morfin diacetilált alakja, mely erősen lipofil, és így hamarabb jut el az agyba, ahol deacetilálódik, és mint morfin kötődik az ópiátreceptorokhoz.
A morfin az ópiátreceptorok közül a mű altípushoz kötődik a legnagyobb affinitással, és ezen keresztül fejti ki többek között fájdalomcsillapító és euforizáló hatását. A morfin a gerincvelői támadásponton kívül elsősorban a fájdalom agykérgi tudatosítását gátolja. A mű-ópiátreceptorokon kívül még delta- és kappa-ópiátreceptor altípusokat különböztetünk meg. Mindhárom receptornak ismert az aminosavsorrendje, és ezek között kb. 60 % a homológia (lásd a 2. ábra fekete pontjait). E receptor altípusoknak vannak endogén ligandjai, a mű és delta altípusoknak a metionin-enkefalin és a leucin-enkefalin, míg a kappa altípusnak a dinorfin. Az előzőek öt aminosavból állnak és a proenkefalin A peptidből keletkeznek, míg az utóbbi tizenhét aminosavból áll, és prodinorfinból hasad le enzimatikus úton. A beta-endorfin, mely a beta-lipotropinból keletkezik és harmincegy aminosavból áll, elsősorban a mű-receptorhoz kötődik. (9. ábra)
A peptidek szelektivitása nem túl nagy, ami az egyes altípusokhoz való kötődést illeti. Újabban sikerült a kiütéses módszerek alkalmazásával megállapítani, hogy a mű-receptorok feltétlenül szükségesek az analgetikus és narkotikus hatáshoz, és a deltaspecifikus ligandok analgetikus hatásához is szükség van a mű-receptorokra. A kappa-receptorok ligandjai eufória helyett diszfóriát okoznak, ezért nem terjedtek el mint fájdalomcsillapítók. A peptidek a bontóenzimek hatására gyorsan lebomlanak, emiatt nem képesek hosszan tartó hatást kifejteni, s a hozzászokás sem fejlődhet ki velük szemben. Kivételt képeznek ez alól azok az esetek, amikor a fokozott tréningek miatt pl. a béta-endorfin koncentrációja megnőhet, ami eufóriát (runner’s high) és toleranciát okozhat, de ezt a hatást naloxon és naltrexon ópiát antagonistákkal nem sikerült kivédeni, ezért ez nem tekinthető klasszikus ópiáthatásnak.
Az ópiátreceptorok az alfa-Gi/o-n keresztül fejtik ki hatásukat, ami az adenilátciklázt gátolja, molekuláris szinten ez hozható összefüggésbe az ópiátok fájdalomcsökkentő hatásával.
b. kannabisz
A kannabisz az indiai kender (Cannabis sativa indica) alkaloidája. Legrégebben az ópiátokhoz hasonlóan a Távol-Keleten és Indiában használták. A mintegy hatvanhat alkaloida közül az A9-tetrahydrocannabinol (THC) (11. ábra) a leghatékonyabb, melyet 1964-ben azonosítottak. A növények a drogot a szárban, a levelekben és a virágokban tartalmazzák, legnagyobb koncentrációban a nőnemű virágokban található. Szárított állapotban általában cigarettába keverve szívják el, ez szerepel a köznyelvben marihuána (nálunk fű ) néven. A THC legnagyobb koncentrációban a hasisban fordul elő, ez egy gyantaszerű anyag, amely a virágok csúcsain képződik, és megszárítva kb. tízszer több hatóanyagot tartalmaz, mint a levelek.
A szervezetbe került kannabisz a véráramon keresztül hamar bejut az agyba, ahol az ún. kannabiszreceptorokon keresztül fejti ki hatását (3. ábra). A kilencvenes évek elején sikerült a kannabiszreceptorokat klónozni. Ezek Gi/o fehérjéhez kötött receptorok, és kétféle alakban CB1-ként és CB2-ként ismertek. Míg a CB1 a központi idegrendszerben fordul elő, addig a CB2 periferiásan helyezkedik el, és az immunitásban játszik szerepet. A kannabiszreceptorok az agyban viszonylag nagy koncentrációban fordulnak elő.
Természetes ligandjaik az endocannabinoidok, ide tartoznak az anandamid (10. ábra), az N-arachidonoildopamin és a 2-arachidonoilglicerol. Az anandamid enzimatikus szintéziséhez Ca ionokra van szükség. Képződését az N-aciltranszferáz és a foszfolipáz D katalizálja, míg a metabolizmusuk egy zsírsavamidhidrolázén keresztül történik, ami arachidonsavra és etanolaminra bontja őket. Feltételezik, hogy az anandamidnak aktív felvétele is van, de transzporterét még nem sikerült klónozni. Az anandamidok az idegsejtmembránból képződnek, és nem a szinaptikus vezikulákban tárolódnak, mint a többi transzmitter, hanem közvetlenül hatnak a receptorra. A kannabisz agonisták hatására bizonyos Ca ioncsatornák záródnak és K ioncsatornák nyílnak meg. Ez gátolja a GAV felszabadulását a hippokampuszban, és a glutaminsavét a csíkolt testben (striatum). A kannabiszreceptoroknak ismertek szelektív antagonistái, így a CB1-nek a rimonabant és a CB2-nek az SR 144528. A kannabiszok hatása némileg az ópiátokra emlékeztet, de annál valamivel gyengébb. Fájdalomcsillapító és euforikus, vagy szedatív és memóriacsökkentő hatását régóta ismerték és rákos betegeknél használták, bizonyos származékait AIDS-esek étvágygerjesztőjeként, valamint izomgörcsök oldására adták. Legalizálása körül ma is élénk viták folynak, leginkább ellene szól, hogy a kemény drogok használói közül legtöbben ettől indultak el.
c. LSD
Az LSD (lizergsavdietilamid) a hallucinogén anyagok közé tartozó szintetikus lizergsav származék (12. ábra). Albert Hoffman svájci kémikus fedezte fel 1938-ban egy önkísérlet folyamán. A szimpatikus idegrendszer izgalma is fellép, elsősorban az aminerg idegek izgalma révén.
Az LSD egy szerotonin antagonista. A számos szerotoninreceptorok közül elsősorban a preszinaptikus 5-hidroxitriptamin2 receptorokon keresztül gátolja a szerotoninfelszabadulását, és így fokozza a szerotonin koncentrációt az idegsejtekben. Az LSD hatásai kiszámíthatatlanok. Az utazásnak nevezett emocionális hatások lehetnek jók vagy rosszak. Ezek a hatások később visszatérhetnek anélkül, hogy újabb adag bevitelére kerülne sor. Skizofréniára vagy depresszióra emlékeztető tünetek is előfordulnak.
A nikotin (13. ábra) a nikotinos ioncsatornához kötött acetilkolin-receptorok agonistája. E receptorok az idegdúcokban, a harántcsíkolt izom idegvégződéseiben és a központi idegrendszerben fordulnak elő. A nikotin ezeket a receptorokat kis adagban izgatja, majd később bénítja. A nikotinos acetilkolin-receptorok izgatása a Ca ionok permeabilitás fokozásán keresztül többek között noradrenalint és dopamint szabadítanak fel. E reakciók folyamán a felszabaduló dopamin az agyi öröm- vagy jutalmazóközpontokban (nucleus accumbens, ventralis tegmentalis area) (14. ábra), hasonlóan a többi élvezeti szerhez eufóriát okoz, ami később függőséghez vezet. Megfigyelték, hogy dopaminreceptor-gátló hatású drogok után a nikotinszívás növekedett, míg dopamin agonisták hatására csökkent.
5. Az ingeranyagok
transzportereire ható drogok
a. Kokain
Már a régi indiánok ismerték a kokanövény leveleinek rágcsálásából származó előnyöket: a fáradtságérzést, éhségérzést csökkentő hatást és az izomerő növelését. Manapság a kokain (15. ábra) egyik legelterjedtebb drog lett. Hatása viszonylag rövid ideig tart, mivel gyorsan lebomlik. Az adagolás intravénásan, az orron keresztüli felszippantással vagy szájon át történik. A kokain kémiailag benzoilmetilekgonin; a vérben és májban lévő eszterázék kezdik el a metabolizálását. A vizelettel kiürülő végterméke az ekgonin.
A kokain kedvező, fent említett hatásain kívül a dopamin transzporter gátlásával a központi idegrendszer jutalmazó központjaiban a dopaminszint megemelkedik, ami erős eufóriát okoz, ezért elsősorban ennek köszönheti fogyasztását. Azonban dopamin transzportergén-kiütéses egereken a kokainhatás nem szűnt meg teljesen, csak ha a szerotonin transzportergénjét is kiütötték, viszont a noradrenalin és szerotonin transzportergén együttes kiütése fokozta a hatást. Mutációs, hibridizációs és kimérás kísérletekben megállapították, hogy a kokaingátlásért más transzmembrán régiók felelősek, mint a dopaminfelvételért. Míg a kokain gátlásért a 6-8-as transzmembrán régió, a dopaminfelvételért a 9-es régiótól a transzporter karboxil végéig terjedő rész felelős, ezért remélhető, hogy a jövőben olyan kokain antagonistát fedeznek fel, amely nem hat a dopamintranszportra, és így nem rendelkezik mellékhatásokkal. A kokain a transzporterfelvétel gátlása mellett még fokozza a transzporter sejtmembránhoz való vándorlását és kötődését, ezáltal mintegy kompenzálva a gátlást. A fentieken kívül a krónikus kokainszedés a dendrittüskék proliferációját is okozza az accumbens magban, ami az idegrendszer fő ún. jutalmazó központja. (14. ábra) Ez a hatás egy enzimaktivitás, a ciklin-dependens kináz növelésén alapszik. A metabotrop glutamát 5-típusú receptor kiütésével pedig egereken megszüntették a kokainaddikciót.
b. Amfetamin és származékai, 16. ábra
Az amfetamin (alfa-metilfenetilamin) (15. ábra) és származékai (metamfetamin, dimetoxiamfetamin, metiléndioximetamfetamin vagy más néven MDMA, illetve extasy) (16. ábra) a szimpatomimetikus anyagok sorába tartoznak, vagyis a dopaminerg és az adrenerg hatások erős fokozását okozzák minden támadáspontjukon. Ez azt jelenti, hogy a kokainhoz hasonlóan beépülnek az idegsejtekbe, fokozzák a szimpatomimetikus katekolaminok felszabadulását, izgatják a receptorokat, gátolják a lebontásért felelős monoaminooxidáz enzim aktivitását és a katekolaminok újrafelvételét a transzportereken keresztül. Az amfetaminok azonban a kokainhoz hasonló központi izgató hatás mellett még a dopaminerg-receptorok és szerotoninerg neuronok és pályák degenerációjához is vezetnek krónikus használat után, ezenkívül csökkentik a szervezet immunválaszát. E szereket kezdetben fogyasztó és ébrenlétet fokozó hatásuk miatt alkalmazták, később azonban a fent említett káros hatások miatt használatukat betiltották.
A receptorok deszenzitizálása
és következményei, védekezési mechanizmusok és terápia
a. Tolerancia
Az ingeranyagok ismételt nagy dózisú, kívülről történő bevitele után a receptorok fokozatosan elvesztik érzékenységüket, ezért azonos hatás eléréséhez egyre többet kell beadni. Ugyanez fokozottan vonatkozik a drogokra, mivel ezek lassabban disszociálnak és bomlanak le. Ezért ismételt drogbevitel, de még egyes gyógyszerek szedése után is tolerancia alakul ki. Ennek oka a receptorok deszenzitizálása. A receptorok elérzéktelenedésének többféle oka lehet. A leggyorsabb a receptorok hidroxil csoportot tartalmazó aminosavainak, a szerinnek és treoninnak foszforilálása és a G-fehérjékről való lekapcsolódása. Ennél lassabb folyamat a receptorok lefűződése a membránról és a sejtbe való bevándorlása (internalizáció), majd a lizozómákba és a proteozomákba való felvétele és lebontása. A fentieken kívül más reguláló fehérjék, mint a beta-arresztin és a dinamin is befolyásolják a deszenzitizációt.
A receptorok tulajdonképpen így védekeznek a túl erős ingerekkel szemben. Az endogén keletkező ingeranyagokkal szemben azért nem alakul ki tolerancia, mert ezek hamarabb lediszociálnak a receptorról, és a bontóenzimek eltávolítják, vagy a transzporterek révén visszakerülnek az idegsejtekbe. Az antagonistákkal szemben szintén nem alakul ki tolerancia. A drogok többségénél azonban, így például az ópiátokkal szemben, elég hamar fellép a tolerancia, és ezért a szenvedélybetegek egyre többet kénytelenek alkalmazni az adott szerből, hogy a kívánt hatást elérjék. Végül is ezek a drogok már toxikus hatást fejthetnek ki az idegsejtekre.
b. Dependencia
A dependenciánál vagy függőségnél testi és lelki formákat különböztetünk meg. A testi függőségek leginkább a szer abbahagyása vagy antagonista adása után válnak nyilvánvalóvá, példa az ópiátelvonás után fellépő hasmenés. A vegetatív tünetek egy részét az okozza, hogy az állandó drogfogyasztás miatt a receptor második hírvivő rendszere, az adenilcikláz aktivitása csökken, amit a szervezet fokozott szintézissel igyekszik kompenzálni. A drogmegvonásnál az addig legátolt aktivitás hirtelen megnő, és ez eredményezi a kellemetlen tüneteket. Nem minden drog okoz testi vagy szomatikus dependenciát, így például a kokainnál csak lelki dependencia áll fenn. Ez azonban igen kínzó lehet, ha nem áll rendelkezésre a megfelelő adag. A dependenciát állatokban is létre lehet hozni, például a kokainfüggő majmok vagy patkányok az önadagoló kokaint választják az élelem helyett akkor is, ha előzőleg éheztetik őket. A lelki függőség hónapokig is fennállhat az adagolás abbahagyása után, míg a testi függőség hamarabb szűnik meg. Mi okozza a lelki függőséget ? Elsősorban a jutalomközpontokban lévő dopamin felszaporodása váltja ki az örömérzést, illetve az eufóriát. Ha patkányokban ezt az idegközpontot elektromosan ingerlik úgy, hogy saját maguk is tudják folytatni az ingerlést egy kar lenyomásával, nem érdekelte őket sem az evés, sem az ivás. Szintén kísérleti állatokban mérték ki, hogy míg az élelem vagy szex 50-100 százalékkal növelik az örömközpont dopaminszintjét, addig a kokain vagy amfetamin ezerszeresére növeli azt. Az eufória lehet közvetett és közvetlen hatással például a glutaminsav, a GAV vagy az ópiátrendszeren keresztül. Ha az illető a mesterségesen fokozott dopaminszintekhez hozzászokik, akkor már a saját endogén transzmitterei nem képesek a korábbi hatásukat kiváltani, mivel a receptorok az erős ingerektől elvesztették érzékenységüket, deszenzitizálódtak. Így válnak a krónikus drogfogyasztók szenvedélyük rabjává, anélkül, hogy ki tudnának elégülni.
c. Terápia
A drogterápia kettős célzatú, egyrészt az elvonási tünetek gyengítését, másrészt a drogtól való teljes elvonást célozza. Ami az ópiátokat illeti, elsősorban a metadonterápiát szokták alkalmazni. A metadon egy gyenge műópiát-receptor agonista, mely egyben antagonista hatást fejt ki a kappaópiát-receptorokon. A metadonkezelés alternativája a buprenorfin, mely szintén hasonló tulajdonságokkal bír, mint a metadon. Veszélyük, hogy szintén okozhatnak függőséget, de ez gyengébb, mint amit a morfin vagy a heroin okoz. Sajnos a visszaesés veszélye hónapok után is fennáll, akár erős stresszhatásra, akár a fogyasztásra emlékeztető helyzetekben bekövetkezhet. Egy másik alternatív terápia az ópiát antagonista naltrexon kezelés. Ezt csak a súlyos elvonási tünetek abbamaradása után lehet alkalmazni. A vegetatív elvonási tüneteket alfa2adrenerg-receptor agonista klonidin vagy beta-reptor gátlókkal lehet csillapítani. A naltrexon affinitása a műópiát-receptorhoz magas és hosszan tartó, így meggátolja az ópiát agonisták hatását. A metadonnál még erősebb hatású a LAAM (1-alfa-acetil-metadol), mivel lassabban disszociál le a receptorról. Szubsztitúciós terápiával gyógyítják még a nikotinabúzust, ahol tapasszal vagy rágógumival pótolják a nikotinbevitel hiányát. Az ópiátabúzushoz hasonlóan a klonidint is alkalmazzák.
A krónikus kokainszedésre még nem létezik az ópiátoknál alkalmazott terápiás elv, nincsen gyengébb és tartósabb hatású szubsztituciós terápia. Mivel a transzportereken a dopamin máshol kötődik, mint a kokain, az ideális szer a kokain kötésének gátlása lenne. A D2 posztszinaptikus dopaminreceptor viszonylag szelektív gátlásával például flupentixollal már értek el eredményeket. Mivel az ópiátok is részben a dopaminrendszeren keresztül fejtik ki euforikus hatásukat, a kokainabúzust is némileg csökkentette a buprenorfin és a naltrexon. Egy másik törekvés a kokain lebontásának gyorsítása antitestekkel, így csökkentve a hatást. Újabban antikokain antitesteket juttatnak be a keringésbe a kokain megkötésére, vagy bakteriofággal fertőzött kokainkötő fehérjét visznek be, mely képes a központi idegrendszerbe is behatolni, és nem toxikus.
A génkezelés, bár egyelőre csak állatkísérletekben, érdekes eredményeket hozott. A műópiátreceptor-kiütéses egereket nem sikerült krónikus morfinkezeléssel dependenssé tenni. A genetikai kutatások másik irányában annak okozóját keresik, hogy alkalmi drogfogyasztók közül egyesek függővé válnak, míg mások nem lesznek azok, ilyen módon kutatva azokat a géneket, amelyek ezekért a hatásokért felelősek lehetnek. Az epidemiológiai vizsgálatok ugyanis azt mutatták ki, hogy a drogfüggőség kockázatának 50 %-a genetikus eredetű. Csak ezen gének azonosítása után válik lehetővé annak megértése, hogy a genetikus és nem genetikus faktorok mennyiben játszanak közre az egyén addiktív magatartásáért.
Következtetések
A droghatásra létrejövő molekuláris elváltozások ismertetésével szerzőnek az volt a célja, hogy az olvasók megismerjék, milyen következményekkel jár a drogok használata. Véleménye szerint lehet elrettentő példákat felhozni, de ennél sokkal hatásosabb, ha az illetők rájönnek, melyek azok a molekuláris törvényszerűségek, amelyek idegműködésünket szabályozzák, és milyen kedvezőtlen, olykor irreverzibilis változások léphetnek fel e biológiai reakciókban. E célból ezt a tanulmányt ajánlja tanároknak és diákoknak egyaránt, hogy ismerkedjenek meg a témakörrel, és ne váljanak a drogok rabjaivá.
Kulcsszavak: ingeranyagok, receptorok, transzporterek, drogok, tolerancia, dependencia, terápia

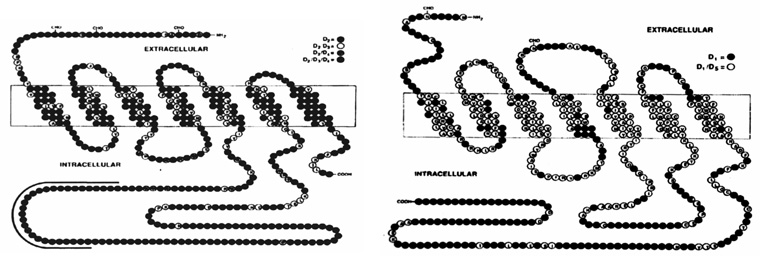
1. ábra • D2 humán receptor és a D3, D4 receptorokhoz való viszonya. A körök az egyes aminosavakat jelzik. D1 receptor és a D5 receptorhoz való viszonya
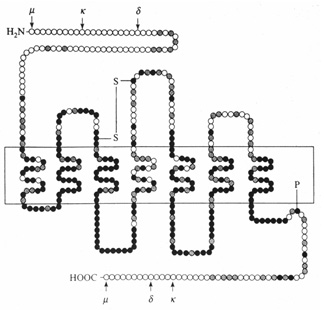
2. ábra • Mű-, delta- és kappa-ópiát-receptorok. A fekete pontok mindhárom, a szürke pontok két receptorban előforduló közös aminosavat jelzik

3. ábra • Kannabisz CB1 receptor
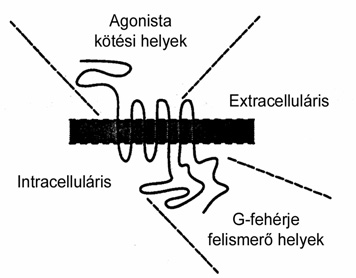
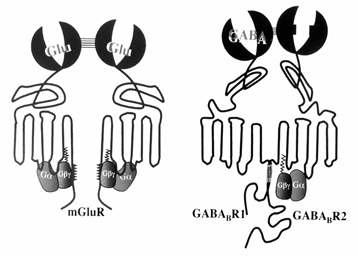
4. és 5. ábra • G-fehérjéhez kapcsolt receptorok modellje, metabotróp glutaminsav és GABAbR1 és R2 receptorok dimér párkapcsolata
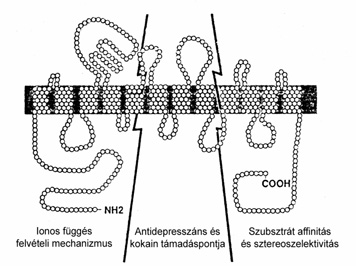
6. ábra • Transzportermodell
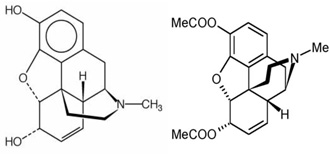
7. és 8. ábra • Morfin, heroin
Leu-enkephalin Tyr-Gly-Gly-Phe-Leu-OH
Met-enkephalin Tyr-Gly-Gly-Phe-Met-OH
-Endorphin Tyr-Gly-Gly-Phe-Met-Thr-Ser-Glu-Lys-Ser-Gin-Thr-Pro-Leu-Val-
Thr-Leu-Phe-Lys-Asn-Ala-Ile-Ile-Lys-Asn-Val-His-Lys-Lys-Gly-Gln-OH
-Neoendorphin Tyr-Gly-Gly-Phe-Leu-Arg-Lys-Tyr-Pro-Lys
Dynorphin Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile-Arg-Pro-Lys-Leu-Lys-Trp-Asp-Asn-Gln-OH
Nociceptin Phe-Gly-Gly-Phe-Thr-Gly-Ala-Arg-Lys-Ser-Ala-Arg-Lys-Leu-Ala-Asn-Gln-OH
9. ábra • Endogén opioid peptidek aminosavszekvenciája
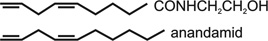
10. ábra
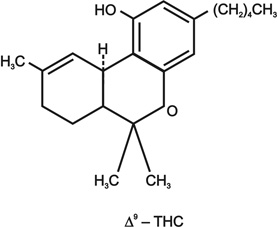
11. ábra
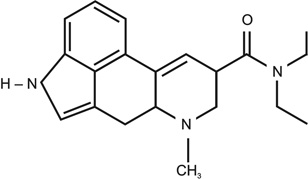
12. ábra • LSD
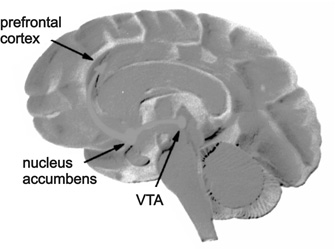
14. ábra • Az agyi jutalomközpontok lokalizációja
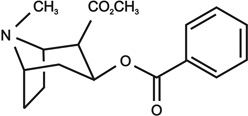
15. ábra • Kokain
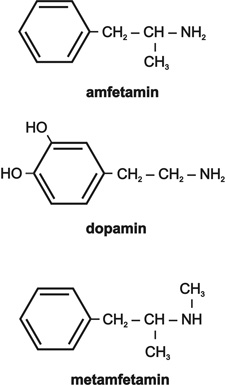
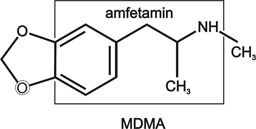
16. ábra • Amfetamin és származékai
IRODALOM
Benyhe Sándor (1993): A morfin biokémiája. Biokémia. 17, 160–170.
Freund Tamás Ferenc – Katona I. – Piomelli, D. (2003): Role of Endogenous Cannabinoids in Synaptic Signaling. Physiological Reviews. 83, 1017–1066.
Fürst Zsuzsanna (szerk.) (1998): Gyógyszertan. Medicina, Budapest
Vizi E. Szilveszter (szerk.) (1997): Humán farmakológia. Medicina, Budapest
Wollemann Mária (1990): Recent Development in the Research of Opioid Receptor Subtype Molecular Characterization. Journal of Neurochemistry. 54, 1095–1099.