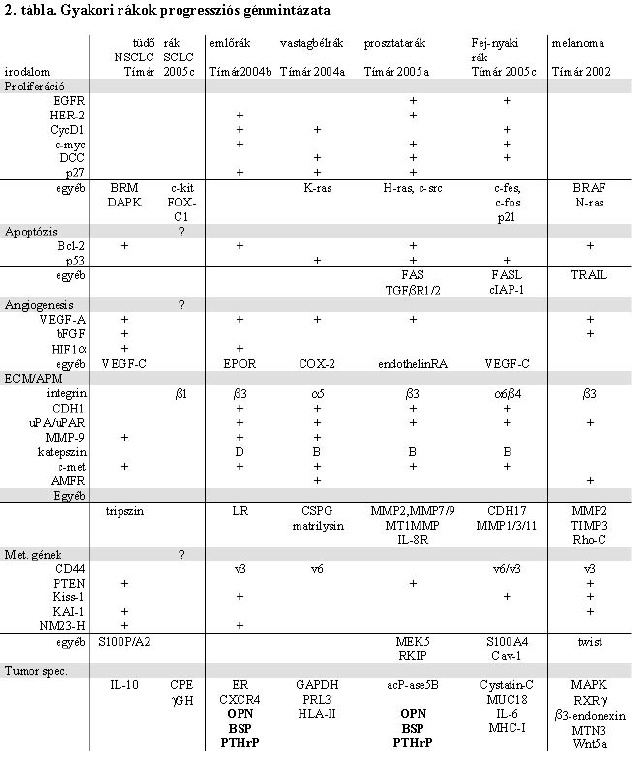
2. táblázat * Gyakori rákok progressziós génmintázata
Általános elvek, az áttétképzés formái
Patológiai értelemben a malignus daganat minimálisan lokális inváziós készséggel rendelkezik, de legtöbbjük limfogén és hematogén áttétképző képességgel is. Ha a lokális inváziós képességet tekintjük, ezzel bizonyos jóindulatú daganatféleségek is rendelkezhetnek, tehát ez a malignitás szempontjából nem egyértelmű jellemző. A daganatos áttétek kialakulása a különböző tumorféleségek esetében más-más formában zajlik, bár a folyamat alapelve és molekuláris mechanizmusának alapjai nagyon hasonlóak. A malignus transzformáció egyik kritériuma az, hogy a megváltozott sejtpopuláció korlátlan, illetve szabályozatlan proliferációs készségre tesz szert, illetve gyakran ezzel egyidejűleg a programozott sejthalálra való készsége megváltozik, túlélőképessége megnő. A két folyamat eredőjeként a daganatos sejtpopuláció felhalmozódik. A daganat progressziója és áttétképzése szempontjából a tumorsejt-populáció növekedési készsége szükséges, de nem elégséges feltétel, és általában gyenge kapcsolatban áll az áttétképző képességgel, illetve sokszor egyáltalán nem is áll azzal kapcsolatban. Ezzel nem azt akarjuk mondani, hogy nincs szükség proliferációs készségre az áttétképző képességhez, hanem csak azt, hogy bármilyen fokú proliferációs készség elegendő feltétel ehhez. Majd látni fogjuk, hogy egyes esetekben a daganatsejtek túlélőképességének sokkal nagyobb jelentősége és szerepe van az áttétképzés folyamatában, mint magának a proliferációs készségnek.
Egy másik fontos jellemzője és kiindulási pontja a daganatos progressziónak, amikor a primer tumor területe tápanyagellátáshoz jut akár a meglévő erek révén, amelyeket a daganat magába foglal, akár új erek kialakítása révén (Tímár et al., 2003a). Maga az angiogenetikus képesség csak a tumorsejt-populáció növekedési feltételeit biztosítja, ez még nem jár együtt az áttétképző képesség kialakulásával is. Azonban a daganatban és a daganat közvetlen környékén lévő erek megteremtik a lehetőségét annak, hogy a tumorsejtek az érpályába jussanak, tehát lehetőséget teremtenek a hematogén áttétképzésre. Sokáig úgy tudtuk, hogy a primer daganatban nincsenek nyirokerek. Mára világossá vált, hogy a primer tumort nemcsak vérerek, hanem nyirokerek is övezik, illetve a daganatsejtek nyirokérburjánzást is kiválthatnak, és ezek gyakran behálózzák a kialakuló daganatot. Ugyanaz érvényesül, mint a vérerek esetében, azaz a tumorszövetben lévő nyirokerek, akár újdonképződöttek, akár ún. inkorporáltak, önmagukban nem elegendőek a nyirokutakon keresztül történő áttétképzéshez, de szükséges feltételei annak.
Lokális terjedés
A daganatok lokális terjedésének egyik legfontosabb aspektusa a tumorsejtek és a környező normális vagy a tumorsejtek által kialakított stromával kialakuló kölcsönhatása, amelynek egy sajátos és az egész progressziós folyamat szempontjából meghatározó triumvirátusát ismerjük, az adhézió - proteolízis - migráció (ADM) szekvenciát (1. táblázat) (Tímár et al., 2001; Chang et al. 2001). Ez az az interakció, amely végeredményben lehetővé teszi, hogy a daganatsejtek a kiindulási helyet - legalábbis minimális távolságra - elhagyják. Egyes daganatok ezt kismértékben képesek végrehajtani, mások nagyon hatékonyan alkalmazzák. A lokális inváziónak egy sajátos aspektusa az, hogy akár az invázióban lévő, akár az inváziót még nem folytató tumorszövet állandó kapcsolatban áll a stromában jelen lévő immunrendszert képviselő sejtes elemekkel. A daganatsejt-populációnak egy része ezen aktivitás eredményeként elpusztul, azonban az is nyilvánvaló, hogy a tumorsejtek jelentős része túléli ezt. Ennek egyik oka lehet, hogy nem is kerülnek kapcsolatba az immunvédekezés sejtes elemeivel, mert nagyon kismértékű a daganatellenes immunválasz, és ezért kis hatékonyságú, de az is lehet, hogy a primer tumorban lévő daganatsejtek olyan faktorokat termelnek, amelyek az immunrendszert magát is gátolják. Tehát a lokális invázió folyamatában fontos szerepe van az immunválasznak, illetve az immunválasz elmaradásának, hiszen az infiltráló daganatsejtek nem pusztulnak el. Sok rosszindulatú daganat esetében a lokális invázió a tumorprogresszióval egyenlő, ilyen daganatféleség például a bőr bazaliómája, de a fej-nyaki rákok egy része is biológiailag csak ezzel a képességgel rendelkezik (Tímár et al., 2005c). Sajnos a rosszindulatú daganatok döntő többsége a lokális invázió mellett, illetve azzal egyidejűleg más típusú inváziós tevékenységet is folytat.
Limfogén és hematogén áttétképzés
A progresszió két másik formája a limfogén és a hematogén áttétképzés. Az elmúlt száz évben a daganatos áttétképzésről kialakított képünk alapvetően a hematogén áttétképzés patomechanizmusának, majd molekuláris mechanizmusának megismeréséből állt (Fidler, 2003), és csak újabban kezdett kialakulni a limfogén áttétképzés patomechanizmusának elmélete, melynek molekuláris alapjait sokkal kevésbé ismerjük, mint a hematogén áttétképzését (Tímár et al., 2005c).
Mint említettem, a limfogén áttétképzés (1. táblázat) alaplépése a daganatban vagy a daganat közvetlen közelében lévő nyirokerek és a daganatsejtek közötti kölcsönhatással kezdődik. E nyirokerek strukturálisan sajátosak, mert csak virtuális bazális membránnal rendelkeznek, és a nyirokkapillárisok endothelje fenesztrált. Mindkét tényező megkönnyíti a daganatsejtek nyirokérbe jutását, az ún. intravazációs folyamatot, amely gyakorlatilag kemokinek, illetve más citokinek mint attraktánsok hatására következik be: a daganatsejtek migrációs készségén kívül mást nem nagyon igényel. Ugyanakkor az nem nyilvánvaló, hogy a nyirokutakba kerülő daganatsejteknek sajátos képességgel kell rendelkezniük, hiszen a nyirokutakban lévő, immunológiailag aktív vagy kompetens effektorsejtek hatásait ki kell tudni védeni. A nyomásviszonyoknak, illetve folyadékáramlásnak megfelelően a daganatsejtek a regionális nyirokcsomókba jutnak. Ez passzív folyamat, ugyanakkor tisztában kell lennünk azzal, hogy itt a nyomásviszonyok nagyon kedvezőek a daganatsejtek terjedése számára, nagyon kicsi annak a lehetősége, hogy olyan nagy mechanikus károsodás érje őket, mint a hematogén áttétképzés során. A nyirokcsomóba jutó daganatsejtek a szubkapszuláris szinuszok területén szoktak leggyakrabban fennakadni, de gyakran eljutnak a medulláris szinuszokig, ahol két lehetőség áll fenn. Korábban azt gondoltuk, hogy a daganatsejtek mindig kivándorolnak, ezután extravazációs folyamat révén a nyirokcsomó stromájába, vagyis a periszinuszoidális térbe, de egyre több adat szól amellett, hogy a daganatsejtek tulajdonképpen válaszút előtt állnak, és sokszor előfordul, hogy a regionális nyirokcsomóba nem vándorolnak ki, hanem a nyirokkeringéssel továbbhaladnak. Ennek azután az lesz az eredménye, hogy amikor a patológus a regionális nyirokcsomóban próbálja vizsgálni, hogy a daganat eljutott-e már ide, esetleg nem talál daganatot, például emlőrák, tüdőrák vagy melanoma esetében, ám amikor távolabbi nyirokcsomót is vizsgál, nagy meglepetéssel tapasztalja, hogy ott viszont metasztázis alakult ki. Ez az ún. átugró vagy skip metasztázis jelensége, amely egyre ismertebb viselkedése a limfogén áttétképzést mutató daganatoknak. A nyirokcsomók esetében is igaz, hogy az extravazációs folyamat a szinuszokban meglehetősen egyszerű folyamat, hiszen ezen szinuszoidok bazális membránja minimális, periciták nem állnak útjában a daganatsejteknek, az endothel sejtek között hatalmas fenesztrációk vannak, tehát itt is a migrációs készség a döntő. A nyirokcsomóba jutó daganatsejtek előtt két lehetőség áll: vagy kedvezőbb körülményeket észlelnek, és ennek hatására elkezdenek osztódni, vagy a körülmények mostoha volta miatt nem osztódnak, és a daganatsejtek megbújnak a nyirokcsomó stromájában. Fontos dolog, hogy a nyirokcsomók kötőszövetes állománya más szövetek alapállományához képest nagyon minimális, az ún. extracelluláris matrix alkotóelemeinek lebontására nincs nagy szükség, hiszen komoly alapállománnyal nem kell megküzdeni a daganatsejteknek. Az egyetlen feladat már a korai stádiumban is az immuneffektor sejtek aktivitásával szembeni rezisztencia. Tehát azt mondhatjuk, hogy a limfogén áttétképzés inváziós szempontból könnyű feladat elé állítja a daganatsejteket, immunológiai szempontból pedig egy nagyon erős, immunrezisztenciára történő szelekciót jelent. Az 1-2 mm-nél nagyobb tumorkolóniák a nyirokcsomóban sem tudnak tovább növekedni az ellátó vérerek kialakítása nélkül, bár erről a folyamatról ma nagyon keveset tudunk. A legújabb adatok szerint azonban magában a nyirokcsomóban is beindul az ún. neoangiogenezis vagy vaszkularizáció, és ez az érhálózat is kiindulópontjául szolgálhat a későbbi hematogén áttétképzési folyamatnak. Sokszor a nyirokcsomóban keletkező áttét az egész nyirokcsomó állományát elfoglalja, sőt a környező perilimfatikus szövetbe is beterjed. Ez minden daganat esetében nagyon rossz prognózisú állapotot jelent.
A hematogén áttétképzés (1. táblázat) az előbbiek szerint tehát kétféle úton jöhet létre. Létrejöhet úgy, hogy a primer tumor lokális inváziója során érintett vérerekbe lépnek a daganatsejtek az intravazációs folyamat során, és létrejöhet úgy is, hogy a nyirokcsomó-áttéteket ellátó vérereket használják a daganatsejtek a vérpályába történő belépésre. A vérerek intravazációs folyamata azonban jelentősen eltér a nyirokerekbe történő belépéstől, hiszen a vérerek struktúrája általában sokkal komplexebb a nyirokerekénél. A bazális membránt erősebb matrix képezi, az endothel sejtek között fenesztráció nem nagyon mutatható ki, és erős pericitaborítás is van az ereken. Ennek ellenére tudjuk, hogy a daganatokban keletkező erek nem mindenben felelnek meg a lokális, normális mikrokapilláris-rendszer ultrastruktúrájának, mert gyakran a pericitaborítás hiányos, az endothelsejtek körüli bazális membrán felrostozódott lehet, és ez mind-mind megkönnyítheti a daganatsejtek intravazációs folyamatát.
A daganatsejtek alapvetően megváltozott környezetbe kerülnek a vérerekbe történő belépéskor. A nyomásviszonyok itt jelentősen eltérnek a primer tumor intersticiális terétől, sokkal nagyobb nyomásnak vannak kitéve. A belépő daganatsejtek nagy része ezen viszonyok megváltozása folytán mechanikus károsodás révén elpusztul. A másik fontos jelenség, hogy a belépő daganatsejteket a keringés immuneffektor sejtjei felismerik és elpusztítják. Ugyanakkor a vérerekbe belépő daganatsejtek, ha képesek a vérlemezkék legalább minimális borítékának kialakítására saját felszínükön (melynek molekuláris feltétele a daganatsejtek ún. trombocita- vagy megakariocita-mimikri jelensége lehet: olyan géneket, felszíni molekulákat expresszálnak, mint a trombociták), ez elősegíti a két sejtféleség között kölcsönhatás kialakulását. Ezek a daganatsejtek jobban ellenállnak a mechanikus hatásnak, és nem férnek hozzájuk az immuneffektor sejtek. Az érpályába jutott daganatsejtek az első ún. filter szervben a dogma szerint fennakadnak. Miután a primer tumort ellátó erek a postkapilláris vénás oldalról származnak, a keringésbe jutó daganatsejtek is a vénás rendszer útján haladnak. Így a szervi áttétek kialakulásának egyik logikája az elvezető vénás hálózat első filter szervében történő fennakadás (Fidler, 2003). Jó példa erre az alsó rektális rákok tüdőbe, illetve a vastagbéldaganatok májba történő áttétképzése.
A célszervbe történő megérkezés nagyon megváltozott mikrokörnyezetet jelent a daganatsejtek számára, tehát egy újabb szelekciós lehetőség, hiszen a szervi kapillárisok endothelje az adott szerv sajátosságait viseli magán antigenicitását tekintve. A daganatsejtek, bár mechanikusan akadnak fenn, ez önmagában nem elegendő ahhoz, hogy itt életteret alakítsanak ki, csak akkor, ha ezekkel az ún. szervi endothel sejtekkel harmonikus viszonyba lépve, extravazációra képesek: át tudnak lépni a szubendotheliális mátrixon, amelyet minimálisan le kell hogy bontsanak, és ki kell jutniuk a kapilláris körüli stromába. Ez egy új citokin, illetve növekedési faktor környezet, és a daganatsejtek jelentős része ezt a környezetet nem képes felhasználni, sem túlélési szignál, sem proliferációs szignál kialakítása céljából. A folyamat a lokális inváziótól eddig a pontig a daganatsejt-populáció megtizedelődése, megszázadolódása, megezredelődése révén valósul meg, és nagyon kevés daganatsejt képes a folyamat során idáig eljutni. Sokszor az extravazáció során az adott szervben, például a csontokban a daganatsejtek egyes vagy néhány sejtes kis kolóniái sokszor évekig, évtizedekig is életben maradnak, de képtelenek további proliferációra vagy nagyobb kolóniák kialakítására. Azonban a szervezet hormonális környezetének, az adott szövet struktúrájának változása, például a menopauza során a csontszövetben beálló alapvető fiziológiás változások mintegy triggerként beindíthatnak olyan folyamatokat, amelyek eredményeként az addig a proliferáció és apoptózis egyensúlyában lévő kis mikrokolónia egyszer csak szaporodni kezd, akár a hormonális hatásokra, akár a növekedési faktorok vagy más citokinek szintjének emelkedése miatt (ha a daganatsejtek rendelkeznek megfelelő receptorokkal). Ekkor megindulhat a mikrometasztázisok kialakulási folyamata, amely természetesen az adott szervben a saját vérellátásának biztosítása nélkül nem tud 1-2 mm-nél nagyobbra növekedni, tehát itt újra az angiogenetikus képességükre lesz szükség. Azonban meg kell jegyezni, hogy ez az angiogenetikus képesség nem feltétlenül kell hogy megegyezzen a primer daganatban megvalósult korábbi angiogenetikus viselkedésükkel, hiszen az adott szervben az erek mások, és a neoangiogenezis folyamatának mechanizmusa alapvetően más lehet az agyban, a májban, a tüdőben vagy a csontokban. Tehát ez is újabb szelekciós lépés lehet, azonban ha a tumorsejt-populáció ezen túljut, megindulhat a makroszkópos áttétek kialakulása, amely a daganatos progresszió utolsó stádiuma szokott lenni. Gyakran megfigyelhető az, hogy ha a primer tumor daganatsejtjei hamar jutottak be a vérpályába, és egy távoli szervben áttéti gócot kialakítottak is, esetleg még mindig immunológiailag védtelenek vagy legalábbis érzékenyek lehetnek az immunrendszer effektor sejtjeivel szemben, mert olyan gyorsan zajlott le a folyamat a primer tumortól a távoli szervi áttéti gócig, hogy annak során az immunrendszernek nem volt módja a daganatsejt-populációt eltávolítani, illetve nem érvényesült az immunszelekciós nyomás. Egyes daganatok, pl. a melanoóma, s még inkább a veserákok esetében emiatt még az áttétekben is van esélye az immunterápiának.
A fentebb felvázolt mechanizmus végigtekintéséből néhány következtetés levonható. Az egyik az, hogy a limfogén és hematogén áttétképzés hasonló elvek alapján valósul meg, de több pontban alapvetően eltér egymástól. Az egyik a nyirok- és vérerek struktúrájának eltérése, a másik az, hogy a limfoid szövetek egymástól nem térnek el jelentősen strukturálisan, ezért ha egyszer a daganatsejtek limfogén áttétet képeztek, az a képesség, ami ezt lehetővé tette, elegendő lesz a többi nyirokcsomóba kialakított áttétek kialakításához is (nincsen ún. szervspecificitás) (Tímár et al., 2005c). Ez nem mondható el a hematogén áttétképzésről, mert az mindig szervspecifikus módon zajlik, még azokban az esetekben is, amikor az első ún. filter szervben akad fenn vagy telepszik meg a daganatsejt (Fidler, 2003). Miért mondjuk ezt? Azért, mert az első filter szerv csak lehetőséget teremt a daganatos kolóniák kialakulására, de csak azok a daganatsejtek képesek ilyen esetben is, legalábbis mikrometasztázisok képzésére, amelyek az adott lokális extracelluláris és citokin miliőben kolónia kialakítására képesek, a többi daganatsejt el fog pusztulni. Egyes tumortípusok esetében ez a szervspecificitás nagyon markáns biológiai jelenség, mint azt a tüdőrák, a prosztatarák vagy az emlőrák esetben látjuk. A tüdőrák esetében egy sajátos anatómiai konstelláció is bonyolítja a helyzetet, mert a tüdőben a primer daganat vérellátása a vénás oldal felől történik, amely ugyanakkor az artériás rendszerbe vezet. Tehát szemben a vénás rendszeren keresztül történő áttétképzéssel, a tüdő esetében a vena pulmonalisba való bejutás az artériás nagyvérkörbe való kijutás lehetőségét teremti meg, és így a daganatsejtek tulajdonképpen az emberi szervezet szinte valamennyi szövetéhez, illetve szervéhez eljuthatnak. Természetesen a metasztázis-képződés szövet- vagy szervspecificitása itt is megnyilvánul, hiszen nem minden szervünkben alakul ki áttét, például a tüdőrák esetében sem, hanem annak kitüntetett helyei az agy, csontok vagy a mellékvesék.
A generalizált daganatos betegség
Nyirokutakon keresztül történő áttétképzésre szinte valamennyi rosszindulatú daganatunk képes. Ennek ellenére a nyirokcsomóáttétek általában nem vezetnek a szervezet halálához, mert azt elsősorban a hematogén áttétképzés során kialakuló szervi destrukciók okozzák. Néhány daganat azonban a nyirokcsomó-áttétképzési folyamat során is képes elpusztítani már a szervezetet: ilyen például a fej-nyaki laphámrák. Ebben az esetben nagy kérdés, hogy milyen úton-módon jön létre az a maradandó, visszafordíthatatlan károsodás a szervezetben, ami a szervezet halálához vezet. Ez az a pont, amely ráirányítja a figyelmet arra, hogy a daganatos progresszió mechanizmusának két szereplője van, az egyik maga a daganatsejt, a másik azonban a gazdaszervezet. A kettőnek a kölcsönhatása tulajdonképpen a progresszió folyamata (Tímár et al., 2003b). A tumorsejtek létrehozzák az áttéti gócokat a korábban felvázolt helyeken, de eközben más is történik a gazdaszervezettel. Az egyik nagyon fontos jelenség, az immunrendszer fokozatos meghátrálása, az immunszuppresszió kialakulása, amely a legtöbb progrediáló daganatban kimutatható, és a daganatsejttel szemben egyre kevésbé aktív immunválaszt eredményez, amely felgyorsítja az egész progressziós folyamatot. Ennek az egyre csökkenő immunválasznak - mint korábban említettük - több eleme van, az egyik az ún. immunszelekciós folyamat, amely tulajdonképpen az egész progressziós folyamat egyik szelekciós síkja, amikor is az áttétképzésre képes daganatsejtek egyben immunrezisztenciával is rendelkeznek. Egy másik lehetőség az, hogy ezek a progrediáló daganatsejtek már nem érzékenyek az immun effektorokkal szemben, mert nem expresszálják azokat az antigének, amelyek szükségesek lennének az immunrendszer számára. Harmadszor, progrediáló daganat egyre nagyobb mennyiségben termelhet olyan citokineket és más molekulákat, amelyek az immunrendszer működését aktívan gátolják; tehát valódi szerzett immunhiányos állapothoz vezethetnek.
Fontos eleme a daganat-gazdaszervezet kölcsönhatásnak az ún. cachexiás állapot kialakulása. Bizonyos daganatok esetében, mint például a fej-nyaki laphámrákok, a daganatos progresszió egy nagyon fontos, majdhogynem meghatározó momentuma a cachexia kialakulása, de a legtöbb progrediáló daganatban is megfigyelhető, és mértéke nem mutat egyértelmű parallelitást a progresszió mértékével (azaz hogy hány szervben, vagy egy-egy szervben milyen mértékben hatalmasodott el a daganat). Adott esetben a primer tumor egymagában elegendő lehet a cachexiás folyamat létrehozására. A tumoros cachexia kialakulásának mechanizmusáról egyre többet tudunk; mediátorai általában a TNFa és IL-6, és célsejtjei a zsírsejtek és a harántcsíkolt izom sejtjei, bár más sejttípusok működésével is interferálni tudnak, mint például a központi idegrendszerrel (Tímár et al., 2003b). A daganatos cachexia egyik jellegzetessége a nyugalmi energiafelhasználás fokozódása, de legjellemzőbb sajátossága az izomszövet fokozott lebomlása, illetve csökkenő reszintézise, és a zsírsejtek metabolizmusának drámai változása. A harántcsíkolt izom esetében a cachexiás citokinek célpontja a mitokondrium, ahol ún. UCP fehérjékre hatnak. Ezek a hő- és ATP-termelést szétkapcsoló fehérjék felelősek részben az energiahiányért és a lebomló fehérjék utáni újra-szintézis kevéssé hatékony voltáért. A daganatos cachexia másik fontos eleme a Cori-kör működésének fokozódása, amely elsősorban a daganatszövetben kialakuló hipoxia miatt következik be, és az ennek eredményeképpen termelődő tejsav dominálja. Az izomszövet folyamatos vesztéséért három mechanizmus felelős. A TNFa az izomspecifikus növekedési faktort, a MyoD1-et kapcsolja ki, aktiválja a myostatint, amely egy TGF-béta-szerű faktor, míg a harmadik lehetőség egy PIF nevű proteolízis-indukáló faktor termelése, amely a 15-HETE nevű bioaktív lipid termeléséhez vezet. A zsírsejtek esetében egy lipidmobilizáló faktort indukál a TNFa, és így a szétkapcsoló fehérjék és a lipidmobilizáló faktorok segítségével tulajdonképpen a két szövetben jelentős bomlási folyamatok indulnak meg, amelyek a cachexiás állapot kialakulásához vezetnek.
A daganatos progresszió dinamikája
Nagy vita van az irodalomban, hogy a daganatos progresszió szétszabdalható-e egyáltalán a fentiekben röviden vázolt szakaszokra, fázisokra, illetve lépcsőkre. Sok daganat esetében a folyamat olyan gyors, hogy ennek a felosztásnak nem sok értelme van, hiszen egymással párhuzamosan zajló folyamatokról beszélünk. A különösen gyors progressziót mutató daganatok két eklatáns példája a tüdőrák (Tímár 2005b, Tímár et al., 2002a), illetve a melanóma. Ugyanakkor egyes daganatok esetében a folyamat látszólag ezen három lépcsőfokra szétválasztható, ezek az ún. lassan progrediáló daganatok, mint például az emlő- (Tímár 2004b) vagy a prosztatarák (Tímár 2005a). A kettő között helyezkedik el ebből a szempontból a vastagbélrák, amelynek a progressziós sebessége a gyors és a lassú progressziót mutató tumorok közé tehető (Tímár 2004a). Ugyanakkor a mai finom molekuláris vizsgálóeszközeinkkel egyre több adattal rendelkezünk e folyamat dinamikájáról, és azokban az esetekben, amikor szisztematikus vizsgálatokra van mód és lehetőség, meg lehet állapítani, hogy például az emlőrák esetében a folyamat nagyon korán kezdődik. Megkísérelték matematikailag modellezni az emlőrák progressziós folyamatát, próbálták meghatározni a primer tumor méretet és ezzel párhuzamosan az első áttétek kialakulásának időpontját, ebből próbálták kiszámolni, hogy tulajdonképpen mikor kezdődhetett el a progressziós folyamat. Azt állapították meg, hogy egy 106 sejtet tartalmazó primer tumorból álló sejtpopuláció esetében már megvan a lehetősége annak, hogy az első áttéti góc valahol a szervezetben kialakuljon (Tímár 2004b). Tehát a daganat fejlődésének egy nagyon korai fázisában megkezdődött a progressziós folyamat, ezért egyes szerzők azt állítják, hogy a rosszindulatú daganat szisztémás betegség. Más daganatféleségek esetében a primer tumorok eltávolításának fázisában a keringésben, csontvelőben molekuláris vizsgálatokkal meghatározhatjuk az esetlegesen disszeminált daganatsejteket. Jól lehet látni, hogy különböző arányban, de bármelyik rosszindulatú daganat esetében kimutathatóak a keringésbe, illetve csontvelőbe jutott daganatsejtek (vastagbélrák, fej-nyaki rákok vagy melanómák esetében is). Az egy más kérdés, hogy mennyi idő fog eltelni addig, amíg ezek a daganatsejtek kolóniákat képezzenek, illetve hogy ezek egyáltalán a forrásai-e a későbbi vagy a késői áttétek kialakulásának. Mindenesetre a fentiekből jól látható, hogy bár ismerjük a daganatok áttétképzésének alapelvét, de ez különböző mechanizmussal, különböző szöveti környezetben, különböző dinamikával történik, és ezért naivitás azt gondolni, hogy a háttérben megbúvó molekuláris mechanizmusok nagyon hasonlóak. Egyre inkább úgy tűnik, hogy az egyes daganatféleségek és azok altípusai esetében a folyamat sajátos formában, molekuláris mechanizmussal történik. A mai korszerű globális genomikai eszközeink alkalmasak arra, hogy ennek a folyamatnak a komplexitását megmutassák, és arra is, hogy a különböző daganatok egyedi sajátosságaira rávilágítsanak (Ramaswamy et al,, 2003).
Prognosztikus patológia
A metasztázisképzésről szerzett ismereteink alapján képesek vagyunk arra, hogy olyan géneket azonosítsunk, amelyek expressziója egy-egy daganatban a progresszió szempontjából meghatározó jelentőségű. Ennek az értelme az lehet, hogy a primer tumor eltávolításakor már meg lehet bizonyos valószínűséggel jósolni a betegség kimenetelét. Ez a beteg gyógyítása szempontjából is fontos lehet, hiszen ennek alapján terápiás stratégiákat is fel lehet építeni. Ezért manapság a patológia legdinamikusabban fejlődő ága a prognosztikus patológia. Leggyakoribb rosszindulatú daganataink a progresszió folyamatában hasonló elveket követnek, ahogy azt az első részben láttuk, azonban ez daganattípusonként más-más formában valósul meg, illetve más-más géneket vesz igénybe. A prognosztikus génexpressziós mintázat meghatározása, bár korántsem teljes, bizonyította azt, hogy egymástól eltérő szövettani szerkezetű, viselkedésű daganatok igenis használnak hasonló stratégiákat a progresszió során, valamint azt is bebizonyította, hogy ennek ellenére az individualitásukat is számos sajátságos gén expressziója határozza meg (2. táblázat).
Proliferáció és apoptózis
A progresszió szempontjából sem elhanyagolható jelentőségű proliferációszabályozás mechanizmusai közül az epidermális növekedési faktor-receptorcsalád (EGFR) elsősorban annak az 1. és 2. formája a leggyakrabban érintett. Az ezek által szabályozott ciklinek közül a ciklin D1 igen gyakran prognosztikus jelentőségű faktor, társulva az általa szabályozott c-myc onkogénhez. Az onkoszuppresszor gének közül a leggyakoribb daganatainkban a DCC szuppresszor gén és a p27 proliferációgátló faktor, melyek a leggyakrabban érintettek. Ugyanakkor jól látszik, hogy a különböző típusú daganatok a sejtproliferáció szabályozása szempontjából is eltérő molekuláris stratégiákat alkalmaznak; ebből a sorból talán a melanóma lóg ki a legjobban, hiszen a hámeredetű daganatok által használt mechanizmusokból praktikusan alig hasznosít valamit. A progresszió szempontjából talán még fontosabb tényező az apoptózis, illetve a túlélőképesség szabályozó mechanizmusa. Meglepő módon limitáltak ismereteink ebből a szempontból, de az eddigi ismereteink szerint ezt két-három gén működése és expressziója irányítja a leggyakoribb daganatainkban, ez pedig a Bcl-2 antiapoptotikus illetve a p53 gén (elsősorban is annak mutációja, 2. táblázat). Ez a leggyakrabban érintett két szabályozómechanizmus, ami felveti annak lehetőségét, hogy a nagyon különböző daganatok ilyen irányú képességét ezek révén meg lehet jósolni és esetleg terápiásan befolyásolni.
Angiogenezis
Az angiogenezisre is igaz egy kicsit az, ami az apoptózis szabályozására érvényes, hogy egy általános szabályozómechanizmus (a hypoxia-faktor és az ahhoz kapcsolódó rendszer) dominál a daganatokban (Tímár et al., 2003a). Az angiogenetikus képességet leggyakrabban a VEGF-A vérér-növekedési faktor szabályozza, és ez egyben prognosztikus faktor is a legtöbb epitheliális eredetű, de más daganatban is. Alternatívaként leggyakrabban a bázikus FGF szerepel, és egyes daganatok esetében a limfangiogenezist szabályozó VEGF-C faktor expressziója is fontos lehet.
Extracelluláris mátrix kölcsönhatások
Az extracelluláris mátrix-kölcsönhatás, mint láttuk, szükséges és meghatározó tényezője a daganatos progressziónak. Ez esetben mind az adhéziós molekulák, mind a proteázok, mind pedig a motilitást szabályozó molekulák expressziójának nagy szerep jut, és ebben feltűnő hasonlóság van az egyes daganatok között. Az integrinek fokozott expressziója, közöttük a b3 integrin gyakori prognosztikus szerepe egyértelmű. Ehhez igen gyakran a sejtadhéziós molekulák közül az epitheliás kadherinnek az elvesztése társul. A proteázok közül a metasztatikus daganatok között a leggyakrabban használt proteáz-rendszer az uPA/uPAR (urokináz plazminogén aktivátor és receptora), emellett a mátrix metalloproteázok közül az MMP-9 gyakran használt daganataink által, míg a katepszinek közül a katepszin-B a legnépszerűbb. A motilitást szabályozó mechanizmusok közül a parakrin motilitást szabályozó c-met onkogén expressziója és nyilván, az ehhez tartozó HGF citokin esetleges autokrin szerepe is szóba jöhet, de nem elhanyagolható a szerepe az ún. autokrin motilitást szabályozó mechanizmusnak sem, amely több daganatban is főszerepet kap (AMFR).
Az ún. metasztázis gének
Az metasztázis gének közül a CD44 több tumorféleségben is érintett, elsősorban splice variánsai révén. Meglepő módon, a korábban felfedezett, v6 exont tartalmazó "metasztázis-variáns" mellett a v3-at tartalmazó variánsok is gyakran előfordulnak a daganatokban (Tímár et al., 2002b). Az első ún. metasztázis-szuppresszor gén az NM23 volt, melynek felfedezésében jelentős szerepet játszott a magyar Kopper László professzor (Steeg et al., 1988). Az metasztázis-szuppresszor gének közül, melyeknek ma már egy meglehetősen széles skáláját ismerjük, többet is használnak gyakoribb daganataink (néha kettőt-hármat is), és némelyik esetében, mint például a melanóma, egy ennél is szélesebb paletta szerepel.
Tumorspecifikus génexpressziós mintázat
Az egyéb gének közül az egyes tumorok igen különböző mintázattal jellemezhetők a progresszió során (2. táblázat). Itt nyilvánul meg igazán az egyes daganatok individuális viselkedése, mint például az ösztrogénérzékeny daganatok ösztrogénreceptora, illetve a hozzá csatolt szabályozómechanizmus, vagy az androgénreceptor által szabályozott mechanizmusok prosztatarákban. A melanómának sajátos expressziós mintázata van, amely az adhéziós molekulák jeltovábbító rendszerei mellett a retinolsav-receptort és a WNT-szignálrendszert is jelenti. Gyakran azt is lehet látni, hogy az azonos szervi metasztatizáló képességgel bíró daganatok között nagyfokú hasonlóság van, mint például azt a csontáttétképző képességgel rendelkező emlőrák és prosztatarák hasonló expressziós mintázata jelzi, amikor is csontmátrix-fehérjék és a PTHrP hormon expressziója a közös jellemző. Az egyes daganatok génexpressziós mintázatának megismerése nemcsak azzal kecsegtet, hogy jobban és pontosabban tudjuk megjósolni a biológiai viselkedését például egy adott individuális daganatnak, hanem ráirányítja a figyelmet a potenciális terápiás célpontokra, amelyek az eddigi ismereteink alapján is már rendelkezésünkre állnak.
A daganatprogresszió terápiájának molekuláris célpontjai (Tímár et al., 2003b)
A jelenleg alkalmazott terápiás eljárások sejtproliferáció-gátló gyógyszerek alkalmazásából állnak, és mint láttuk, a daganatos progresszió kulcslépései ezektől a mechanizmusoktól független folyamatok. Nem véletlen, hogy a kezelések magának a progressziós folyamatnak az elindulására nagyon csekély hatással vannak. Ennek ellenére egyes terápiák, elsősorban az újabb célzott terápiák, jelentősen tudják befolyásolni a daganatos progressziót is, ha a proliferációt szabályozó mechanizmusok a progresszió szempontjából is kulcsszerepet töltenek be, mint például az emlőrák progressziójában a HER2-amplifikáció. Ezért van az, hogy a Herceptin (anti-HER-2 antitest) terápia a progressziós folyamatot is befolyásolja. Az várható, hogy például az EGF-receptort célzó terápiák azokban a daganatokban, ahol az EGF-receptor expressziója prognosztikus jelentőségű is (mint a prosztatarák vagy a fej-nyaki daganatok), hatékonyak lesznek nemcsak a kialakult daganat elpusztításában, hanem az áttéti folyamat megelőzésében is. Mint látjuk a 2. táblázatban, az apoptózist szabályozó mechanizmusok közül a daganatos progresszió során a p53 onkoszuppresszor gén, illetve a Bcl-2 gyakori érintettsége figyelhető meg, és miután rendelkezünk hatékony génterápiás eszközzel, amely a Bcl-2 gén fokozott működésének felfüggesztésére képes (Bcl-2 antiszensz terápia), ez azzal kecsegtet, hogy ennek alkalmazása több daganat esetében is a progressziós folyamat hátráltatásához fog vezetni. A metasztázisok kialakulásához is érellátásra és neoangiogenezisre van szükség, és az ún. anti-angiogenetikus gyógyszerek alkalmazásának talán ez lenne a legideálisabb helye a daganatos betegek kezelésében, hiszen láthatóan közös mechanizmusok működnek. Leggyakrabban a VEGF-A citokint használják a daganatok, és az ez elleni monoklonális antitest már klinikai alkalmazásra került néhány tumortípus esetében. Minden bizonnyal a közeljövőben ennek a gyógyszernek az alkalmazása még szélesebb körben valósulhat meg. Ezeket a szereket azonban a primer tumor eltávolítása után közvetlenül kellene alkalmazni, mert akkor van esély arra, hogy hatékonyan tudják gátolni a szétszóródott egyedi daganatsejtekből mikroszkópos kolóniák kialakulását. Ugyanakkor a már kialakult tumorszövetekkel és azok vérellátásával minden bizonnyal nem fognak tudni mit kezdeni az ilyen típusú gyógyszerek.
Az extracelluláris mátrix-kölcsönhatások attraktív célpontjai a daganatprogresszió elleni kezeléseknek. A b3 integrin potenciális terápiás célpontként került előtérbe, hiszen több daganat esetében is bizonyított a szerepe a progressziós folyamatban, és rendelkezésre áll olyan, a humán gyógyászatban már kipróbált antitest-terápiás eszköz, amely a b3 integrin működését képes felfüggeszteni; nagy a valószínűsége, hogy a közeljövőben sor fog kerülni ilyen típusú klinikai vizsgálatokra. A proteázokkal kapcsolatban az eddig kipróbált szerek kevés eredményt értek el a progressziós folyamat lassításában. Ez valószínűleg azért van, mert ugyan a daganatok hasonló enzimeket használnak, azonban minden egyes tumorféleség többféle proteáz egyidejű alkalmazásával éri el a hatékony kötőszövet-lebontást, és az eddig kifejlesztett gyógyszerek csak egy-egy proteáztípus, illetve annak egy-egy alformája működésének felfüggesztésére képesek. Nyilvánvalóan a közeljövőben olyan koktélokat fognak kipróbálni, amelyek a daganatban jelen lévő valamennyi proteáztípus aktivitásának egyidejű gátlásával tudnak operálni. Nagy kérdés, hogy a sejtmozgást szabályozó mechanizmusokat hogyan lehet terápiás célpontként felhasználni. Látható, hogy meglehetős hasonlóság van ez esetben is a legkülönfélébb daganatok között. Elsősorban a c-met onkogének általános használata feltűnő a progressziós képességgel rendelkező daganatokban. Ez a membrán-fehérje tirozin kináz aktivitású, azonban erre specifikus gátlószer sajnos jelenleg még nem áll rendelkezésre.
A metasztázisgénekről általánosságban azt lehet mondani, hogy nehezen képzelhető el olyan hatékony terápiás eszköz (elsősorban talán génterápiás eszköz), amellyel humán viszonyok között is meg tudnánk változtatni egy daganat biológiai képességét a metasztázisgének kikapcsolásával. Ezek közül a CD44 molekula egy olyan géntermék, amely a sejtfelszínen expresszálódik, és jellegzetes jelátviteli útvonallal rendelkezik. Felmerül az a lehetőség, hogy mint minden sejtfelszínen expresszálódó daganatsejt-fehérje ellen, ezellen is hatékony és esetleg biológiai aktivitással rendelkező monoklonális antitestet lehet kifejleszteni.
Az extracelluláris mátrix-kölcsönhatások daganatprogresszióban játszott szerepére legjobb példa a biszfoszfonát-terápia. A csontáttétképző daganatok viselkedését egy olyan gyógyszer képes megváltoztatni, illetve a progressziós folyamatot lassítani, amelynek primer célpontja nem is maga a daganatszövet, hanem a csontszövet, ennek stabilizálásával és az osteoclast-aktivitás csökkentésével éri el a hatékony progressziógátló hatását. Ez a gyógyszer nagyon jó példája annak is, hogy milyen típusú gyógyszerek lehetnek azok az új, progresszióban klinikailag is hatékonynak bizonyuló gyógyszerek, melyek nem a sejtproliferációt tekintik célpontnak, hanem sokkal inkább azokat a finom molekuláris mechanizmusokat, amelyeknek olyan nagy jelentőségük lehet egy-egy szövetbe történő áttétképzés során.
Ugyanígy továbbra is fontos szerepe lehet progressziós szempontból az ún. hormonális környezetnek. Elsősorban azon daganatok esetében, amelyek hormonérzékenyek (emlőrák és a prosztatarák), továbbra is az ösztrogén és androgén receptort befolyásoló szereknek lesz a progresszió folyamatában is meghatározó jelentőségük.
Mint említettük, az immunrendszerrel való kölcsönhatás az egész progressziós folyamatot végigkísérő jelenség. Az immunterápia is hatékony módszer lehet a progressziós folyamat lassítására vagy megelőzésére. Ehhez azonban sokkal célzottabban kell alkalmazni, és csak olyan esetekben, amikor a daganatsejtek még bizonyítottan érzékenyek az immuneffektor sejtekre, és az immunrendszer maga is aktív vagy legalábbis aktiválható. Minden egyéb esetben az immunterápiának semmiféle jótékony hatása nem várható a progressziós folyamat szempontjából.
Végül egy fontos és az utóbbi időben újra a figyelem középpontjába került területe a progressziós folyamatnak az antiaggregációs vagy hemosztatikus terápia kérdése. A daganatos progresszió legvégső fázisa az, amikor a daganatsejtek a keringésbe kerülnek, és onnan kolonizálják a különböző szöveteket. Jól tudjuk, hogy a trombocitákkal kialakuló kölcsönhatásnak meghatározó jelentősége van ezen folyamat hatékonyságában. A belgyógyászat, illetve hemosztazeológia számos új, nagyhatású és igen specifikus gyógyszert állított elő, amelyek a véralvadási rendszer különböző elemeit képesek finoman szabályozni, illetve a trombocita-aggregációt gátolni. Az elmúlt évek klinikai fázisvizsgálatai hívták fel a figyelmet arra, hogy a trombózis profilaxisra oly sikeresen használt alacsony molekulasúlyú heparinok széleskörű alkalmazása a daganatgyógyászatban mintegy mellékhatásokat produkálva, a legkülönfélébb daganatok progressziós folyamatát lassította. Ennek magyarázata csak részben az, hogy az alacsony molekulasúlyú heparinok a véralvadásgátlás révén megakadályozzák a daganatsejtek körüli mikrotrombusok kialakulását. Ezen alacsony molekulasúlyú heparinok részt vesznek a tumorsejt-endothelsejt kölcsönhatásban, amely az extravazációs folyamat egyik meghatározó lépése, ugyanakkor nem specifikus módon, de hatékonyan képesek felfüggeszteni az extracelluláris mátrix fehérjéivel kialakuló kölcsönhatásokat, és láttuk, hogy ennek milyen nagy jelentősége van például a csontáttétek kialakulásában. Tudjuk jól, hogy számos növekedési faktor és citokin heparinkötő képességgel rendelkezik; ilyenek a daganatsejtek számára kulcsszerepet betöltő epidermális növekedési faktor (EGF) és a hepatocita növekedési faktor (HGF), de az angiogenezis valamennyi stimuláló tényezője is heparinkötő képességgel rendelkezik. A heparin lenne tehát egy olyan ideális, nem specifikus, de annál hatékonyabb, a daganatprogressziót megelőző gyógyszer, amely megbízhatóan, jelentősebb mellékhatások nélkül lenne képes a progressziós folyamat korai lépéseinek gátlására. Természetesen például a heparintól azt nem lehet várni, hogy a már kialakult mikrometasztázisokat vagy a metasztatikus gócot is befolyásolja.
Ezzel eljutottunk a daganatprogresszió potenciális jövőbeli terápiájának kulcskérdéséhez. Hasonlóan az ún. kemoprevenciós kutatásokhoz, itt is a metasztázis-képződés kemoprevenciójára vonatkozó kutatásokra lesz szükség, hiszen a folyamatot hatékonyan igazán csak abban a korai fázisban lehet megakadályozni, amikor a daganatsejtek még egyedi sejtekként vagy kis sejtcsoportokként utaznak a szervezet különböző üregeiben, a vérpályában, az egyes szervekben. Tehát olyan gyógyszerekre lesz szükség, amelyeket hosszú időn át mellékhatás nélkül lehet adagolni, hogy a progressziós folyamatot jelentősen gátolják vagy netán fel is függesszék. Ezek a szerek azonban ezek szerint egészen más típusúak kell hogy legyenek, mint a daganatgyógyászatban ma használt citosztatikus gyógyszerek; az azokra jellemző toxicitási paletta a progressziót gátló gyógyszerek esetében elképzelhetetlen, hiszen sokkal hosszabb ideig kell őket folyamatosan alkalmazni. Ezeknek a kemoprevenciós szereknek más farmakológiai hatásokkal kell rendelkezniük, és talán nem is véletlen, hogy a kipróbálásra kerülő vegyületek közt miért van oly sok ún. természetes, környezetünkben előforduló molekula.
Összefoglalva, ismereteink nap mint nap, szinte exponenciálisan bővülnek az egyes daganatféleségek progressziójában szerepet játszó génekről, az azok által működtetett molekuláris mechanizmusokról, ami azzal a reménnyel kecsegtet, hogy a folyamat megismerhető, és azzal is biztat, hogy ez hatékonyabb terápiák kialakításához vezet. Természetesen ehhez arra van szükség, hogy a progresszióra vonatkozó alapkutatásokra és ezek eredményeinek hasznosítására a folyamat jelentőségének megfelelő figyelem, valamint megfelelő mértékű anyagi erőforrás fordítódjon, hiszen e nélkül nehezen képzelhető el egy sikeresebb klinikai onkológia.
Kulcsszavak: genomika, rák, progresszió, prognózis, predikció

2. táblázat * Gyakori rákok progressziós génmintázata
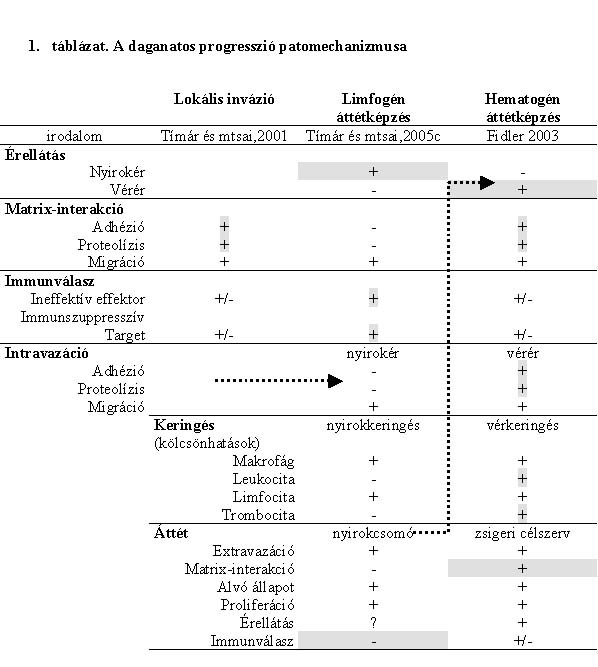
1. táblázat * A daganatos progresszió patomechanizmusa
Irodalom
Chang, Chieh - Werb, Zena (2001): The Many Faces of Metalloproteases: Cell Growth, Invasion, Angiogenesis and Metastasis. Trends in Cell Biology. 11, S37-43.
Fidler, Isaiah J. (2003): The Pathogenesis of Cancer Metastasis: The 'Seed and Soil' Hypothesis Revisited. Nature Reviews. Cancer. 3, 453-458.
Ramaswhamy, Shridhar - Ross, K. N. - Lander, E. S. - Golub, T. R. (2003): A Molecular Signature of Metastasis in Primary Solid Tumors. Nature Reviews. Genetics. 33, 49-54.
Steeg, Patricia S. - Bevilacqua, G. - Kopper L. - Thorgeirsson, U. P. - Talmadge, J. E. - Liotta, L. A. - Sobel, M. E. (1988): Evidence for a Novel Gene Associated with Low Tumor Metastatic Potential. Journal of the National Cancer Institute. 80. 200-2004.
Tímár József - Csuka O. - Orosz Z. - Jeney A. - Kopper L. (2001): Molecular Pathology of Tumor Metastasis. I. Predictive Pathology. Pathology and Oncology Research. 3, 217-230.
Tímár József - Csuka Orsolya (2002a): A malignus melanoma molekuláris diagnosztikája: molekuláris stadium meghatározás, minimális reziduális betegség. Magyar Onkológia. 47, 63-69.
Tímár József - Lapis K. - Dudás J. - Sebestyén A. - Kopper L. - Kovalszky I. (2002b): Proteoglycans and Tumor Progression: Janus-Faced Molecules with Contradictory Functions in Cancer. Seminars in Cancer Biology. 12, 173-186.
Tímár József - Döme B. - Paku S. (2003a): Angiogenesis. In: Kéri György - Tóth István (eds.): Molecular Pathomechanisms and News Trends in Drug Research. Taylor & Francis, London-New York, 465-487.
Tímár József - Ladányi, A., Peták, I., Jeney, A. - Kopper, L. (2003b): Molecular Pathology of Tumor Metastasis III. Target Array and Combinatorial Therapies. Pathology and Oncology Research. 9, 49-72.
Tímár József (2004a): A vastagbélrák prognosztikai faktorai. In: Bodoky G. (ed.): Onco Update 2004. Melania, Budapest, 30-38.
Tímár József (2004b): Az emlőrák prognosztikai faktorai. In: Bodoky G. (ed.): Onco Update 2004. Melania, Budapest, 184-191.
Tímár József (2005a): Az uroonkológiai daganatok prognosztikai faktorai. In: Bodoky G. (ed.): Onco Update 2005. Melania, Budapest, 264-274.
Tímár József (2005b): A tüdőrák prognosztikai faktorai. In: Bodoky G. (ed.): Onco Update 2005. Melania, Budapest, 127-139.
Tímár József - Csuka O. - Remenár É. - Répássy G. - Kásler M. (2005c): Progression of Head and Neck Squamous Cell Cancer. Cancer and Metastasis Reviews. 24, 107-127