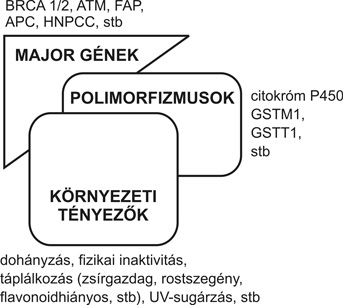
1. ábra * Genetikai és környezeti tényezők kölcsönhatása a daganatos betegségek keletkezése során (a területek átfedése additív vagy multiplikatív hatást reprezentál)
A genetikai kutatások nagyarányú fejlődése, a Human Genom Project eredményessége, illetve a betegségek keletkezésével, progressziójával kapcsolatos genetikai ismeretek exponenciális halmozódása következtében napjainkban egyre sürgetőbben fogalmazódik meg a genetikai ismeretek népegészségügyi hasznosításának igénye nemcsak a tudományos kutatások szintjén, de a közvélemény elvárásaként is.
Ismertté vált, hogy a genetikai meghatározottság nemcsak ritka, jellemzően veleszületett betegségek esetében jelent kóroki tényezőt, de az igen magas incidenciával és prevalenciával jellemezhető klasszikus népbetegségek (szív-érrendszeri, daganatos, anyagcsere- stb. betegségek) esetében is a fogékonyság (illetve veszélyeztetettség) mértékének meghatározásában lényeges jelentőséggel bírhat.
A népegészségtan mint multidiszciplináris tudomány olyan interszektoriális gyakorlat (a népegészségügyi tevékenység) elméleti megalapozását jelenti, melynek célja a lakosság egészségi állapotának javítása, a betegségek megelőzése. Az alapvető kérdés következésképp az, hogy a genetika eredményei miként hasznosíthatók a betegségek megelőzését célzó preventív intervenciók elméleti megalapozásában. Mára a népegészségügyi genetika a népegészségtan és a genetika módszertanának és eredményeinek ötvözésével jellemezhető új határterületi tudományággá fejlődött, szükségszerűen vezetve paradigmaváltáshoz a prevenció értelmezésének területén.
Tradicionális értelmezésben a prevenció három szintje különböztethető meg: primer (a potenciálisan megbetegedést okozó tényezők kiiktatása), szekunder (a betegségek korai felismerésével - mely jellemzően szűrővizsgálattal lehetséges - a gyógyulás esélyének növelése- illetve a betegségek okozta halálozás mértékének csökkentése) és tercier (a betegségek progressziójának gátlása, a maradandó egészségkárosodás mértékének csökkentése, gyakran a rehabilitáció eszköztárával) prevenció. A genetikai prediszpozíció- illetve veszélyeztetettség felismerésével a prevenció szintjeinek fenti, hagyományos klasszifikációja nem illetve nehezen alkalmazható. A genetikai hajlam gyanúja (illetve igazolása) esetén ugyanis primer prevencióra nincs mód (a rizikótényező nem iktatható ki), ugyanakkor a veszélyeztetettség kimutatását célzó szűrővizsgálat nem tekinthető szekunder prevenciós ténykedésnek sem, hisz nem a betegség, hanem az iránta fennálló fogékonyság kimutatását célozza. A genetika eredményeire támaszkodó, a krónikus, nemfertőző betegségek kapcsán kifejtett sajátos prevenciós tevékenység a primer és szekunder prevenció határterületén helyezhető el Eric T. Juengst (1995) javaslatát és meghatározását elfogadva, fenotípus prevenció néven, mely a megbetegedés kialakulásának megakadályozását célozza adott genotípusú egyének (magas rizikójú csoportok) esetében.
A daganatos betegségek megelőzése, mind a primer (például: dohányzásellenes tevékenység), mind a szekunder prevenció (például: szűrővizsgálatok) szintjén, a népegészségügy egyik legerőteljesebb ambíciója, illetve gyakorlata. A fenotípus prevenció lehetősége és szükségessége az elmúlt évtizedben vált egyértelművé, amikor a daganatos betegségek genetikai meghatározottságát vizsgáló kutatások az egyértelműen genetikai meghatározottságú, de rendkívül ritka daganatos kórképektől a magas morbiditású és mortalitású daganatos megbetegedések felé fordultak.
A megbetegedések etiológiájának koncepcionális értelmezése szerint, mely a népegészségügyi gyakorlat általános alapelveit is levezethetővé teszi, a betegségek a genetikai és környezeti tényezők együttes - betegségtípusonként változó arányban és mértékben érvényesülő - hatásának eredményeként alakulnak ki. Ez a koncepció jelenti a daganatos betegségek etiológiai értelmezésének és következményesen a megelőzési tevékenységnek is az alapját.
A daganatos betegségek kialakulásában és progressziójában a genetikai és a környezeti tényezők egyaránt fontos szerephez jutnak. Népegészségügyi szempontból egy adott daganatos betegség familiáris halmozódását tekintik genetikai háttérre utaló jelnek. Első megközelítésben e feltételezés egyértelműen elfogadható, de amellett, hogy egy adott gén örökletes mutációját tételezzük fel a jelenség hátterében, nem zárható ki az a lehetőség sem, hogy több, a betegség kialakulása szempontjából az egyénre nézve kedvezőtlen konstellációt jelentő allél-izomorf örökletes társulása és/vagy hasonló környezeti tényező(k) érvényesülése áll a halmozódás hátterében. Természetesen e három lehetőség kombinált fennállása is lehetséges, annál fokozottabb veszélyeztetettséget jelentve, minél több hajlamosító tényező együttes előfordulásával jellemezhető az egyén vagy egy közösség rizikóstátusa (1. ábra).
Genetikai tényezők
Major gének
A magas penetranciával jellemezhető génmutációk populációs frekvenciája általában alacsony. Etiológiai szerepük valószínűsége a familiáris halmozódás hátterében annál nagyobb, minél gyakoribb a családon belül a korai manifesztációjú, klinikailag sajátos megjelenésű (például emlőrák esetében bilaterális lokalizációjú) kóresetek száma.
A népegészségügyi szempontból, relatíve magas incidenciájuk miatt, legjelentősebb daganatos betegségek közül eddig az emlőrák (illetve petefészekrák), a vastagbélrák, a prosztatarák és a melanóma esetében került major gén azonosítására.
Az emlőrákra (és ováriumrákra) hajlamosító BRCA1 és BRCA2 gén mutációinak előfordulási gyakorisága populációs szinten igen variábilis. Az USA lakossága esetében a karrierfrekvencia becsült értéke 1:500, de egyes etnikai csoportok esetében ettől lényegesen eltérhet. Askenázi zsidó közösségekben a génhordozók gyakorisága lényegesen magasabb, elérheti a 2,6 %-ot is (Grann et al., 1999), míg a fekete női lakosság esetében akár a gén hiánya sem zárható ki. Mindkét gén penetrancája igen magas, 84-85 % valószínűséggel idézik elő a hordozó egyén megbetegedését a teljes élettartam vonatkozásában. Hangsúlyt érdemel, hogy a BRCA1 gén hordozók esetében az 50. életév előtti (ún. korai) manifesztáció valószínűsége lényegesen magasabb, mint a BRCA2 gén karrierek esetében (51 % v. 28 %). Az emlőrák-megbetegedések kb. 4-10 %-a BRCA1/BRCA2 gén hordozással hozható kapcsolatba. Bár a BRCA1 génhibák közel 90 %-a frame-shift vagy nonsense mutáció, megjegyzendő, hogy az eddig, manifeszt emlőrák kapcsán leírt mutációk száma meghaladja a kétszázat, ami esetleges szűrővizsgálati program kidolgozása, illetve szűrőteszt kiválasztása kapcsán komoly korlátozó tényező.
Az örökletes vastagbélrák mindkét formája kapcsán azonosításra került az ún. "daganatkeltő" major gén, melyek elnevezése a kórforma jellegzetességére utal. A FAP (familiaris adenomatosus polyposis) és a HNPCC (herditary non-polyposis colorectal cancer) gének populációs frekvenciája igen eltérő, a FAP gén esetében 1:10 000-re (Burt - Petersen, 1996), míg a HNPCC gén esetében 1:200-400-ra becsült. Ezzel összhangban az USA-ban a vastagbélrák esetek 0,5 %-ában FAP, további 5 %-ában HNPCC génhordozás valószínűsített. Megjegyzendő, hogy a HNPCC génkonstelláció géncsaládot, s nem egyetlen gént jelöl. Ismert, hogy legalább négy mismatch repair gén (hMSH2, hMLH1, PMS1, PMS2) hibája azonosítható - eltérő gyakorisággal - HNPCC kapcsán (Fishel et al., 1993). Hasonlóan, a FAP génhordozók jellemzően APC génmutánsok is (Burt - Petersen, 1996). A FAP/APC génpenetrancia rendkívül magas (gyakorlatilag 100 %-os valószínűséggel jelentkezik a kiterjedt polyposisos elváltozás a 40. életév előtt), s a HNPCC gének penetranciája is 35 % körüli az 50. és 80 % körüli a 70. év betöltése előtt (Vasen et al., 1996).
A prosztatarák esetében az örökletes tényezők szerepe nem vitatott, de kevésbé karakterizált, mint az emlőrák és a vastagbélrák esetében. A HPC1 szuszceptibilitási lokusz azonosítása óta egyetlen olyan vizsgálat történt, mely a gén populációs frekvenciájára és penetranciájára vonatkozóan szolgáltatott adatokat. A svéd lakosságra reprezentatív mintán a frekvenciát 1,67 %-nak, míg az élettartam-penetranciát 63 %-nak találták. Újabb vizsgálatok előrelépést jelentettek a genetikai háttér tisztázása terén, de az információnyerés és hasznosíthatóság korlátait is feltárták (Simard et al., 2002). Tekintettel a prosztatarák relatíve késői manifesztációjára, valamint az örökletes és sporadikus formák klinikai hasonlóságára a kutatási lehetőségek igen korlátozottak.
A melanóma-incidencia világszerte növekvő tendenciája népegészségügyi szempontból is érdekessé teszi a kórforma örökletes jellegét igazoló tanulmányokat. A CDKN2A tumor szupresszor gén mutációját a vizsgált melanóma-esetek 7,8 %-ában ki tudták mutatni. Lengyel kutatók által elvégzett vizsgálatok hasonló eredménnyel jártak, a gén A148T mutáns variánsának előfordulási gyakoriságát melanómás esetcsoportban 7 %-nak találták, szemben az általános populáció esetében becsült 2,9 %-kal (Debniak et al., 2005).
Polimorfizmusok
A genetikai polimorfizmusok és lehetséges következményei kutatásának új lendületet adott a Human Genom Project komplettálása. Ezek az alacsony penetranciájú mutációk egyedileg viszonylag csekély rizikónövekedéssel járnak, de ugyanakkor populációs frekvenciájuk mindig számottevő (per definitionem egy gén adott genetikai módosulata abban az esetben tekinthető csak polimorfizmusnak, ha populációs frekvenciája eléri, illetve meghaladja az 1 %-ot) és egy adott egyén esetében az előnytelen fenotípust eredményező genetikai polimorfizmusok halmozottan fordulhatnak elő, ami (a "sok kicsi sokra megy" elv alapján is) következményesen jelentős rizikónövekedéssel járhat. Ma általánosan elfogadottnak tekinthető az a nézet, miszerint a polimorfizmusokra visszavezethető rizikónövekedés népegészségügyi jelentősége az ismeretek bővülésével egyre jelentősebb mértékben múlja felül a major gének által reprezentált általános populációs rizikó súlyát.
Míg a major gének egy adott (s esetleg néhány rokonítható) malignitás vonatkozásában jelentenek rizikónövekedést, az előnytelen polimorfizmusok általában a szervezet védelmi kapacitásának szűkítésén keresztül a daganatos betegségekkel szemben általános rizikónövekedéshez vezetnek.
A citokróm P450 szuperfamilia génjeinek előnytelen polimorfizmusai a kémiai expozíció talaján induló karcinogenezis veszélyét fokozzák azáltal, hogy a különböző xenobiotikumok (mint a policiklikus aromás szénhidrogének, benz(a)pirén, heterociklikus aminok stb.) detoxifikálási folyamatát lassítják, esetleg gátolják. A CYP17 A2/A2 és A2/A1 genotípusú egyének esetében az emlőrák kialakulásának rizikója fokozott. Beágyazott esetkontroll-tanulmány eredménye szerint az A2 allél hordozása kb. két és félszeres rizikónövekedéssel jár, ami azért érdemel különös figyelmet, mert az allél populációs frekvenciája 40 % körüli.
Hasonlóan befolyásolják a karcinogenezis folyamatát az N-acetil-transzferáz enzim génjeinek (NAT1 és NAT2) polimorfizmusai, elsősorban a cigarettafüstben előforduló aromás aminok detoxifikálási és aktiválási folyamatainak befolyásolásával. Szerepük a vastagbél- és tüdőrákok esetében egyaránt valószínűsített.
A glutation-S-transzferázok egyes ismert polimorf variánsai (GSTM1, GSTT1) a karcinogén kémiai ágensek eliminációjának befolyásolásán keresztül vezethetnek fokozott rizikóstátus kialakulásához. A GSTM1 genotípus és a vastagbélrák asszociációját genetikai epidemiológiai vizsgálat eredményei is alátámasztják.
Fentiekkel ellentétben arra is van példa, hogy egy polimorf allél jelenléte csak egy adott daganattípus vonatkozásában jelent rizikónövekedést. Az APC gén - a major gén mutációtól független - I1307K polimorf variánsa (melynek előfordulási gyakorisága az askenázi zsidó populációban eléri a 6 %-ot) a vastagbélrák-hajlam vonatkozásában valószínűleg előnytelen konstellációt jelent. Ez a mutáns allél instabilitáshoz vezet, mely a sejtoszlás során újabb mutációk kialakulásának kedvez.
A népegészségügy(i genetika) specifikus szempontrendszere és feladatai
A genetikai eredmények népegészségügyi hasznosíthatóságának megítélése sajátos megközelítést igényel. Alapvető kérdések megválaszolása szükséges pusztán ahhoz is, hogy az egyes genetikai eredmények népegészségügyi relevanciájáról felelős állásfoglalás születhessen, s még inkább ahhoz, hogy népegészségügyi intervenciók szintjén a genetikai információk hasznosításra kerüljenek.
Ezek az alapvető kérdések a népegészségügyi vizsgálati (első szinten feltétlenül az epidemiológiai) módszertan célzott alkalmazásával válaszolhatók meg.
1. A fő feladat annak becslése, hogy a kérdéses (felfedezett) génvariáns populációs szinten milyen mértékben befolyásolhatja az egészségi állapotot. Erre a kérdésre nincs általános válasz, hisz az egyes etnikai, geográfiai, kulturális, illetve egyéb szempontok szerint elkülönülő, illetve elkülöníthető közösségek esetében nemcsak egy major gén vagy hajlamosító polimorfizmus prevalenciája változhat igen széles határok között, de azok tényleges penetrancája is, amennyiben kifejeződésük széles értelemben vett környezeti hatások (például táplálkozási szokások, egyéb életmódtényezők, kulturális hagyományok, lehetséges környezeti expozíciók stb.) függvénye is. Ezért alapvető népegészségügyi feladat egy adott közösség (ország lakossága, etnikai csoportjai) esetében a kérdéses allél, illetve genotípus frekvenciájának megállapítása, s a genotípus-fenotípus-betegség asszociáció mértékének tisztázása. Utóbbi kérdés megválaszolása lényegében annak becslését jelenti, hogy milyen mértékű megbetegedésrizikó társítható egy adott allélhoz a kérdéses közösség esetében.
2. Kritikus feladat annak tisztázása, hogy az adott génhiba, illetve variáns kimutatására rendelkezésre álló teszt népegészségügyi vizsgálatokban (például szűrővizsgálatokban) hasznosítható-e. E problémakör vizsgálata messze túlmutat a laboratóriumi minőségbiztosítás szintjén általában megfogalmazott kérdéseken: azaz nem elégséges a módszer megfelelő szintű specifitásának, validitásának, szenzitivitásának, reprodukálhatóságának bizonyítása, de meggyőzően igazolni kell azt is, hogy a vizsgálatba vonandó egyének számára könnyen elfogadható, s nem utolsósorban azt, hogy az alkalmazandó módszerek financiális vonzata esetenként tömeges vizsgálatok kapcsán is kezelhető. Napjainkban, amikor szinte naponta új betegség-gén variánsok kerülnek felfedezésre, a média és következményesen a közvélemény érdeklődése is felfokozott, s a diagnosztikus (illetve annak szánt) tesztek kifejlesztése és marketingje is rendkívüli intenzitású, ennek a feladatnak a teljesítése távolról sem tekinthető egyszerűnek.
3. Ha a fenti kérdésekre kapott válaszok a hasznosítás lehetőségét felvetik is, a népegészségügyi tevékenység, illetve szűrővizsgálatok sajátos szempontrendszere alapján további kérdések vetődnek fel. Ezek közül kettő kiemelésre érdemes: a.) Van-e igazolható egészségnyereség a vizsgálatok elvégzésének köszönhetően? Ez a szűrővizsgálatok etikai megközelítése szempontjából közel azonos azzal a kérdéssel - melyre az igenlő válasz alapvető elvárás -, hogy a veszélyeztetettség kimutatása esetén van-e lehetőség preventív intézkedésre. b.) A vizsgálatok költséghatékonysági mutatói alapján milyen szintű kiterjesztés engedhető meg, illetve milyen szűrővizsgálati protokoll alkalmazása lehetséges. Egy-egy szűrővizsgálat költséghatékonyságát számos tényező befolyásolja, melyek közül a vizsgálatba vonás kritériumrendszere döntő jelentőségű.
4. A népegészségügyi tevékenység és szolgáltatások rendszerében a kommunikáció alapvető funkció. A kommunikáció komplex rendszerében kiemelten fontos, az egészségpolitikai döntéshozók (köztük a népegészségügyi ellátás finanszírozóinak) tájékoztatása és meggyőzése mellett a vizsgálatok potenciális érintettjeinek meggyőzése. Az egyén önrendelkezési jogának tiszteletben tartása szükségessé teszi azon közvélemény-kutatási adatok mérlegelését, melyek azt mutatják, hogy a lakosság jelentős hányada nem óhajtja tudni, hogy esetében fennáll-e bármiféle genetikai veszélyeztetettség. A Time/CNN által 1994-ben elvégzett közvélemény-kutatás eredményei szerint a megkérdezettek 49 %-a nem, míg 50 %-a kíváncsi lenne arra, hogy élete során valószínűleg milyen betegségben szenved majd. Nem zárható ki annak lehetősége, hogy ezen általános kérdés megválaszolása során a nemleges válaszok magas száma mögött az is meghúzódik, hogy nem kaptak arról tájékoztatást, hogy a veszélyeztetettség kimutatása után van-e lehetőség bármiféle védekezésre a betegség kialakulásának megakadályozásához. Ezt a feltételezést valószínűsíti, hogy egy, az emlőrák veszélyeztetettség kimutatására szervezett program résztvevőinek nagy része - annak tudatában, hogy lehetőség van hatékony gondozásra és kezelésre - kérte a vizsgálat eredményének közlését. Személyes tapasztalatként említhető, hogy a magyar populáció kardiovaszkuláris betegségekkel szembeni rizikóstátusának felmérése, a Háziorvosi Morbiditási Adatgyűjtési Programhoz kapcsoltan (Széles et al., 2003) indított genetikai epidemiológiai vizsgálatunk során gyakorlatilag minden résztvevő kérte az eredmények közlését, interpretálását és a betegség kialakulásának gátlását vagy késleltetését (megelőzését) célzó életvezetési tanácsokat.
5. Kritikus, a népegészségügyi gyakorlatban is hangsúlyos kérdés, hogy kellő mértékben megvalósítható-e az érintett egyén, illetve közösségek jogi védelme a stigmatizációval és a diszkriminációval szemben. Ez nem pusztán a személyes adatok védelmét jelenti, de olyan törvénykezési gyakorlatot, amely az érintettek előnytelen megkülönböztetését minden vonatkozásban (a foglalkoztatás és egészségbiztosítás területén hangsúlyozottan) hatékonyan gátolja.
A genetikai eredmények hasznosításának jelenlegi helyzete a daganatos betegségek prevenciója területén
A daganatos betegségek genetikai meghatározottságával, azok kimutatásával és kezelésével kapcsolatos ismeretek - nagy biztonsággal jósolhatóan - már a közeljövőben lényegesen gazdagodni fognak. Jelen helyzetben, fenti népegészségügyi megfontolások alapján érthetően, az ismeretek népegészségügyi hasznosításának lehetőségei korlátozottak. Az ismeretek hasznosításának korlátai közül érdemes kiemelni, hogy
1. a népegészségügyi hasznosításhoz elengedhetetlen genetikai epidemiológiai tanulmányok a potenciálisan érintett közösségek csak igen szűk körében kerültek elvégzésre,
2. a rendelkezésre álló tesztmódszerek evaluálása népegészségügyi hasznosíthatóság szempontjából nem, vagy alig történt meg,
3. a jelenleg alkalmazott módszerek jellemzően költségigényesek (diagnosztikum és instrumentalizáció vonatkozásában egyaránt), emellett nem igazán kedvezőek költség-haszon és költség-hatékonysági mutatóik sem (azaz drágán, viszonylag csekély információhoz jutunk),
4. az azonosítható veszélyeztetettségi állapotok csak igen szűk körében van lehetőség érdemi preventív intézkedésekre, s esetenként ezek elfogadhatósága az egyén szempontjából kérdéses (lásd prevenciós célzatú mastectomia, oophorectomia, colectomia),
5. a genetikai alapú szűrővizsgálatokhoz illetve azok céljainak és eredményeinek kommunikálásához a népegészségügy területén a humán erőforrás nem biztosított,
6. hiányzik, illetve korlátozott a szabályozottságot biztosító törvényi háttér.
Fentiek értemében nem meglepő, hogy genetikai alapú populációs szintű szűrővizsgálatokra csak sporadikus példák említhetők. Az emlőrákkal szembeni veszélyeztetettség kimutatására askenázi zsidó közösségek esetében működnek szűrőprogramok. Erre - többek között - az ad lehetőséget, hogy a populációban a hibás gén mutációinak jelentős része a BRCA1/2 gének lehetséges mutációi közül három mutáció valamelyike (azaz módszertanilag jól fogható) és ezek előfordulási gyakorisága említetten magas. E három mutációra végzett populációs alapú szűrés költséghatékonyságát vizsgálva csekély a valószínűsége annak, hogy ez a szűrési módszer alacsonyabb prevalenciával jellemezhető közösségekre kiterjesztésre kerül. Bár a túlélési elemzés szignifikáns esélynövekedést igazol, egy megmentett életév költsége - a protokoll függvényében - meghaladhatja a 130 ezer US dollárt is. További korlát az elterjedés tekintetében, hogy a szűrővizsgálati módszer költséghatékonysága csak akkor igazolható, ha pozitív teszteredmény esetén profilaktikus sebészi beavatkozásra kerül sor (Grann et al., 1999). Az e tanulmány kapcsán megjelent reflexió (Knell - Presant, 1999) is rámutat arra, hogy a populációs alapú szűrés költséghatékonysága jellemzően elmarad a csak magas rizikójú egyénekre kiterjesztett szűrővizsgálatok költséghatékonyságától, melyre számos példát találni. A magas rizikójú egyének/családok szűréséhez a feltételek - az ismeretanyag és a módszertan vonatkozásában - hazánkban is adottak (van der Looij et al., 2000).
A vastagbélrákra hajlamosító gének kimutatására a gyakorlatban általában szintén a magas rizikójú egyének/családok esetében kerül sor, s költség-hatékonyság tekintetében is kedvező eredményekről számolnak be (Kievit et al., 2005).
Prevenciós lehetőségek igazoltan genetikailag veszélyeztetett egyének esetében
Sajnálatos, hogy nemcsak a szűrővizsgálatok, de a prevenció lehetőségei is erősen korlátozottak. Igazoltan major rizikó-gén hordozók esetében négy prevenciós megközelítés ismert:
a.) a hagyományos daganatszűrések speciális alkalmazása, ami a szűrővizsgálatok gyakoriságának növelését, a kortartomány kiszélesítését (jellemzően a rendszeres szűrések kezdő időpontjának előrehozását), továbbá nem hagyományos szűrési tesztek bevezetését jelenti. A NIH Cancer Genetics Studies Consortium ajánlására a BRCA1/2 mutáns génhordozók esetében az évenkénti mammográfiás szűrést már huszonöt éves kortól végzik, s kiegészítik kismedencei ultrahang vizsgálattal. Az American Cancer Society ajánlása szerint vastagbélrákra prediszponáló HNPCC gén hordozók esetében a szokásos FOBT-alapú szűrővizsgálatok helyett huszonegy éves kortól évenkénti colonoscopiás vizsgálat alkalmazása indokolt (Smith et al., 2005).
b.) Emlőrákra hajlamosító major génhordozók esetében a profilaktikus sebészeti beavatkozás (bilaterális mastectomia, oophorectomia) elfogadhatósága erősen vitatott, bár a plasztikai sebészet fejlődésével ez a korábban szinte teljesen elutasított eljárás újra lehetőségként konsziderálható (Spear et al., 2005). A vastagbélrákra prediszponáló FAP gén hordozók esetében az American Cancer Society pubertás korban (pozitív teszteredmény után) elvégzendő colectomiát ajánl a veszélyeztetettség extrém mértéke miatt.
c.) Az örökletes daganatos kórképek manifesztációjának megelőzésére a kemoprevenció lehetősége is felmerül. Az emlőrákra hajlamosító major génhordozók esetében a szelektív ösztrogén receptor modulátorok (például tamoxifen) alkalmazását illetően nincs egységes álláspont, nemcsak az eredményességet illetően, de a nemkívánatos mellékhatások jelentőségének megítélésében sem.
d.) Az 1. ábrán bemutatott összefüggés alapján is könnyen indokolható az életmód tényezők befolyásolásával elérhető rizikócsökkentés szükségessége. A zsírszegény diéta, a zöldség- és gyümölcsfogyasztás és a fizikai aktivitás növelése az emlőrák rizikót génhordozók esetében is csökkenteni látszik. A dohányzás tiltása emlőrákra és vastagbélrákra hajlamos génhordozók esetében, a dohányzás jelentős rizikónövelő szerepe miatt, különösen indokolt (Hou et al., 2005).
A daganatos betegségek megelőzésében a genetikai alapú kockázatbecslés jelentősége ma sem lebecsülendő, bár korlátai könnyen beláthatók. A biotechnológia, bioinformatika és a diagnosztika fejlődésétől e területen is egyértelmű fejlődés, sőt bizonyos vonatkozásban áttörés várható. A microarray technika rohamos fejlődésének köszönhetően ma már kereskedelmi forgalomban vannak azok a chipek, melyek használatával számos daganattípus (például emlőrák, prosztatarák) vonatkozásában az egyéni fogékonyság tesztelhető, de nem kell sokat várnunk azokra a chipekre, melyek komplex daganat-rizikóbecslést tesznek lehetővé, nemcsak a major génekre, de a hajlamosító polimorfizmusokra is kiterjesztve a szűrést. Megjelentek az elemző programok előfutárai (Antoniou et al., 2004) is, jelezve e területen a fejlődés irányát. A modern diagnosztika és bioinformatika eredményeinek konstruktív fogadása és alkalmazása az elkövetkező évtized(ek)ben a modern népegészségügyi tevékenység iránt elkötelezett szakemberek számára is óriási kihívást fog jelenteni.
Kulcsszavak: daganatos betegségek, genetikai fogékonyság, népegészségügy, szűrővizsgálatok

1. ábra * Genetikai és környezeti tényezők kölcsönhatása a daganatos betegségek
keletkezése során (a területek átfedése additív vagy multiplikatív hatást
reprezentál)
IRODALOM
Antoniou, Antonis C. - Pharoah, P. P. D. - Smith, P. et al., (2004): The BOADICEA Model of Genetic Susceptibility to Breast and Ovarian Cancer. British Journal of Cancer. 91, 1580-1590.
Burt, Randall W. - Petersen, Gloria M. (1996): Familial Colorectal Cancer: Diagnosis and Management. In: Young Graeme P. - Rozen, P. - Levin, B. (eds.): Prevention and Early Detection of Colorectal Cancer. Saunders, London, 171-194.
Debniak, Tadeusz - Scott, R. J. - Huzarski, T. et al. (2005): CDKN2A Common Variants and Their Association with Melanoma Risk: A Population-Based Study. Cancer Research. 65, 835-839.
Fishel, Richard - Lescoe, M. K. - Rao, M. R. et al. (1993): The Human Mutator Gene Homolog MSH2 and Its Association with Hereditary Nonpolyposis Colon Cancer. Cell. 75, 1027-1038.
Grann, Victor R. - Whang, W. - Jacobson, J. S. et al. (1999): Benefits and Costs of Screening Ashkenazi Jewish Women for BRCA1 and BRCA2. Journal of Clinical Oncology. 17, 494.
Hou, Lifang - Chatterjee, N. - Huang, W. Y. et al. (2005): CYP1A1 Val462 and NQO1 Ser187 Polymorphisms, Cigarette Use, and Risk for Colorectal Adenoma. Carcinogenesis. [Epub Ahead of Print]
Juengst, Eric T. (1995): “Prevention" and the Goals of Genetic Medicine. Human Gene Therapy. 6, 1595-1605.
Kievit, Wietske - De Bruin, J. H. - Adang, E. M. et al. (2005): Cost Effectiveness of a New Strategy to Identify HNPCC Patients. Gut. 54, 97-102.
Knell, Ellen R. - Presant, Cary A. (1999): Re-Evaluation of Benefits of BRCA1/2 Testing. Journal of Clinical Oncology. 17, 1962.
Simard, Jacques - Dumont, M. - Soucy, P. et al. (2002): Perspective: Prostate Cancer Susceptibility Genes. Endocrinology, 143, 2029-2040.
Smith, Robert A. - Cokkinides, V. - Eyre, H. J. (2005): American Cancer Society Guidelines for the Early Detection of Cancer, 2005. CA Cancer Journal for Clinicians, 55, 31-44.
Spear, Scott L. - Carter, M. E. - Schwarz, K. (2005): Prophylactic Mastectomy: Indications, Options, and Reconstructive Alternatives. Plastic and Reconstructive Surgery. 115, 891-909.
Széles György - Vokó Z. - Jenei T. et al. (2003): Háziorvosi morbiditási adatgyűjtés program kidolgozása, elindítása és működtetése Magyarországon. A magasvérnyomás, cukorbetegség és májzsugor prevalenciája. Orvosi Hetilap. 144, 1521-1529.
Van Der Looij, Marco - Szabo C. (Cs.) - Besznyak I. et al. (2000): Prevalence of Founder BRCA1 and BRCA2 Mutations among Breast and Ovarian Cancer Patients in Hungary. International Journal of Cancer. 86, 737-740.
Vasen, Hans F. - Wijnen, J. T. - Menko, F. H. et al.(1996): Cancer Risk in Families with Hereditary Nonpolyposis Colorectal Cancer Diagnosed by Mutation Analysis. Gastroenterology. 110, 1020-1027.