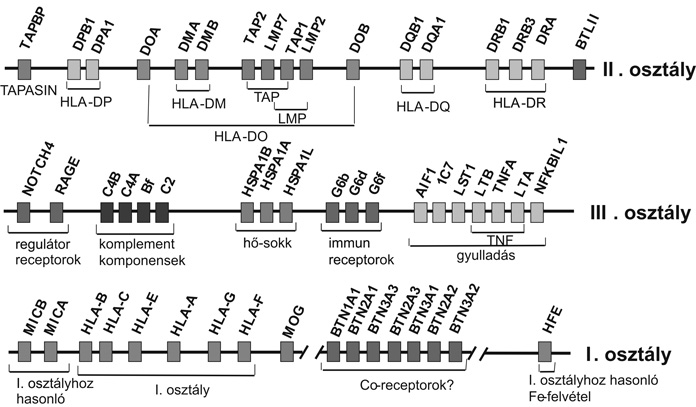
1. ábra * Az emberi fő hisztokompatibilitási rendszer (HLA) három "osztály-régiója" a 6. kromoszóma rövid karján (J. Trowsdale, BCI, Budapest, 2004)
A fajok a környezet káros hatásaival szembeni alkalmazkodó képességét és a védekezési mechanizmusok generációkon keresztüli fennmaradását a filogenezis során kialakult két komplex genetikai rendszer biztosítja. Az egyik szerepe az egyedek azon tulajdonsága, hogy a szervezetükbe került idegen károsító anyagokat, fehérjéket - bármilyen molekuláris szerkezettel rendelkezzenek - felismerik, és különböző immunológiai mechanizmusaik segítségével közömbösítik. E tulajdonság hátterét olyan genetikai mechanizmus biztosítja, mely a rendelkezésre álló genetikai elemek felhasználásával (variábilis és konstans szakasz gének) és a génátrendeződés mechanizmusával képes felépíteni azt a fehérjeszerkezetet, mely az idegen anyaggal kapcsolatba lép, és azt közömbösíti (immunglobulinok, T- és B-sejt receptorok). Így az immunrendszer a szervezetbe jutó károsító molekula/fehérje legtöbb variációjával szemben képes olyan immunglobulin- ill. T- és B-sejt receptor-struktúrákat kialakítani, méghozzá igen rövid idő alatt, melyek lehetővé teszik a védekezési reakciók beindulását és hatékony működését.
A másik mechanizmus az előbbit segíti azáltal, hogy a környezet változó új elemeit képes a saját, egyedi molekuláris jellegzetességeitől megkülönböztetni, idegennek felismerni, és azt az immunrendszer különböző receptorai számára elemeire (peptidek) bontva prezentálni. Ennek a rendszernek a populációs szintű diverzitását, vagyis azt a tulajdonságát, hogy a legkülönbözőbb struktúrákkal szembeni receptorral rendelkező egyed legyen a populációban, a gének nagy polimorfizmusa, sokszínűsége biztosítja. Az előbbi rendszerrel szembeni alapvető eltérése az, hogy e polimorfizmust az utódok számára kombinációk formájában átörökíti, mely lehetővé teszi újabb variációk kialakulását. Ez a genetikai rendszer az élőlények egyik legkomplexebb génállománya, mely a fő hisztokompatibilitási komplex (Major Histocompatibility Complex - MHC) elnevezést kapta. Ez a komplex génállomány magában foglal számos más, az immunológiai működéshez szükséges géneket is. Jelentősége elsősorban a fajok és fajták változó környezethez való alkalmazkodásában rejlik. Ennek érdekében a génkomplex a már korábbiakban kialakult és az újonnan kiépített felismerő struktúrák utódokba történő átörökítését biztosítja.
Összefoglaló munkánkban a hisztokompatibilitási rendszer kialakulását, funkcióját és működésének molekuláris hátterét ismertetjük, felhasználva a BCI kongresszus (Basic and Clinical Immunogenomics, Budapest, 2004.) MHC szimpozium előadásainak anyagát. Központi szerepet tulajdonítunk a "saját" és "idegen" felismerésnek és annak, hogy ez a funkció hogyan kapcsolódik össze a génkomplexben elhelyezkedő más immunológiai faktorokat meghatározó gének működésével. Külön kiemeljük, milyen molekuláris jellegzetességek játszanak szerepet a transzplantációs immunitásban, a betegségekkel és fertőzésekkel szembeni fogékonyság vagy rezisztencia kialakításában.
A hisztokompatibilitási rendszer felfedezése
A hisztokompatibilitási rendszer (MHC) és az ezzel kapcsolatos transzplantációs immunitás felismerése több évtizedet vett igénybe a múlt század közepén. A törvényszerűségek feltárása több, igen kiváló szaktekintély nevéhez fűződik, akik közül elsőként George Schnell nevét kell megemlítenünk. Az 1940-es években végzett kísérleteiben egérdaganatok különböző egyedekbe történő átoltása során egyaránt észlelte a daganat növekedését (megtűrést) és a daganat elpusztulását (kilökődését). E jelenség tanulmányozása céljából beltenyésztett egértörzseket hozott létre, melyek minden egyede az egypetéjű ikrekhez hasonlóan azonos volt, de különböztek egy más típusú beltenyésztett törzs egyedeitől. Az azonosságot vagy különbséget a "bőrtranszplantációs teszttel" lehetett meghatározni (megtapadás vagy kilökődés). Különböző törzsek között végzett bőrtranszplantációs tesztek segítségével felismerte, hogy az egyik törzstől származó transzplantátum egy másik törzshöz tartozó recipiensre történő átültetését követően a kilökődést vagy megtapadást a sejtekre jellemző, genetikailag meghatározott különbségek vagy azonosságok határozzák meg. George Schnell nevezte el ezeket a jellemző sejtfelszíni fehérjéket "hisztokompatibilitási antigéneknek", és az azokat meghatározó genetikai rendszert "fő hisztokompatibilitási komplexnek". A múlt század ötvenes éveiben Jean Dausset az emberben is felfedezte ezt a rendszert, melyet HLA-rendszernek nevezett el (Human Leukocyte Antigen). Később Baruj Benacerraff csatlakozott hozzájuk az immunreaktivitás gének és az immungenetika alaptörvényének leírásával, mely szerint a kilökődési reakció erősségét a donor és recipiens közötti hisztoinkompatibilitás mértéke határozza meg. Felfedezéseikért 1960-ban mindhárman Nobel-díjat kaptak. Ugyanezen időszak alatt egy másik alapjelenséget, a "transzplantációs toleranciát" ismerte fel az ugyancsak Nobel-díjban részesült Frank Macfarlane Burnet és Peter Medawar. Velük egyenrangú kutató volt a témában Ray Owens és Milan Haek. Különböző kísérleti rendszerekben (egerekben és madarakban) valamennyien megállapították, hogy ha embrionális vagy újszülött korban az egyedeket egy másik hisztoinkompatibilis egyed sejtjeivel intravénásan oltják, életük folyamán nem lökik ki, vagyis tolerálják az "idegen donor" egyedtől származó bőrtranszplantátumot. A toleráns egyedek az idegen sejtekkel, szövetekkel együtt létezve ún. kiméraállapotot hoznak létre. A kiméra az ógörög mitológiában szereplő élőlény, mely három faj jellegzetességeit viselte egyetlen egyeden, például kecsketest, oroszlánfej és kígyó-, illetve sárkányfarok. Mindezen tapasztalatok talaján fogalmazódott meg a "saját" és "idegen" struktúrák felismerésének tulajdonsága, mely az egyedek hisztokompatibilitási antigénjeinek azonosságán vagy különbségén alapul. A saját hisztokompatibilitási fehérjéket (antigéneket) az egyedek az embrionális kor végén, születés előtt a thymusban (csecsemőmirigyben) az immunsejtek (T-limfociták) fejlődése és érése során "tanulják" meg.
Az MHC szerkezete és elhelyezkedése a humán genomban
Az emberi HLA-rendszert csak vázlatosan ismertetjük, kiemelve azon géncsoportokat, melyek az egyediség meghatározásával és az immunfunkciókkal állnak összefüggésben.
A humán MHC a 6. kromoszóma rövid karján mintegy 4000 kilóbázis területet foglal el. Három régióban csoportosulnak a különböző lókuszok, melyek legjellemzőbb génjei a polimorfizmusokat viselő I. és II. osztályú hisztokompatibilitási molekulákat kódolják. Az I. osztályú kétláncú és doménszerkezetet mutató fehérjéket a HLA-A, -B, -C, -G, -E stb. lókuszok determinálják. A polimorfizmust képviselő aminosav-pozíciók elsősorban a
-B, -C és -A lókuszok által meghatározott molekulák á1 doménjét alkotó fehérjeláncban találhatók, melyek az ún. peptidcsapdát képezik. A II. osztályú, a HLA-DR, -DQ, -DP, -DO lókuszok által meghatározott kettős láncú (alfa, béta) molekulák kisebb mértékű polimorfizmusát külön gének kódolják (HLA-DRA, -DRB, -DQA, -DQB stb.). A különálló láncok a sejtmembránban rekombinálódhatnak, melynek eredményeként, ha az anyai és apai lókuszok által meghatározott különböző allotípusok lehetséges kapcsolódásait figyelembe vesszük, a fenotípusos sajátságok (egyedi jellegek) igen nagy variációs lehetőségét ismerhetjük fel (1. ábra).
A II. osztályú régióban találhatók még a peptidprezentációban alapvető szerepet játszó TAP és LMP, valamint DMA és DMO gének. Tekintettel arra, hogy az endogén és exogén peptidek immunsejtek különböző receptorai számára történő prezentálása az immunológiai folyamatok és "saját/idegen" felismerés alapját képezik, egy kis kitérővel szükséges e folyamat molekuláris jellemzőit bemutatni. Az endogén fehérjék (vírus, daganat, saját anyag stb.) proteoszomákba juttatását hősokkfehérjék (HSP család) is elősegítik. A feltördelt peptideket a TAP transzmembrán komplexek juttatják be az endoplazmás retikulumba. Ide kerül a szintetizált I. osztályú HLA-fehérjék nehézlánca is a megfelelő "gardedam" vagy "kísérő" molekulák által védve (calnexin, calretikulin, tapasin). A HLA-molekulák a könnyű lánccal (b2 mikroglobulinnal) való kapcsolódást követően ragadják meg és szállítják a sejtfelszínre a legjobban illeszkedő peptideket, ahol prezentálják a megfelelő sejtreceptorok számára. A II. osztályú molekulák exogén peptidek megragadására és prezentálására elkötelezettek, melyekkel a cytoplazmában az endoszomás vezikulumokban találkoznak. Az endoplazmás retikulumban szintetizált HLA alfa és béta egyesült láncokat vándorlásuk közben "invariánsnak" nevezett molekula (CD74) védi. A lizosomális enzimek által felbontott exogén fehérjékből (baktérium, gomba, parazita, idegen szövet/sejt, allergén stb.) származó peptidek a vezikulumokban újabb "segéd" molekulák révén (HLA DM, CLIP) "csapdájukba" ragadják a megfelelő peptideket, és a sejtfelszínre szállítva prezentálják a megfelelő sejteknek. E folyamat vázlatos ismertetése azért volt fontos, hogy az ősi "paralog" és "ortholog" elemekből megértsük a komplexitás kialakulását, valamint a polimorfizmus és a peptidcsapda szerepét a "saját/idegen" felismerésben, a fertőzésekkel, ill. egyes betegségekkel szembeni fogékonyságban vagy rezisztenciában (2. ábra).
Az MHC kialakulása a fajfejlődés során
A fajfejlődés kezdeti időszakában, 700-800 millió évvel ezelőtt, a gerinctelenek primitív fajainál a védelmet az "ősi természetes immunitás" képviselte a környezet károsító behatásaival szemben. Ez a rendszer a kezdetleges felismerő receptorok és oxido-redukciós, enzimatikus és sejtes effektor mechanizmusok révén rendkívül hatásos és gyors védelmet biztosított. Mindezek ellenére a rendszer a saját és a nem saját felismerésre nem volt képes, amire ez idő tájt talán még nem is volt szükség. Az immunrendszer és az abban közreműködő faktorok fejlődését a patogén élőlények és faktorok megjelenése és hatása irányította, melynek eredményeként többszörös genetikai "robbanás" indította el az "adaptív immunitás" kifejlődését. Mielőtt az MHC gének összerendeződésének legfontosabb lépéseit áttekintenénk, érdemes megismerni a "faji idegenség" felismerésének (allorecognition) egyik első példáját. A ma is élő ősi protochordata fajok egyes egyedei, melyek a gerincesek kifejlődésének kulcsszereplői voltak, több száz azonos méretű modulból épülnek fel (zooidok), melyek csillagformába rendeződve zselatinszerű masszába ágyazódva helyezkednek el. Ezek a zooidok kolóniákba rendeződnek, melyeket "érhálózat" köt össze a széli részeken, "ampullákat" képezve. A kolóniák a széleken expanzionálisan növekszenek. Ha különböző kolóniák érintkezésbe lépnek egymással, kétféle reakció figyelhető meg. Az egyik esetben összeolvadnak, primitív vaszkuláris parabiózist létesítenek, kiméra állapotot hoznak létre; a másik esetben a kezdeti fúziót kilökődés és gyulladásos folyamatok lezajlása követi. A kétféle jelenség hátterében az ősi "idegenfelismerő" rendszer működése áll, mely a következőképpen vázolható.
A különböző folyamatokat a két találkozó kolónia eltérő vagy azonos egyedi tulajdonságai és a kezdetleges "saját" és "nem saját" felismerés határozza meg. A "fajtaidegenség" felismerését (allorecognition) egy ezekben a primitív fajokban kialakult szimpla, de nagyon polimorf lókusz haplotípusának sejteken való kifejeződése teszi lehetővé. A felelős gént "hisztokompatibilitási/fúzióbilitási lókusznak (Fu/HC) nevezik, mely ko-domináns alléleket reprezentál. Genetikailag a következő lehetőségek eredményezik az "idegen" felismerés immunológiai effektor mechanizmusait, melyek három hierarchikus szinten valósulhatnak meg.
* Az első szinten a teljes genetikai azonosság az érintkező kolóniák között fúziót, a különbség kilökődést eredményez.
* A második szinten a "kimérás felszívódás" jelensége akkor jön létre, ha a két kolónia hisztokompatibilis, de genetikailag egymástól eltérő. Ebben az esetben először egy fúzió jön létre, majd a kiméra állapotban a genotípusosan eltérő zooidok masszív fagocitózis áldozatai lesznek. Ezt a jelenséget a fentiekben említett Fu/HC és Re/HC lókuszok determinálják. A jelenség, mely a homozigóták heterozigóták általi eliminálását jelenti, rendkívül hasonlít a gerincesek Hh-1 génjének "hibrid rezisztencia" funkciójához.
* A harmadik szinten az "allofelismerés" szomatikus és germinális sejtparazitizmus jelenséget hozzák létre. Ebben az esetben az akár már morfológiailag eltüntetett, genetikailag alacsonyabb rendű kolónia a "nyertes" partnerben élősködés jellegű funkcióval fenn tudja magát tartani.
Az előbbiekben már ismertettük, hogy az MHC három komplex genetikai régiója különböző funkcionális tulajdonságért felelős gének együttese, melyek összerendeződését az utóbbi idők komparatív genomikai és proteomikai kutatásai tárták fel. Az alapvető molekuláris "spontán rendeződés" a gerinchúros élőlények fejlődése során lehetővé tette az új fehérjék kialakulását. Az MHC párhuzamosan fejlődött az adaptív immunitás genetikai hátterével, mely az állkapoccsal rendelkező gerincesek megjelenéséhez kapcsolódott, és különböző, már a primitív fajokban működő géncsoportok "ko-optálását" jelentette génáthelyeződés és génduplikációk révén. Ezek közül az alábbi jellegzetes géncsoportok emelhetők ki (3. ábra).
A peptidprezentálás kialakulásában alapvető volt az ősi proteosoma gének proteolitikus aktivitásának és így az immunproteosomáknak a létrejötte. Az ide tartozó PSMB géncsaládok a ko-optálás és duplikációk eredményeként egyrészt megtartották ősi fehérjedegradációs működésüket, ugyanakkor új működésként képessé váltak peptidek előállítására az MHC-prezentációhoz. Egy másik fontos géncsoport az MHC I. molekulák számára a peptidcsoportok rendeződéséért és szállításáért felelős. Az ősi ABC transzporter fehérjék (adenozintrifoszfát-kötő kazetták) családjának génjei duplikációval rendeződtek az emlősökben végső formában megjelenő TAP1 és TAP2 lókuszokba. Az I. osztályhoz tartozó hisztokompatibilitási molekulák endoplazmás retikulumon belüli transzportja, peptidekkel való feltöltése, a molekula térbeli szerkezetének kialakítása több "kísérő" és "házvezetői" működést ellátó fehérje együttműködését igényli, mint például a hősokkproteinek, valamint a calnexin és calretikulin család tagjai. Ezek a gének ortholog funkciót ellátó igen általános gének áthelyeződésével kerültek az MHC komplexbe. A már eukariotákban is működő gének feleltek azokért a létfontosságú funkciókért, melyek általánosan jelen voltak a sejtmaggal, Golgi apparátussal, endoplazmás retikulummal és különböző sejtorganellumokkal rendelkező élő egységekben.
Külön szükséges megemlíteni azokat a molekulákat kódoló géneket, melyek szerkezete az immunglobulin modul elemeit foglalja magában (IgC1 domain). Ezek legfontosabb reprezentánsai az MHC I. és II. osztályhoz tartozó molekulák, melyek az ősi tapasin és a butyrophylin család tagjai. A filogenezis során ezek a gének az immunglobulin gének fejlődésével párhuzamosan az állkapoccsal rendelkező gerincesekben jelentek meg, de más törzsekben nem fordulnak elő. A II. osztályú fehérjék - tekintettel arra, hogy a citoplazma vezikulumaiban töltődnek fel az exogén peptidekkel - különálló "kísérő" és "védő" molekulák közreműködését igénylik. Ezek klasszikus tagjai a CD74 transzmembrán protein (invariáns lánc) és a HLA-DM, -DO molekulák. Az előbbi csak a csontos gerincesekben jelent meg, míg a HLA-DM valószínűleg a gerincesek fejlődése során a proto-MHC régióból a génduplikációk eredményeként rögződött a komplexhez.
A közelmúltban sikerült bizonyítékokat találnia arra, hogy általánosságban az MHC-be rendeződött gének egy része a duplikációk után került "ko-optálásra". A duplikációk azonos időszakaszban (528-766 millió évvel ezelőtt) következhettek be, ami arra utal, hogy a gerincesek "paralog" régiói polyploidok voltak. Feltételezhető, hogy az állkapcsos gerincesek kialakulását megelőzően széles lépcsőzetekben (block) történtek a duplikációk, melyek az MHC paralog területeit is érintették. A proto-MHC régiók megfelelnek az emlősökben a mai I. és III. osztályú géneknek. Az I. osztályú gének csoportja az emlősök kifejlődése során transzlokálódott e régióba az ősi lokalizáció helyéről új génterületet kolonizálva, mely nem következett be más állkapcsos gerinces törzsekben. Végül szükséges kiemelni, hogy a III. osztály régióiba lokalizálódtak azok a gének, amelyek a természetes és az adaptív immunitásban egyaránt szerepet játszanak, mint például a C3/C4/C5, a TNF szupercsalád és a Toll receptor génjei (4. ábra).
"Saját és nem saját" megkülönböztetés és a transzplantáció
Bár a szerv- és szövettranszplantáció "természetellenes" orvosi beavatkozás, mégis magában foglalja azokat a jelenségeket és törvényszerűségeket, melyek a fajfejlődés során alakultak ki azzal a céllal, hogy a szervezetbe jutó idegen, károsító élő anyagokkal szemben védelmet nyújtsanak, vagyis azokat semlegesítsék, kilökjék. A transzplantációs immunológia kutatásainak eredményeként és a klinikai tapasztalatok alapján tudjuk, hogy a befogadás vagy kilökődés a donor és recipiens hisztokompatibilitási antigénjeinek (HLA fenotípus) egyezésétől vagy különbözőségétől függ, melyet a recipiens "immunreaktivitás" génjeinek funkciója is befolyásol. A klinikai gyakorlatban számos módszerrel rendelkezünk, melyek alkalmasak a HLA allotípusok laboratóriumi meghatározására, de akár szerológiai, DNS-szintű vagy sejtközvetített in vitro vizsgálatot végzünk, mindig fennmarad a kérdés, vajon megfelelő-e a módszerünk a donor és recipiens közötti "idegenség" megítélésére. Ennek a teoretikusnak látszó, bár funkcionális szempontból alapvető kérdésnek azonban több klinikai megfigyelés is alapját képezi. Ezek közül csak egy-kettőt szeretnénk kiemelni, mely arra világít rá, hogy a "klasszikusnak" ítélhető tipizáló módszerekkel meghatározott "hisztoinkompatibilitás" az immunbiológiai reaktivitás mértékét az "idegenséggel" szemben nem egyértelműen tükrözi.
Klinikai megfigyelés, hogy még a "teljesen HLA-azonos" (full house compatible) nem rokon donor vese is kilökődhet bizonyos esetekben. Ennek az ellenkezője is előfordulhat, hogy a recipienstől valamennyi meghatározható alloantigénben különböző vese jól funkcionál. Alapvetően fontos Johannes J. van Rood megfigyelése, miszerint a nem öröklött anyai antigénekkel rendelkező transzplantátumot a recipiens jobban tolerálja, mintha az apai nem öröklött antigénekkel rendelkezik. A leideni munkacsoport továbbá azt is kimutatta, hogy egy megfelelő szűrési programmal kimutathatók azok az "idegen alloantigének", melyekkel szemben a hiperszenzitizált recipiensek kilökődési reakciót nem indítanak el. Mindezek alapján indokolt az a kétség, hogy az immunrendszer nem teljesen azonos alapon ismeri fel a "nem saját" jellegzetességeit, mint ahogy azt ma az immungenetika a módszertani repertoárjával meghatározza. E kétségek vezették Rene Duquesnoy kutatót és munkatársait, hogy új megközelítésből próbálják jellemezni a "szöveti idegenség" fogalmát. A rendkívül szellemes eljárást azért mutatjuk be vázlatosan, mert rávilágíthat az immungenomika olyan funkcionális megközelítési lehetőségére, melynek segítségével az idegenfelismerés mechanizmusában jobban megismerhetjük a valós molekuláris genetikai történéseket.
Utalva közleményünk első részében említettekre, hogy az egyedi eltérések a hisztokompatibilitási molekula fehérjeláncának egyes aminosav-pozícióihoz rögzítettek, az ún. matchmaker program azokat az "aminosav tripleteket" tárja fel, melyek a molekula felszínén az ellenanyagok által felismerhető "polimorf epitopokat" képezik. Kiderült: egyes polimorf sajátságok "rejtett" aminosav-pozíciókban nem immunogének, vagyis immunválaszt nem indukálnak, így nem hozzáférhetőek az ellenanyagok vagy antigén-specifikus receptorok számára. Az talán még érdekesebb, hogy az eltérő allotípussal rendelkező egyedek a saját allotípusos variációjuktól függően más-más "polimorf epitopot" ismernek fel az idegen hisztokompatibilitási antigénen. Ennek megítélését szolgáló igen bonyolult matematikai analízis ismertetése helyett táblázatban próbáljuk érzékeltetni, hogy az "ellenanyag" szemszögéből a saját allotípus hátterével valamely egyed milyen "aminosav tripleteket" ismer fel idegen illetve saját "epitópnak" (1. táblázat).
Az új felismerésből arra lehet következtetni, hogy a szerológiai HLA-tipizálási módszerrel meghatározott allotípusok általánosságban nem mindig tükrözik pontosan az idegen, "nem saját" polimorfizmus immunogenitását. Általánosságban tehát megállapítható, hogy a hisztokompatibilitási molekula meghatározott területein vannak azok a jellemző triplet aminosav-pozíciók, melyek felelősek külön-külön a humorális, sejtközvetített és regulációs immunválasz kiváltásáért. A triplet kódok aktuális immunogenitása függ azonban a donor és recipiens közötti allotípusos, molekuláris szintű eltérésektől, illetve azonosságoktól.
Az immunogenomika korszakában a transzplantációs immunitás témájában talán ez az első olyan felismerés, mely a polimorfizmus molekuláris alapjaira támaszkodva magyarázza az egyes gének funkcionális szerepét. A HLA és betegségek egy másik olyan terület, ahol hasonló molekuláris összefüggések ismerhetők fel az "idegen" és "saját" felismerésben, és ennek alapján a kórokozóval szembeni genetikailag meghatározott rezisztencia vagy érzékenység fennállásában. Ennek bemutatására két, a HLA-allotípusokkal kapcsolatban álló betegség immungenetikai hátterét ismertetjük.
HLA és fertőzések molekuláris genetikai kapcsolata
Az MHC molekuláris polimorfizmuson alapuló működése a "nem-saját", "kóros" felismerésében rámutat arra, hogy az adaptív immunitás kialakulása "patogenetikusan irányított" volt. Az MHC "idegen patogén epitóp" felismerési mechanizmusára a legjellemzőbb példák egy mycobakteriális és egy parazitafertőzés kiváltotta betegségcsoportban találhatók.
A tuberkulózist és leprát egyaránt mycobakteriális fertőzés okozza. Mindkét betegségnek ismeretes egy enyhe és egy súlyos formája. Annak ellenére, hogy a betegség általánosságban a HLA-DR2 allotípussal asszociál, csak kis különbség mutatkozik a betegség két különböző kimenetelű formájának a DR2 allotípussal való kapcsoltságában. Ha azonban az összehasonlítást molekuláris genetikai vizsgálatok alapján végezzük el, szignifikáns összefüggést találunk a HLA molekula polimorf szerkezetével.
Ismert, hogy az MHC polimorfizmusát a peptidkötő helyek nagy variációja, a különféle peptid epitópok megkötésére szolgáló polimorf szakaszok, ún. "zsebek" variabilitása okozza. Az ebben elhelyezkedő aminosavak a rendelkezésre álló peptidek különböző oldalláncainak megkötésére képesek. Ez szabja meg a HLA molekula peptidkötő képességének minőségét és erősségét. Ismert továbbá, hogy az I-es osztályú (HLA-A, -B,
-C) molekulák 8-15 aminosavból álló peptideket képesek megkötni, és T-sejtek felé prezentálni, míg a II-es osztályú (HLA-DR,
-DQ, -DP) molekulák ennél hosszabb (12-25 aminosav) peptidek megragadására is képesek (5. ábra).
Fentiek ismeretében Narinder K. Mehra és munkatársai génszintű vizsgálatot végeztek a mycobakteriális fertőzés okozta tuberkulózis és lepra betegségekben szenvedő betegek két különböző klinikai lefolyású csoportjában. A HLA-DR2 molekula génszintű "szubtipizálása" a DR2 altípusokra különbséget jelzett a "peptidcsapda" 1-es és 4-es "zseb" szerkezetében, és összefüggést mutatott a betegség kétféle típusával. E szerint, ha az 1-es "zseb" 86-os pozíciójában "Valin" aminosav található, mely a HLA-DRB1*1501 szubtípusra jellemző, a betegség súlyos formája várható. Ha azonban ebben a pozícióban a "Glycin" foglal helyet, mely a HLA-DRB1*1502 szubtípusnak felel meg, a betegséggel szembeni rezisztencia tapasztalható. Ez utóbbi esetben azt feltételezik, hogy az 1-es "zseb" nagyobb affinitással köti meg a nagy immunogenitású bakteriális epitópot, mint a DRB1*1501 esetében, és ezért a fertőző ágenssel szembeni Th1 típusú cytokintermelés a meghatározó immunreaktivitás (6. ábra).
A másik példa a populációk migrációjával kapcsolatos, mely együtt járhat a peptidkötő jellegek változásával. A malaria falciparum fertőzés Nyugat-Afrikában, Gambiában a HLA-B*5301 alléllal asszociált, mivel ez a HLA-típus a parazitaellenes erős CTL (Citotoxikus T-limfocita) aktivitás által védelmet nyújt a fertőzéssel szemben. Ez a polimorf sajátság a malárialárva ún. máj-stádiumra specifikus (liver stage specific) antigénjéből eredő konzervatív nonapeptidet képes prezentálni mint "parazita target epitopot", mely immunogenitása következtében megindítja az erős és hatékony immunválaszt.
Ezzel szemben a kelet-afrikai Kenyában a protektív hatás egy másik HLA-alléllel, a DRB1*0101-gyel asszociált. Ez valószínűleg azzal állhat összefüggésben, hogy a két különböző afrikai régióban a parazita CTL epitópja eltérő, vagyis mutált. Ehhez alkalmazkodott ugyanazon népcsoport keletre vándorolt populációja azzal, hogy pár száz év alatt más HLA-kapcsoltság alakult ki a betegséggel szembeni rezisztencia tekintetében. Ez a példa világosan tükrözi a környezeti befolyás szerepét az MHC diverzitás kifejlődésében és változásában. Hasonló környezeti tényezők változtathatták meg a HLA-A2 szubtípusainak megoszlását az indiai és a roma népességben. Ismert, hogy a roma populációk Indiából vándoroltak Kelet-Európába évszázadokkal ezelőtt. A két populáció közös eredetét antropológiai, genetikai tanulmányok, közös kulturális szokások, továbbá egyes jellegzetes HLA és betegségkapcsolatok bizonyítják. A HLA-A2 szubtípus gyakoriságváltozások kialakulása a fentiekhez hasonlóan valószínűleg az Indiában és Kelet-Európában eltérő bakteriális és vírusfertőzésekkel magyarázható (7. ábra).
A folyamatban lévő indiai-magyar kollaboráció egyik fő kutatási témája az immungenetika területén e különbség feltárása, mely a humán funkcionális genomika területén értékes új adatot szolgáltathat. Ezeknek az eredményeknek hasznosulása természetesen a betegségek megelőzésében és a transzplantációs klinikai tevékenységekben fog megnyilvánulni.
Következtetés
A fő hisztokompatibilitási genetikai rendszer kialakulása az élőlények filogenezise során, valamint annak molekuláris szintű működése a fajok egymáshoz és a változó környezethez való alkalmazkodásának egyik legszebb példája . Ennek a tulajdonságnak hátterében álló és a túlélést biztosító genetikai rendszernek a legfőbb tulajdonsága a diverzitás és variációs készség. A sokszínűséget egyrészt az egyedek mindegyikében lévő és a variabilitásért felelős génállomány, valamint annak rekombinációs tulajdonsága, másrészt az újonnan kialakult tulajdonságok, variációk átörökítő képessége okozza. Utóbbiban játszik elsőrendű szerepet az MHC az általa biztosított rendkívüli polimorfizmussal. Ez a polimorfizmus molekulaszerkezethez kötött, mely meghatározza a szervezetben keletkezett és a környezetből származó fehérjék építőelemeivel (peptidekkel) való kapcsolatképzés lehetőségét. A polimorfizmus molekuláris sajátságai szabják meg, hogy az egyedekben megindul-e a károsító fehérjével szembeni immunreakció. Csodálatos, hogy ki tud alakulni, például egy új vírusfehérjével reagálni képes MHC molekula mutációk és rekombinációk segítségével. Ez a sajátság az utódokba átörökítve elősegíti a megváltozott környezetben a faj fennmaradását. A funkcionális immunogenomika egyik legizgalmasabb kutatási területe, hogy napjainkban próbálja nyomon követni ezeket a populációs változásokat, például a HIV-fertőzésekkel vagy daganatokat előidéző új vírusokkal szemben. Ha sikerül feltárni e folyamatokért felelős molekuláris folyamatokat, új lehetőségek nyílnak meg a betegségek megelőzésében és a terápiában is.
Kulcsszavak: immungenetika, polimorfizmus, MHC, HLA, peptidprezentálás, filogenezis, transzplantáció, hisztokompatibilitás, saját-idegen felismerés

1. ábra * Az emberi fő hisztokompatibilitási rendszer (HLA) három
"osztály-régiója" a 6. kromoszóma rövid karján (J. Trowsdale, BCI, Budapest,
2004)
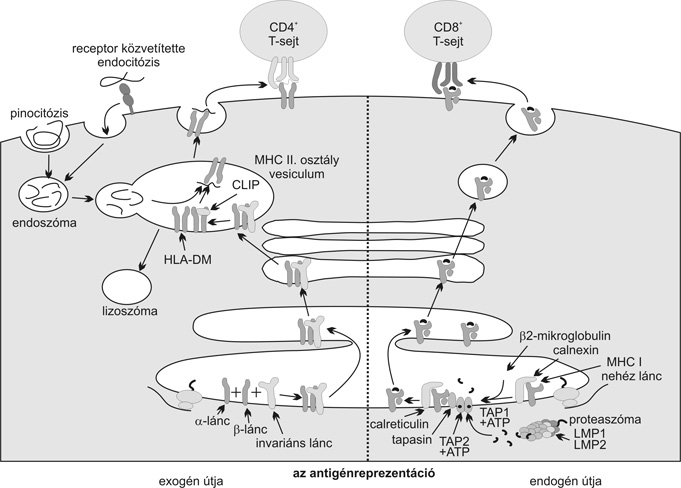
2. ábra *Az I. és II. osztályú hisztokompatibilitási molekulák endogén és
exogén peptidek prezentálási folyamata
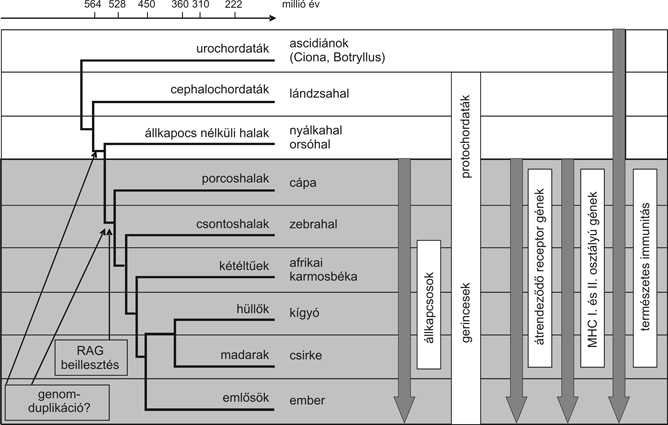
3. ábra * Az adaptív immunitás és az MHC kialakulása a fajfejlődés során
(Kasahara et al.: Trends in Immunology. 2004, 25, 105-111.)
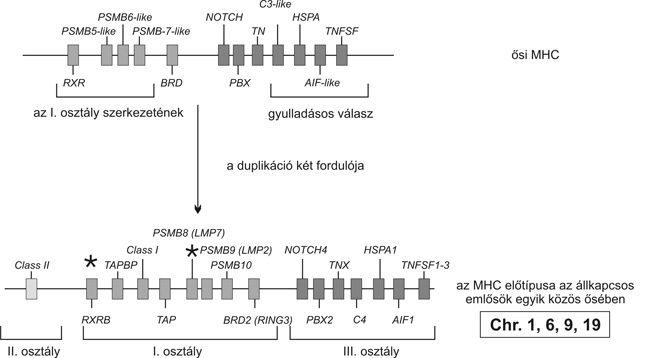
4. ábra * Az MHC "osztály-régióinak" az "ősi proto gének" duplikációival
történő kialakulásan (M. Flajnik, BCI Budapest, 2004)

1. táblázat * HLA-allotípusban eltérő egyedek hisztokompatibilitási
fehérjelánc-pozíciói, melyekben az aminosav-eltérések "idegensége" nem
immunogén, vagyis sajátként elfogadott (Duquesnoy matchmaker concept)
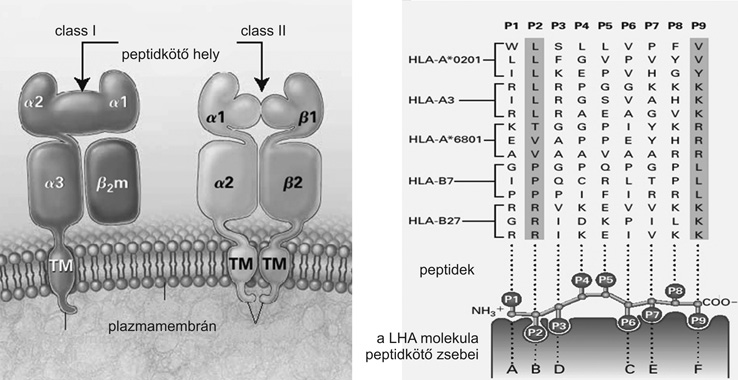
5. ábra * A hisztokompatibilitási molekula és a peptidkötő zsebek szerkezete,
valamint a polimorf pozíciók elhelyezkedése és meghatározó szerepe a peptidek
megragadásában
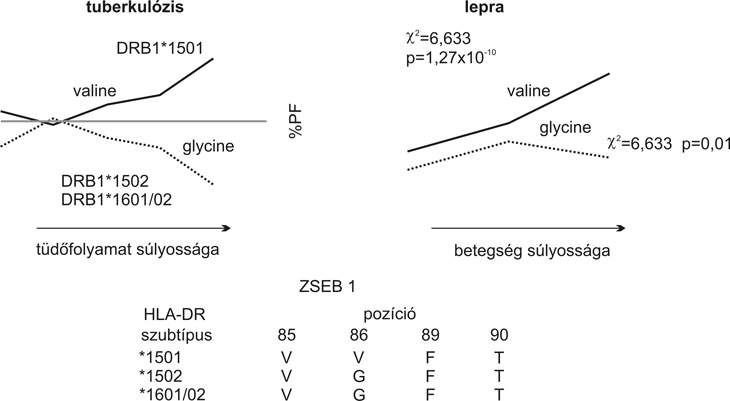
6. ábra * A hisztokompatibilitási antigén polimorf pozíciójának meghatározó
szerepe a tuberkulózis és a lepra betegségek klinikai formáinak létrejöttében
(Balamurugan - Sharma - Mehra, AIIMS New Delhi)
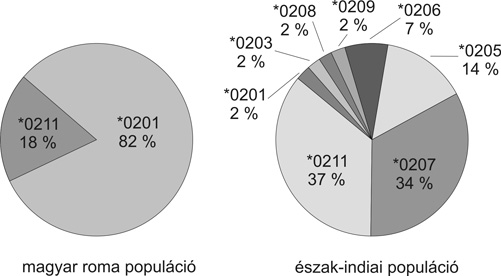
7. ábra * A HLA-A2 allotípusainak egyezése és eltérése a közös eredetű indiai
és roma populációkban (Mehra, N. K., AIIMS New Delhi, Tissue Antigens. 2001,
57, 502-507.)
Irodalom
Balamurugan, Arumugam - Sharma, S. K. - Mehra, N. K. (2004): Human Leukocyte Antigen Class I Supertypes Influence Susceptibility and Severity of Tuberculosis. Journal of Infectious Diseases. 189, 5, 805-811.
Danchin, Etienne - Vitiello, V. - Vienne, A. - Richard, O. - Gouret. Ph. - McDermott, M. - Pontarotti, P. (2004): The Major Histocompatibility Complex Origin. Immunological Reviews. 198, 216-232.
Duquesnoy, Rene J. - Marrari, Marylin (2002): H. L. A. Matchmaker: A Molecular Based Alorithm for Histocompatibility Determination. II. Verification of the Algorithm and Determination of the Relative Immunogenicity of Amino Acid Triplet-defined Epitopes. Human Immunology. 63, 353-363.
Ehrlich, Rachel (1997): Modulation of Antigen Processing and Presentation by Persistent Virus Infections and in Tumors. Human Immunology. 54, 104-116.
Flajnik, Martin (2004): Comparative Genomics of the MHC. 1st International Conference on Basic and Clinical Immunogenomics, Symposion 3. Budapest. (előadás, ábrák).
Glynne, Paul A. - Price, N. M. (2000): HLA and Infectious Diseases. In: Lechler, Robert - Warrens, Anthony (ed.): HLA in Health and Disease. Academic Press, San Diego, 299-326.
Kasahara, Masanori - Suzuki, T. - Du Pasquier, L. (2004): On the Origins of Adaptive Immune System: Novel Insights from Invertebrates and Cold-blooded Vertebrates. Trends in Immunology. 25, 1471-1490.
Kronenberg, Mitchell - Brines, R. - Kaufman, J. (1994): MHC Evolution: A Long Term Investment in Defense. Immunology Today. 15, 4-6.
Maenaka, Katsumi - Jones, E. Yvonne (1999): MHC Superfamily Structure and the Immune System. Current Opinion in Structural Biology. 9, 745-753.
Mehra, Narinder K. - Jaini, R. - Rajalingam, R. - Balamurugan, A. - Kaur, G. (2001): Molecular Diversity of HLA-A*02 in Asian Indians: Predominance of A*0211. Tissue Antigens. 57, 6, 502-507.
Powis, Stephen H. - Geraghty, Daniel E. (1995): What is the MHC? Immunology Today. 16, 466-468.
Trowsdale, John (1995): Both Man and Bird and Beast": Comparative Organisation of MHC Genes. Immunogenetics. 41. 1-17.
Trowsdale, John (2004): Genetic and Functional Interactions between Polymorphic MHC Class I Proteins and KIR Receptors. (előadás, ábrák).