Immungenomika: a genomalapú immunológia
Széll Márta
PhD, tudományos főmunkatárs, MTA-SZTE Dermatológiai Kutatócsoport - szell @ mail.derma.szote.u-szeged.hu
Bata-Csörgő Zsuzsanna
PhD, egyetemi docens, SZTE Bőrgyógyászati és Allergológiai Klinika, MTA-SZTE Dermatológiai Kutatócsoport - bata @ derma.szote.u-szeged.hu
Sonkoly Enikő
PhD-hallgató, SZTE Bőrgyógyászati és Allergológiai Klinika - esonkoly @ mail.derma.szote.u-szeged.hu
Dobozy Attila
az MTA rendes tagja, egyetemi tanár, SZTE Bőrgyógyászati és Allergológiai Klinika, MTA-SZTE Dermatológiai Kutatócsoport - magony @ mail.derma.szote.u-szeged.hu
Kemény Lajos
az MTA doktora, tanszékvezető egyetemi tanár, SZTE Bőrgyógyászati és Allergológiai Klinika, MTA-SZTE Dermatológiai Kutatócsoport - kl @ mail.derma.szote.u-szeged.hu
Genomikai kutatások a bőrgyógyászatban
Bevezetés
A mindennapos bőrgyógyászati gyakorlatban régóta ismert, hogy egyes
bőrbetegségek - melyek közül jó néhány igen súlyos tünetekkel jár, némelyikük
az élettel is összeegyeztethetetlen - nagyon kis gyakorisággal fordulnak elő,
és családi halmozódást mutatnak. A genetika mendeli szabályainak ismeretében a
20. században számos ilyen ritkán előforduló, súlyos bőrgyógyászati kórkép
öröklődésmenetére derült fény: családfaelemzések alapján tisztázták, hogy
recesszíven vagy dominánsan öröklődnek-e, illetve egyes betegségek esetében
az is nyilvánvalóvá vált, hogy nemi kromoszómához kötötten öröklődnek. Ezeket a
bőrgyógyászati kórképeket összefoglalóan genodermatózisoknak hívjuk. Más, jóval
gyakrabban előforduló bőrbetegségek (pikkelysömör, atópiás dermatitisz)
esetében is felfigyeltek rá, hogy a tünetek megjelenése egyes családokban
gyakoribb, de a genodermatózisokkal ellentétben e kórképekben nem volt
egyértelműen levezethető az öröklődésmenet, illetve a megfigyelések szerint
környezeti és életmódbeli tényezők is nagymértékben befolyásolják az ezekkel a
bőrbetegségekkel járó tünetek megjelenését. A fenti kórképeket mindezen
tényezők alapján multifaktoriális bőrbetegségeknek hívjuk.
Mind a genodermatózisok, mind a multifaktoriális bőrbetegségek hátterében álló
genetikai eltérések azonosításának, illetve azok szerepének tisztázásában a
kóroki folyamatokban, nagy lendületet adott az 1990-ben induló Humán Genom
Projekt. A nemzetközi összefogással, állami intézmények és magáncégek
bevonásával létrejött grandiózus munka eredményeként napjainkra 3×109
bázispárnyi humán genomi DNS szekvenálása történt meg, és a szekvenciaadatok
alapján 30-35 ezer gén jelenlétét feltételezik a teljes humán genomban. Bár még
mindig van kb. egyszázaléknyi össze nem illesztett rész, a humán genom szinte
teljes mértékű ismerete új távlatokat nyit a genetikai hátterű kórképek
pathogenezisének megismerésében. Napjainkban az eddig használt, rendkívül
munka- és időigényes ún. pozicionális klónozási és funkcionális vizsgálati
módszerek helyébe a Humán Genom Project adatain alapuló genomikai és
proteomikai vizsgálati módszerek lépnek.
Mely területeken számíthatunk nagy előrelépésre a közeljövőben? Egyrészt a már
jellemzett, különböző bőrgyógyászati kórképekkel asszociált gének további
lókuszainak azonosítása a Humán Genom Projekt adatai és az interneten bárki
számára hozzáférhető és használható adatbázisok és genomikai témájú szoftverek
segítségével egyre egyszerűbbé válik. Másrészt a projekt szekvenciaadatai
alapján folyó annotálási munkák új gének azonosítását, funkcióik jellemzését
teszik lehetővé, ezek közül jó néhánynak a különböző humán kórképekkel, többek
között genodermatózisokkal, illetve multifaktoriálisan öröklődő
bőrbetegségekkel való asszociációját, a genotípus-fenotípus összefüggéseket
lehet majd tisztázni. Hosszú távon ezek az eredmények lehetővé teszik majd a
genetikai hátterű bőrbetegségek molekuláris diagnózisát, a preszimptómatikus
diagnózist, az esetleges hordozók azonosítását, valamint a szomatikus
génterápiát (McGrath, 2004).
Genodermatózisok
Az elmúlt évtizedek, kiváltképp a 90-es évek igen intenzív genetikai kutatásai
a genodermatózisok hátterében álló mutációk azonosítására nagy mennyiségű
adatot szolgáltattak: napjainkra 350 genodermatózis molekuláris szintű
jellemzése történt meg. E kórképek közül az elméleti adatoknak a mindennapi
gyakorlatba történő átvitelére a legnagyobb előrehaladás a genetikai hátterű
hólyagos bőrbetegségek (epidermolysis bullosa csoport) területén történt. Ez a
ritkán előforduló bőrgyógyászati kórkép rendkívül változatos klinikai képet
mutat, melyek közül néhány forma nagyon súlyos, halálos kimenetelű is lehet.
Napjainkra ismertté vált, hogy a sokféle megjelenési forma mögött a bazális
membrán - a dermisz és az epidermisz között elhelyezkedő anatómiai képlet -
különböző fehérjéit kódoló gének mutációi állnak. Mely területeken hasznosult
mindeddig ez a tudás, és mi várható a közeli illetve a távoli jövőben?
A genetikai hátterű hólyagos bőrbetegségekkel kapcsolatos eddigi ismereteinket
(amelyekhez a Prof. Dr. Kárpáti Sarolta által vezetett hazai kutató műhely is
hozzájárult [Csikós, 2004]), egy nemzetközi összefogással létrejött
betegtámogató adatbázisban összegezték, amely interneten is elérhető
(http://www.debra.org/).
A különböző, genetikailag determinált hólyagos
bőrbetegségek hátterében álló genetikai eltérések ismerete lehetővé teszi a
kórformák pontos elkülönítését, az adott kórképet okozó mutáció azonosítását,
és lehetőség nyílik genetikai tanácsadásra is. A hólyagos genodermatózisok
által érintett családok, hasonló módon az egyéb, már ismert genetikai hátterű
betegségekben szenvedőkkel, illetve hordozókkal, a közeli jövőben számolhatnak
az in vitro fertilizációs technika által nyújtott preimplantációs diagnózis
által nyújtott lehetőséggel is.
A genetikai kutatások eredményei a pontos diagnózis felállításához szükséges
módszerek mellett lehetőséget nyújtanak a genodermatózisok hátterében álló
mutációk által okozott fenotípusok, a megnyilvánuló betegség tüneteinek
korrekciójára is. Számos sikeres, egereken és kutyákon végrehajtott szomatikus
génterápiai kísérletet követően az első klinikai vizsgálatokat 2002-ben
végezték el. A klinikai kísérletek úttörője az olasz De Luca professzor, aki a
római Istituto Dermopatico dell'Immacolata klinikán a bazális membrán
hemidezmoszómáit érintő génmutációk által okozott junkcionális epidermolysis
bullosa szomatikus génterápiáját célzó első vizsgálatokat végzi. Már az első
kísérletek számos technikai problémát vetettek fel: az ex vivo szomatikus
génterápiai módszerrel végrehajtott eljárás után a graft megtapadása, túlélése
kérdéses, valamint számos, az eljárással kapcsolatos biztonsági kérdést vet fel
az a tény, hogy a géntranszfert virális vektorokkal hajtják végre (Dellambra,
2001).
Annak ellenére, hogy a genodermatózisok hátterében álló mutációk azonosítása és
az általuk okozott kóroki folyamatok tisztázása az elmúlt évtizedben nagy
lépésekkel haladt előre, a mindennapos bőrgyógyászati gyakorlatban mindezen
tudás hasznosulása még mindig korlátozott: a molekuláris diagnosztikai
eljárások csak speciálisan felszerelt laboratóriumokban kivitelezhetőek, a
genodermatózisok szomatikus génterápiája pedig inkább a távoli jövőben lesz
alkalmazható.
Multifaktoriális bőrbetegségek
A mendeli öröklődésmenetet mutató genodermatózisok esetében a betegség
genetikai hátterének tisztázásában nagy segítséget nyújt az érintett családok
családfaelemzése, és az a tény, hogy az adott mutáció megléte egyértelműen a
fenotípus kialakulásához vezet. Ezzel szemben a multifaktoriálisan öröklődő
bőrbetegségek öröklődésmenete nem tisztázható családfaanalízisekkel,
fenotípusuk megjelenése nem egyértelmű, a tünetek megjelenését életmódbeli,
környezeti tényezők is nagymértékben befolyásolják. Jóllehet a 90-es évek óta
intenzíven folyik számos multifaktoriális bőrbetegség (atopias dermatitis, acne
vulgaris, krónikus lábszárfekély) pathomechanizmusának vizsgálata, a legnagyobb
léptékű előrehaladást a pikkelysömörrel (psoriasis) kapcsolatos vizsgálatokban
láthatjuk. Ennek egyik oka feltehetően az, hogy ez, a kaukázusi populációban
2-3 % gyakorisággal előforduló kórkép adja a bőrgyógyászati rendelések
forgalmának kb. 8 %-át, a pikkelysömör tehát joggal tekinthető az egyik
leggyakoribb bőrbetegségnek. Mivel a Szegedi Tudományegyetem Bőrgyógyászati és
Allergológiai Klinikáján a 80-as évek eleje óta folynak a pikkelysömör
pathomechanizmusával kapcsolatos kutatások, jelen munkánkban ezen a betegségen
fogjuk szemléltetni a multifaktoriális bőrbetegségekkel kapcsolatos genomikai
kutatások előrehaladását.
A pikkelysömör betegség klinikai jellemzése, pathomechanizmusának immunológiai
komponensei
Más poligénes betegségekhez hasonlóan a pikkelysömör klinikai spektruma is
széles: a tünetek súlyossága igen széles skálán mozog, az életminőséget alig
befolyásoló néhány lokalizált bőrtünet jelentkezésétől a súlyos, egész
bőrfelületet érintő, ízületi panaszokkal kísért, az életet veszélyeztető
formáig terjed. A pikkelysömörös bőrtünetek kialakulásában nagy szerepet
játszik a T-sejtes infiltrátum a hám alatti kötőszövetben és a hámban, valamint
a hámsejtek (keratinociták) fokozott osztódása és kóros differenciálódása (1A.
ábra). A pikkelysömörös betegek bőrén a legkülönbözőbb hatásokra (fizikai,
kémiai trauma, infekció, kontakt allergének, stressz, fokozott
alkoholfogyasztás, bizonyos gyógyszerek) kialakul a jellegzetes pikkelysömörös
lézió (Köbner-jelenség), jelezve, hogy a pikkelysömörös beteg bőre tünetmentes
állapotában is kóros reakciókészséget hordoz. A pikkelysömör klinikai képe igen
változatos, de alapvetően két altípust: a fiatal korban jelentkező I. típust és
a felnőtt korban jelentkező II. típust különböztetünk meg. A fiatal korban
jelentkező forma általában negyvenéves kor előtt alakul ki, gyakran hirtelen,
nagy kiterjedésben jelentkező pontszerű (guttált) bőrtünetek formájában, míg a
II. típusra inkább a nagy kiterjedésű plakkok a jellemzőek.
A bőrt infiltráló T-sejtek pathomechanizmusban játszott szerepének vizsgálata
az 1980-as években kezdődött, Jan D. Bos és munkatársai 1983-ban írták le az
infiltrátum sejtjeinek immunfenotípusát (Bos, 1999). Kísérletes adatok
bizonyították, hogy a bőrt infiltráló aktivált T-sejtek limfokinjeik révén a
pikkelysömörös betegek keratinocita őssejt típusú sejtjeinek proliferációját
fokozzák (1B. ábra), normál bőrből származó sejteken ilyen hatást nem lehet
észlelni. A hámproliferációt kiváltó limfokinhatás egyik lényeges eleme az
interferon-g (IFN-gamma). Számos vizsgálat igazolta, hogy a pikkelysömörben
kialakuló gyulladásban fontos szerepet játszanak az autoreaktív, IFN-gamma termelő,
Th1 típusú T-sejtek (Bata-Csörgő, 1995). Az utóbbi években egyre több, régóta
alkalmazott antipsoriatikus hatású terápiáról (fénykezelések, methotrexat,
retinoidok, D3 vitamin analógok) derült ki, hogy a Th1-es típusú immunválaszt
visszaszorítják, ami feltehetően hozzájárul a betegségben tapasztalt terápiás
hatáshoz.
Annak köszönhetően, hogy a pikkelysömör immunológiai hátterének vizsgálata
fényt derített számos, a betegség pathomechanizmusában szerepet játszó
folyamatra és az azokban részt vevő komponensekre, számos új biológiai szert
fejlesztettek ki, és kezdték el alkalmazásukat az utóbbi években a közepes és
súlyos fokú pikkelysömör terápiájában. Ilyen, már a klinikai gyakorlatban is
használt szerek a tumor nekrózis faktor (TNF) gátlók: egy LFA-3 fúziós protein,
amely a bőrt infiltráló T-sejtek aktivációját akadályozza azáltal, hogy a
T-sejtek CD2 receptora és az antigénprezentáló sejtek LFA-3 receptora közötti
kostimulációs kapcsolatot gátolja, valamint egy monoklonális ellenanyag, amely
a T-sejtek LFA-1 (CD11a) receptorához kötődve a T-sejtek bőrbe jutását és
aktivációját gátolja. A fentiek jól szemléltetik, hogy a pikkelysömör
immunológiai hátterének kutatása olyan nagy mennyiségű értékes adatot
szolgáltatott a betegség pathomechanizmusáról, hogy azokra alapozva új, már a
klinikumban használatos szerek fejlesztésére is sor kerülhetett.
Ezzel szemben távolinak tűnik még az az idő, amelyben a pikkelysömör hátterében
álló genetikai faktorokkal kapcsolatos vizsgálatok a betegség diagnózisában és
terápiájában hasznosulhatnak.
A pikkelysömör multigénesen meghatározott bőrgyógyászati kórkép
A pikkelysömör öröklődésének első rendszerezett feldolgozását 1963-ban Donald
C. Abele és munkatársai közölték, akik egy nagy észak-karolinai betegpopuláció,
több érintett család adatainak feldolgozása alapján arra a következtetésre
jutottak, hogy a betegség hátterében álló (akkor még teljes mértékben
ismeretlen) genetikai faktorok penetranciája megközelítőleg 60 %-os. Szintén a
60-as évekre datálódik a felismerés, amely szerint a pikkelysömör tüneteinek
kialakulásához számos, egymástól független genetikai eltérés megléte szükséges,
tehát a betegség genetikailag heterogén. Egy- és kétpetéjű pikkelysömörös ikrek
adatainak feldolgozása szerint egypetéjű ikrek esetében a betegség
konkordanciája 65-70 %, míg kétpetéjű ikrek esetében 15-20 %-os. Gunnar
Swanbeck és munkatársai 1997-ben 3717 érintett család vizsgálata alapján a
következő, genetikai tanácsadáson is használható becsléseket tették: ha egyik
szülő sem szenved pikkelysömörben, akkor 4 %, ha az egyik szülő pikkelysömörös,
akkor 51 %, ha pedig mindkettő, akkor 83 % esély van arra, hogy a születendő
gyermek pikkelysömörös lesz.
A PSORS lókuszok
A pikkelysömörre való hajlam és bizonyos HLA (humán leukocita antigén)
génvariációk közötti összefüggés már a hetvenes évek eleje óta ismert. Thomas
J. Russel és munkatársai (1972) számoltak be róla, hogy a HLA-B13 allél
szignifikánsan magasabb arányban fordul elő a pikkelysömörös betegek között,
mint az egészséges populációban: míg előzőek körében 27 %, utóbbiak között
csupán 3 % arányban fordul elő. Az allél pikkelysömör-hajlammal való
kapcsolatát tűnik megerősíteni az a tény is, hogy eszkimók, észak-amerikai
indiánok és japánok között ez az allél nagyon kis gyakorisággal fordul elő, és
ugyanezen népcsoportokban a pikkelysömör prevalenciája is alacsonyabb,
összehasonlítva a kaukázusi populációval. Az azóta eltelt több mint harminc év
igen intenzív, több kontinensen párhuzamosan folyó HLA-asszociációkkal
kapcsolatos kutatásai egyértelműen abba az irányba mutatnak, hogy a
pikkelysömörre való hajlam kialakításáért felelős egyik alapvető fontosságú gén
(vagy gének) a humán 6. kromoszóma rövid karján (6p21.3), a szöveti
összeférhetőséget meghatározó fő hisztokompatibilitási génkomplexben (MHC)
található (Balendran, 1999). Ezt a lókuszt a pikkelysömörrel foglalkozó
irodalom PSORS1 (psoriasis susceptibility 1) (2A. ábra) néven említi, és a
régió génjeinek azonosításával és a géneken belül található polimorfizmusok
jellemzésével közelebb kerülhetünk a pikkelysömörre való hajlam genetikai
hátterének megértéséhez (2B. ábra). Könnyen lehet, hogy az első látásra magától
értetődő HLA-asszociációk valójában nem állnak oki összefüggésben a
pikkelysömör pathogenezisével, hanem a velük kapcsoltan öröklődő gén(ek)
változatai játszanak szerepet a betegségre való hajlam kialakításában. A 6p21.3
pozícióban található HLA régió közel 3,5 millió bp hosszúságú, és
megközelítőleg kétszáz gént tartalmaz. Annak érdekében, hogy ez a nagy régió
minél kisebbre legyen szűkíthető, nagy felbontású mikroszatellita analízist
végeztek (Oka, 1999), ennek segítségével sikerült a régión belül azonosítani
egy ősi haplotípust, amely generációról generációra öröklődik egymással családi
kapcsolatban nem levő csoportokban, számos, földrajzilag egymástól távol eső
populációban. Ily módon az eredetileg 3,5 millió bp hosszúságú régió egy 160
kb-nyi szekvenciarészletre volt szűkíthető, amelynek a centromer felé eső
legszélső génje a HLA-C gén.
Melyek azok a gének, amelyek ebben a régióban helyezkednek el, és milyen módon
vehetnek részt a pikkelysömörre való hajlam kialakításában, a betegség
pathomechanizmusában? A fenti szekvenciarészleten három pszeudogén (NOB4, NOB5,
HCGII-2), valamint a HLA-C gén, egy oktamer motívum kötő transzkripciós faktort
kódoló gén (OTF3), egy, a sejtek növekedésében szerepet játszó transz-aktiváló
faktor génje (TCF 19), egy a-helikális szerkezetű coiled coil rod fehérjét
kódoló gén (HCR), a keratinociták differenciálódása során magas szinten
kifejeződő corneodesmosin gén (CDSN), valamint három, mindeddig ismeretlen
funkciójú fehérjét kódoló gén, az SPR1, SEEK1 és STG1 gének találhatók. A fenti
fehérjék azonosítását követően az elmúlt néhány évben intenzív kutatás
kezdődött annak felderítésére, hogy az ezeken a géneken belül azonosított
polimorfizmusok mutatnak-e összefüggést a pikkelysömörre való hajlammal.
Egyértelmű asszociációt mutat a HLA-C gén HLA-Cw*0602 allél változata a
pikkelysömörre való hajlammal, elsősorban az I. típusú, fiatalkorban, guttált
típusú bőrtünetekkel jelentkező betegséggel. Az OTF3 gén egyik variánsának, az
ún. OTF3-b allélnak az előfordulási gyakoriság (Gonzalez, 2000), valamint a
SEEK1 gén öt és az SPR1 gén egy SNP-je (single nucleotide polymorphism: egy
adott gén különböző szekvenciarészletein található egyetlen nukleinsav
eltérése) mutat szignifikáns eltérést az egészséges és pikkelysömörös
populációban, míg a TCF19 gén esetében ilyen polimorfizmust nem találtak. Hat
különböző népcsoportból származó 419 család tanulmányozása során arra derült
fény, hogy a HCR gén HCR*WWCC és a HLA-C gén HLA-Cw*0602 allélvariánsai együtt
olyan haplotípust alkotnak, amely szignifikáns asszociációt mutat a
pikkelysömör betegséggel (Asumalahti, 2000). In silico vizsgálatok szerint a
fenti HCR allél a HCR fehérje másodlagos szerkezetének megváltozásához vezet,
valamint az is igazolást nyert, hogy a pikkelysömörös tünetes bőrben a HCR
protein magasabb szinten fejeződik ki, mint az egészséges bőrben. Mindezek
alapján a szerzők feltételezik, hogy a HCR*WWCC allél, feltehetően a
keratinociták proliferációját módosítva, a pikkelysömörre való hajlam egyik
meghatározó genetikai komponense lehet. A keratinociták differenciálódása során
magasan expresszálódó glikoprotein, a corneodesmosin CDSN* 971T allél variánsa
több, egymástól független etnikai csoportban a pikkelysömörrel asszociáltan
jelentkezik (Ahnini, 1999). Kimutatták továbbá, hogy az azonosított SNP
megváltoztatja a cormeodesmosin mRNS egy olyan kötőhelyét, amely egy 39 kDa
fehérjét köt, és a fokozza a transzkriptum stabilitását, ennek következtében a
corneodesmosin jóval magasabb szinten és abnormális mintázattal fejeződik ki a
pikkelysömörös léziókban. Igazolást nyert továbbá, hogy ez a megváltozott
szintű és mintázatú corneodesmosin expresszió csak a pikkelysömörös tünetekre
jellemző, egyéb gyulladásos bőrbetegségekben nem jelentkezik.
A betegség pontosabb diagnózisát és a preszimptómatikus diagnosztikus eljárások
kidolgozását segíthetik azok a vizsgálatok, amelyek célja a PSORS1 lókusz,
illetve az azon belül azonosított polimorfizmusok szerepének tisztázása a
különböző pikkelysömör alcsoportok pathomechanizmusában. Ezeknek a
vizsgálatoknak elengedhetetlen feltétele, hogy a pikkelysömörös betegcsoporton
belül az egyes alcsoportokat több száz, klinikailag rendkívül jól jellemzett
beteg reprezentálja. Az elmúlt két-három év érdekes eredményei szerint a PSORS1
lókuszon belül a HLA-Cw*0602, HCR*WWCC és CDSN*5 allélvariánsok egymással
szoros kapcsoltságban mind a guttált, mind a plakkos megjelenésű
pikkelysömörrel asszociáltan fordulnak elő, viszont nem mutatnak asszociációt a
tenyéri-talpi lokalizációjú pusztulózus pikkelysömörrel. Egy közelmúltban
közölt vizsgálat adatai szerint a késői megjelenésű, II. típusú pikkelysömörrel
nem, csak a fiatalkori, I. típusú pikkelysömörrel asszociált a PSORS1 lókusz,
ami annak a lehetőségét vetíti fel, hogy a két alcsoport hátterében (habár
klinikailag és hisztológiailag nagyon hasonlóak) nem ugyanazok a genetikai
eltérések állnak, és ebből a szempontból esetleg két különböző eredetű
kórképről van szó (Asumalahti, 2003).
A PSORS1-en kívül mindeddig hat olyan lókuszt (PSORS2-7) (2A. ábra)
azonosítottak a humán genomban, amely feltehetően szerepet játszik a
pikkelysömörre való hajlam kialakításában. Ezeket a szakirodalom nem-MHC
pikkelysömör lókuszoknak nevezi, elkülönítendő a PSORS1 lókusztól. Ezek közül
az utóbbi időben nagy figyelem fordult a 17. kromoszóma hosszú karjára (17q25)
térképezett PSORS2 lókusz felé. Ennek nagy felbontású térképezése (hasonlóan a
PSORS1 lókuszhoz) mikroszatellita analízissel megtörtént, és jelenleg is folyik
a leszűkített régióban található gének jellemzése, illetve szerepük tisztázása
a pikkelysömör pathomechanizmusában.
Összefoglalóan elmondhatjuk, hogy a PSORS1 lókusz pikkelysömörrel való
asszociációját (függetlenül a vizsgált populációtól) eddig minden tanulmány
igazolni látszott, a PSORS2, PSORS4 és PSORS6 lókuszok esetében legalább két
független tanulmány adatai utalnak ezek szerepére a betegség
pathomechanizmusában. A többi lókusz esetében további független vizsgálatokat
igényel pikkelysömörrel való asszociációjuk igazolása.
A pikkelysömör pathomechanizmusában szerepet játszó citokin gének
polimorfizmusainak vizsgálata
A klasszikus genetikai kapcsoltsági analízisek mellett sok értékes adatot
szolgáltatnak a pikkelysömörre való hajlam kialakításáról azok a vizsgálatok,
melyek a tünetek kialakulásáért felelős kóros citokin környezet hátterében álló
eltéréseket kutatják. Ismert, hogy a pikkelysömörös tünetes bőrben egyes
citokinek, úgy, mint a tumor nekrózis faktor a (TNF-alfa) és az interleukin-1b
(IL-1beta) magasabb szinten, míg más citokinek, úgy, mint az antiinflammatórikus
hatású interleukin 10 (IL-10) és az interleukin 1 receptor antagonista fehérje
(IL1-RA) alacsonyabb szinten fejeződnek ki. A pikkelysömör pathomechanizmusában
szerepet játszó citokin gének polimorfizmusai befolyásolhatják a
citokintermelést, ezzel hozzájárulva a betegség kialakításában szerepet játszó
kóros citokin környezethez. Több száz pikkelysömörös beteg és egészséges
kontroll egyén TNF-alfa, IL-1beta és IL1-RA polimorfizmusainak összevetése igen
érdekes eredményeket szolgáltatott. A TNF-alfa gén G-238A polimorfizmusa emelt
szintű TNF-alfa produkcióhoz vezet, és szignifikáns asszociációt mutat az I.
típusú, fiatalkori pikkelysömörre való hajlammal, érdekes módon elsősorban a
férfi betegekben (Reich, 2002). Ezzel szemben az IL-1beta gén C-511T
polimorfizmusa a II. típusú, negyven év felett jelentkező pikkelysömörrel
mutatott asszociációt. In vitro kísérletekben ez a polimorfizmus emelt szintű
IL-1beta fehérje expressziót eredményez, összehasonlítva a vad típusú alléllal. Az
antiinflammatorikus hatású IL-10-ről régóta ismert, hogy fontos szerepet
játszik a pikkelysömör pathomechanizmusában. Az IL-10 gén promoter régiójában
számos polimorfizmust írtak le, amelyek két mikroszatellitával jellemezhetők,
IL10.G és IL10.R. Hetvennyolc pikkelysömörös beteg és nyolcvan egészséges
kontroll egyén adatainak összevetéséből a következő eredmény született: a két
allél eloszlásában nem találtak szignifikáns különbséget a beteg és az
egészséges populáció összevetésekor, ellenben amikor a pikkelysömörös
betegpopuláción belül vizsgálták a két mikroszatellita allél frekvenciáit,
akkor az IL10.G13 allél I. típusú, családi halmozódást mutató, fiatalkori
pikkelysömörrel való szignifikáns asszociációját találták. Ezek alapján
feltételezik, hogy az IL10 lókusz szerepet játszik a pikkelysömörre való hajlam
kialakításában (Asadullah, 2001).
Nagyskálájú génexpressziós vizsgálatok
a pikkelysömörre hajlamosító genetikai faktorok azonosítására
A pikkelysömörre hajlamosító genetikai faktorok azonosításának (a klasszikus
genetikai asszociációs vizsgálatok és a betegség pathomechanizmusáben részt
vevő citokin gének polimorfizmusainak vizsgálata mellett) egy harmadik
megközelítési lehetősége az ún. nagyskálájú génexpressziós vizsgálat.
Alapvetően kétfajta módszerrel lehet nagy skálájú génexpressziós vizsgálatokat
végezni. Az ún. "zárt" rendszerekben (pl. a DNS chip vizsgálatokban) már
ismert, általában azonosított funkciójú gének expressziójának
összehasonlítása folyik, ezzel szemben az ún. "nyílt" rendszerekben lehetőség
van eddig nem azonosított, ismeretlen funkciójú gének expressziójának
összehasonlítására különböző eredetű mintákban. Az elmúlt évtizedben megjelent
számos közlemény tanúsítja, hogy mindkét megközelítési módot alkalmazták a
pikkelysömörös léziókra, ill. a pikkelysömörös nem léziós epidermiszre jellemző
génexpressziós változások követésére.
Anne Bowcock és munkatársai közölték mindeddig a legátfogóbb tanulmányt (2001),
amelyben 12 ezer annotált gén expresszióját hasonlították össze egészséges és
pikkelysömörös tünetes, illetve tünetmentes bőrben. 177 gént azonosítottak,
amely az egészséges bőrhöz viszonyítva alacsonyabb vagy magasabb szinten
fejeződött ki a pikkelysömörös tünetes bőrben. Ezek közül tíz a pikkelysömörös
tünetmentes bőrben is eltérő expressziót mutatott, és a már korábban
azonosított PSORS lókuszok valamelyikére térképeződött. Ez az eredmény arra
utal, hogy a pikkelysömörre való hajlam kialakításában részt vevő egyes gének
oly módon fejtik ki hatásukat, hogy a tünetmentes bőrben az egészségeshez
viszonyítva kóros szinten fejeződnek ki mRNS szinten.
Saját eredmények
A Szegedi Tudományegyetem Bőrgyógyászati és Allergológiai Klinikáján az 1980-as
évek eleje óta folynak vizsgálatok a pikkelysömör pathomechanizmusával
kapcsolatosan, melyeknek fő irányvonala a tünetek kialakulását indukáló
immunológiai folyamatok, citokinek és citokin receptorok expressziójának,
illetve az antipsoriatikus dithranol hatásmechanizmusának vizsgálata volt. A
Klinikán a 90-es évek végén bevezetett molekuláris biológiai vizsgálati
módszerek lehetővé tették, hogy munkacsoportunk genomikai jellegű vizsgálatokat
is végezzen. Számos multifaktoriális bőrgyógyászati kórkép genetikai hátterét
vizsgáljuk, úgy, mint a festékhiányos bőrbetegség (vitiligo), acne vulgaris,
lábszárfekély (Nagy, 2005). Jelen dolgozatunkban a pikkelysömörrel kapcsolatos
genomikai vizsgálataink eredményeit foglaljuk össze. Munkánk célja az volt,
hogy pikkelysömörös tünetmentes és egészséges epidermiszminták expressziós
mintázatának összehasonlításával olyan géneket azonosítsunk, amelyek szerepet
játszhatnak a pikkelysömörre való hajlam kialakításában. Ehhez nagyskálájú,
"nyílt" rendszerű ún. differential display génexpressziós vizsgálatokat
végeztünk. Eddigi vizsgálataink során néhány olyan eltérő expressziójú gént
azonosítottunk, amelyek fehérjetermékeinek funkciója már ismert volt. Az egyik
ilyen fehérje egy extracelluláris mátrix protein, a fibronektin, melynek EDA
onkofötális formájáról korábban kimutatták, hogy a pikkelysömörös tünetmentes
bőrben a dermális-epidermális junkció (DEJ) területén kifejeződik, és ez a
kifejeződés nem jellemző az egészséges bőrre. További vizsgálatainkkal
igazoltuk, hogy maguk a pikkelysömörös tünetmentes keratinociták is képesek
expresszálni a fibronektint és annak EDA onkofötális formáját, így részben
forrásai lehetnek a DEJ területén detektált fibronektinnek (Széll, 2004).
Vizsgálataink során szintén magasabb szintű expressziót mutatott mind a
differential display, mind a real-time reverz transzkriptáz polimeráz
láncreakció (RT-PCR) kísérletekben (3A. ábra) egy mindeddig ismeretlen
funkciójú transzkriptum. A cDNS (amelynek szekvenciája tízhetes humán embrió
cDNS könyvtárból származik) az adatbázisokban AK022045 azonosítási számon
szerepel. A cDNS in silico átírása nem eredményezett fehérjeterméket, és
további homológiavizsgálataink arra utaltak, hogy az AK022045 transzkriptum egy
szabályozó, nem-kódoló RNS. Kísérletekkel igazoltuk, hogy az általunk 5'
irányban meghosszabbított, a keratinocitákban teljes hosszúságban kifejeződő
gén különböző stresszhatásokra indukálódik a hámsejtekben, a gént PRINS-nek
(Psoriasis Susceptibility-related RNA Gene Induced by Stress) neveztük el.
Az utóbbi évtizedben számos közlemény jelent meg, amely arra hívja fel
figyelmünket, hogy a humán genom fehérjéket nem kódoló junk DNS-szakaszairól
sok olyan gén íródik át, amely RNS-ként tölt be szabályozó funkciót. Ilyen, a
PRINS génnel szerkezeti homológiát mutató, nem kódoló RNS gén a
neuronspecifikusan kifejeződő BC200 gén is, amely az emberben és főemlősökben
konzervált struktúrát mutató monomerikus Alu retrotranszpozíciós elemet hordoz
(Martignetti, 1993). Abnormális expressziója számos, nem neuronális eredetű
tumoros szövetben is detektálható.
Az Alu elemeket hordozó, fehérjévé át nem íródó, de a sejtekben stabil RNS-ként
detektálható géntermékekről általánosan elfogadott tény, hogy expressziójuk
magas szintje akkor figyelhető meg, ha a sejteket valamilyen formában stressz
éri (Liu, 1995). Számos irodalmi adat és saját kutatási eredményeink is arra
hívják fel a figyelmünket, hogy a pikkelysömörös tünetmentes epidermiszben az
abnormális extracelluláris miliő a keratinociták számára stresszt jelent.
Feltételezzük, hogy ez is hozzájárulhat a pikkelysömörös tünetmentes
keratinociták külső indukcióra mutatkozó, inherens, felfokozott
reakciókészségéhez. Amikor azonban a pikkelysömörös tünetek kialakulásához
vezető keratinocita hiperproliferáció külső hatásra indukálódik (lásd
pikkelysömörös epidermisz és a T-limfokinekkel indukált pikkelysömörös
tünetmentes epidermisz), a keratinociták felszabadulnak e stresszhatás alól, és
a PRINS gén expressziója határozottan csökkenni kezd (3B. ábra).
Eredményeink szerint a PRINS gén az általunk tanulmányozott összes humán
szervben és szövetben kifejeződik (3C. ábra), tehát ellentétben a szoros
neuronspecifikus kifejeződést mutató BC200 nem-kódoló RNS génnel, a PRINS
nem-kódoló RNS gén feltehetően minden sejt általános stresszválaszának
kialakításában szerepet játszik. Az a tény azonban, hogy a különböző
szövettípusok között a PRINS gén expressziója nagymértékű eltérést mutat, arra
utal, hogy kifejeződése bizonyos mértékben szerv- és szövetspecifikusan
szabályozott.
A fehérjévé át nem íródó, szabályozó funkciójukat RNS-ként betöltő génekkel
kapcsolatos kutatások az elmúlt néhány év nagy figyelmet keltő területévé
váltak: 2002-ben a Science magazin az év első számú, nagy áttöréseként
értékelte a szabályozó RNS-ekkel kapcsolatos vizsgálatok eredményeit. A Szegedi
Tudományegyetem Bőrgyógyászati és Allergológiai Klinikáján és az MTA-SZTE
Dermatológiai Kutatócsoportjában folyó munkánkkal reményeink szerint
hozzájárulunk egyrészt a pikkelysömörre hajlamosító genetikai faktorok
azonosításához, másrészt napjaink molekuláris biológiai kutatásainak egyik új
ágához, a nem-kódoló szabályozó RNS-ek azonosításához és funkcióik
megismeréséhez.
Kulcsszavak: genodermatózisok, multifaktoriális bőrgyógyászati kórképek,
pikkelysömörre hajlamosító genetikai faktorok, nem-kódoló RNS gének
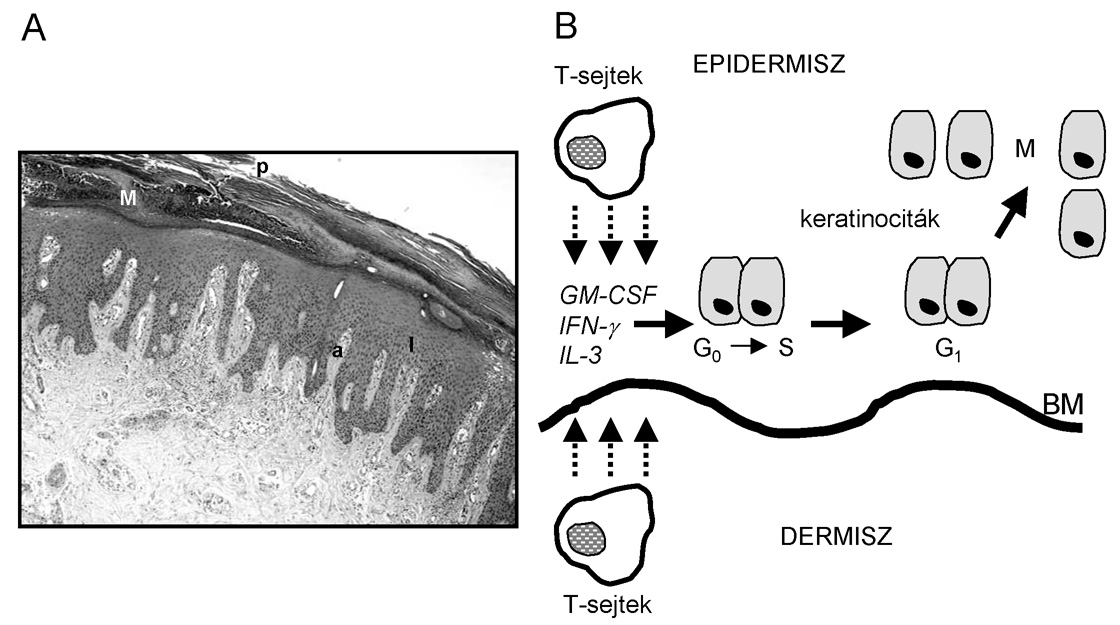
1. ábra * A pikkelysömör szövettani képe és a betegségre jellemző hám
hiperproliferáció feltételezett mechanizmusa. A) Pikkelysömörös tünetes bőr
keresztmetszete hematoxilin-eozin festéssel. p: parakeratózis, amely a klinikai
képben hámlásként jelenik meg; a: akantolízis, a megnyúlt hámcsapok között a
kötöszövet egészen a hámló szarurétegig nyúlik fel; M: Munro-féle
microabscessusok, leukocita sejtcsoport az epidermiszben; l: leukocita
beszűrődés B) A dermiszben és az epidermiszben kórosan jelen levő T-sejtek
limfokineket: interferon-g-t (IFN-gamma), interleukin-3-t (IL-3),
granulocita-makrofág kolónia stimuláló faktort (GM-CSF) termelnek és bocsátanak
ki, amely a bazális membránon (BM) ülő őssejtek aktiválásához vezet, a sejtek
nyugalmi fázisból (G0) kilépve osztódni kezdenek (M).
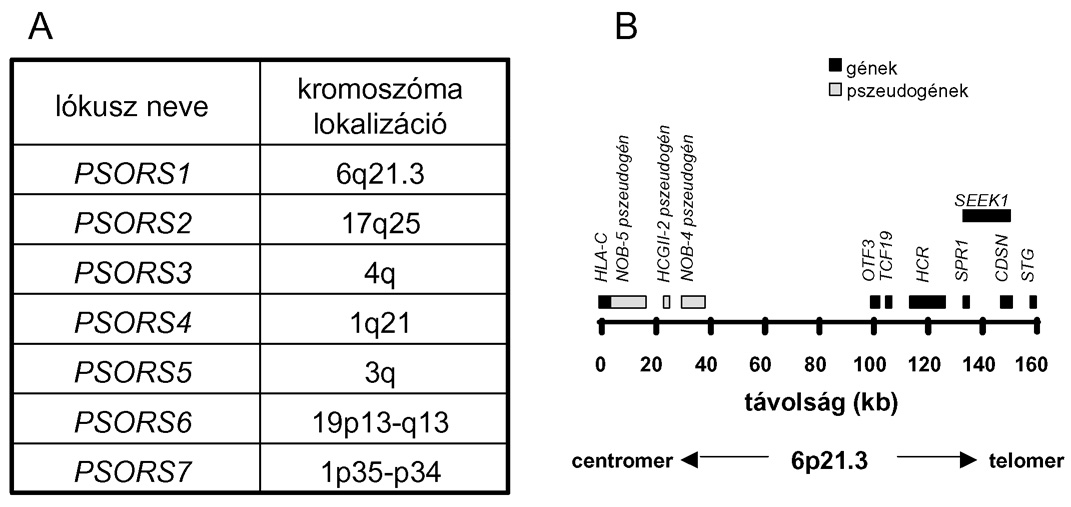
2. ábra * A PSORS lókuszok A.) A kapcsoltsági analízisekkel azonosított,
pikkelysömörre való hajlam kialakításában szerepet játszó lókuszok és azok
kromoszomális lokalizációja. B.) A PSORS1 lókusz lokalizációja a humán 6.
kromoszómán és a lókuszon belül azonosított gének, illetve pszeudogének. A
gének részletes jellemzését lásd a szövegben.
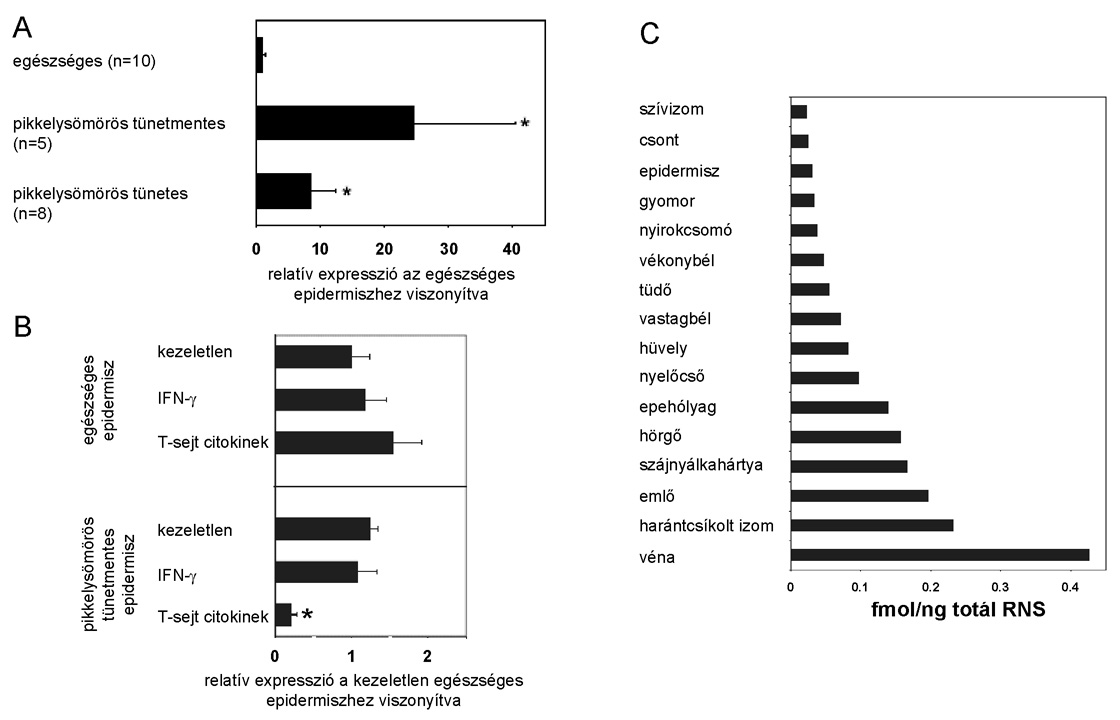
3. ábra * A PRINS gén expressziójának vizsgálata kvantitatív real-time RT-PCR
módszerrel. A) A PRINS gén legmagasabb szintű expresszióját a pikkelysömörös
tünetmentes epidermiszben detektáltuk, amely huszonötször magasabb mértékű,
mint az egészséges epidermiszben. B) A PRINS gén expressziója T-sejt
citokinekkel való indukciót követően nem változik egészséges epidermiszben,
ellenben pikkelysömörös tünetmentes epidermiszben expressziója nagymértékben
lecsökken, emlékeztetve a pikkelysömörös tünetmentes és tünetes epidermisz
között detektált PRINS expresszió különbségre. C) A PRINS gén minden általunk
vizsgált szövetben és szervben kifejeződik, de expressziójának mértéke nagy
különbségeket mutat: legmagasabb szintű a vénákban, míg legalacsonyabb szinten
a szívizomban fejeződik ki.
Irodalom
Abele, Donald C. - Dobson, R. L. - Graham, J. B. (1963): Heredity and
Psoriasis: Study of a Large Family. Archives of Dermatology. 88, 38-47.
Ahnini, R. Tazi - Camp, N. J. - Cork, M. J. - Mee, J. B. - Keohane, S. G. -
Duff, G. W. - di Giovine, F. S. (1999): Novel Genetic Association between the
Corneodesmosin (MHC S) Gene and Susceptibility to Psoriasis. Human Molecular
Genetics. 8, 1135-40
Asadullah, Khusru - Eskdale, J. - Wiese, A. - Gallagher, G. - Friedrich, M. -
Sterry, W. (2001): Interleukin-10 Promoter Polymorphism in Psoriasis. Journal
of Investigative Dermatology. 116, 975-978.
Asumalahti, Kati - Laitinen, T. - Itkonen-Vatjus, R. - Lokki, M.-L. - Suomela,
S. -Snellman, E. - Saarialho-Kere, U. - Kere, J. (2000): A Candidate Gene for
Psoriasis near HLA-C, HCR (Pg8), Is Highly Polymorphic with a
Disease-Associated Susceptibility Allele. Human Molecular Genetics. 9,
1533-1542.
Asumalahti, Kati - Ameen, M. - Suomela, S. - Hagforsen, E. - Michaelsson, G. -
Evans, J. - Munro, M. - Veal, C. - Allen, M. - Leman, J. - Burden, A. D. -
Kirby, B. - Connolly, M. - Griffiths, C. E. M. - Trembath, R. C. - Kere, J.
-Saarialho-Kere, U. - Barker, J. N. W. N. (2003): Genetic Analysis of PSORS1
Distinguishes Guttate Psoriasis and Palmoplantar Pustulosis. Journal of
Investigative Dermatology. 120, 627-632.
Balendran, Nalini - Clough, R. L. - Arguello, J. R. - Barber, R. - Veal, C. -
Jones, A. B. - Rosbotham, J. L. - Little, A.-M. - Madrigal, A. - Barker, J. N.
W. N. - Powis, S. H. - Trembath, R. C. (1999): Characterization of the Major
Susceptibility Region for Psoriasis at Chromosome 6p21.3. Journal of
Investigative Dermatology. 113, 322-328.
Bata-Csorgo Zsuzsanna - Hammerberg, C. - Voorhees, J. J. et al. (1995):
Kinetics and Regulation of Human Keratinocyte Stem Cell Growth in Short-term
Primary Ex Vivo Culture. Cooperative Growth Factors from Psoriatic Lesional T
Lymphocytes Stimulate Proliferation among Psoriatic Uninvolved, But Not Normal,
Stem Keratinocytes. Journal of Clinical Investigation. 95, 317-327.
Bos, Jan D. - De Rie, Menno A. (1999): The Pathogenesis of Psoriasis:
Immunological Facts and Speculations. Immunology Today. 20 40-46.
Bowcock, Anne M. - Shannon, W. - Du, F. - Duncan, J. - Cao, K. - Aftergut, K.
-Catier, J. - Fernandez-Vina, M. A. - Menter, A. (2001): Insights into
Psoriasis and Other Inflammatory Diseases from Large-scale Gene Expression
Studies. Human Molecular Genetics. 10, 1793-805.
Csikós Márta - Szalai Z. - Becker K. - Sebők B. - Schneider I. - Horváth A. -
Kárpáti S. (2004): Novel Keratin 14 Gene Mutations in Patients from Hungary
with Epidermolysis Bullosa Simplex. Experimental Dermatology. 13, 185-191.
Dellambra, Elena - Prislei, S. - Salvati, A. L. - Madeddu, M. L. - Golisano, O.
- Siviero, E. - Bondanza, S. - Cicuzza, S. - Orecchia, A. - Giancotti, F. G. -
Zambruno, G. - De Luca, M. (2001): Gene Correction of Integrin Beta4-Dependent
Pyloric Atresia-Junctional Epidermolysis Bullosa Keratinocytes Establishes a
Role for Beta4 Tyrosines 1422 and 1440 in Hemidesmosome Assembly. Journal of
Biological Chemistry. 276, 41336-41342.
Gonzalez, Segundo - Martinez-Borra, J. - Sanchez del Río, J. - Santos-Juanes,
J. - Lopez-Vazquez, A. - Blanco-Gelaz, M. - López-Larrea, C. (2000): The OTF3
Gene Polymorphism Confers Susceptibility to Psoriasis Independent of the
Association of HLA-Cw*0602. Journal of Investigative Dermatology. 115, 824-828.
Liu, Wen-Man - Chu, W-M. - Choudary, P. V. - Schmid, C. W. (1995): Cell Stress
and Translational Inhibitors Transiently Increase the Abundance of Mammalian
SINE Transcripts. Nucleic Acids Research. 23, 1758-1765.
Martignetti, John A. - Brosius, Jürgen (1993): BC200 RNA: A Neural RNA
Polymerase III Product Encoded by a Monomeric Alu Element. Proceedings of the
National Academy of Sciences of the USA. 90, 11563-11567.
McGrath John A. (2004) Translational Benefits from Research on Rare
Genodermatoses. The Australasian Journal of Dermatology. 2, 89-93.
Nagy N. - Szolnoky Gy. - Szabad G. - Bata-Csörgő Zs. - Dobozy A. - Kemény L.
Széll M (közlésre elfogadva): Single Nucleotide Polymorphisms of the Fibroblast
Growth Factor Receptor 2 Gene in Patients with Chronic Venous Insufficiency
with Leg Ulcer. Journal of Investigative Dermatology.
Oka, Akira - Tamiya, G. - Tomizawa, M. - Ota, M. - Katsuyama, Y. - Makino, S. -
Shiina, T. - Yoshitome, M. - Iizuka, M. - Sasao, Y. - Iwashita, K. - Kawakubo,
Y. - Sugai, J. - Ozawa, A. - Ohkido, M. - Kimura, M. - Bahram, S. - Inoko, H.
(1999): Association Analysis Using Refined Microsatellite Markers Localizes a
Susceptibility Locus for Psoriasis Vulgaris within a 111 kb Segment Telomeric
to the HLA-C Gene. Human Molecular Genetics. 8, 2165-2170.
Reich, Kristian - Mossner, R. - Konig, I. R. - Westphal, G. - Ziegler, A. -
Neumann, C. (2002): Promoter Polymorphisms of the Genes Encoding Tumor Necrosis
Factor-alpha and Interleukin-1-Beta Are Associated with Different Subtypes of
Psoriasis Characterized by Early and Late Disease Onset. Journal of
Investigative Dermatology. 118, 155-163.
Russell, Thomas J. - Schultes, L. M. - Kuban, D. J. (1972): Histocompatibility
(HL-A) Antigens Associated with Psoriasis. The New England Journal of Medicine.
287, 738-740.
Swanbeck, Gunnar - Inerot, A. - Martinsson, T. - Enerback, C. - Enlund, F. -
Samuelsson, L. - Yhr, M. - Wahlstrom, J. (1997): Genetic Counselling in
Psoriasis: Empirical Data on Psoriasis among First-Degree Relatives of 3095
Psoriatic Probands. British Journal of Dermatology. 137, 939-942.
Széll Márta - Bata-Csörgő Zs. - Koreck A. et al. (2004): Proliferating
Keratinocytes Are Putative Sources of the Psoriasis Susceptibility-Related EDA
(Extra Domain A of Fibronectin) Oncofetal Fibronectin. Journal of Investigative
Dermatology. 123, 537-546.
<-- Vissza a 2005/6 szám tartalomjegyzékére
<-- Vissza a Magyar Tudomány honlapra
[Információk] [Tartalom] [Akaprint Kft.]


