1. ábra
A terhesség alatt a magzat zavartalanul fejlődik egészen a szülés megindulásáig, annak ellenére, hogy az anyától genetikai és immunológiai szempontból eltér, ezért az anya immunrendszere idegenként ismeri fel. A magzat felerészben apai, az anya számára idegen antigéneket hordoz, így várható lenne, hogy az anyai immunrendszer megtámadja és elpusztítja a magzati szövetet. Jelenlegi ismereteink szerint azonban a magzat jelenlétének immunológiai felismerése nem veszélyezteti a terhességet. A felismerést követően az anya és a magzat között immunológiai párbeszéd indul meg, ami kialakítja a magzatnak kedvező immunológiai környezetet.
A proteomika és a genomika módszereinek alkalmazása forradalmi változásokat eredményezhet a terhességgel kapcsolatos kutatásban. A microarray technika lehetőséget nyújt a cytokintermeléssel, illetve a növekedéssel kapcsolatos génexpressziós profilok tanulmányozására. Egyre több, a placentáció különböző fázisaiban szerepet játszó cDNS és fehérje válik ismertté, és ezek révén számos, a placentális pathológiával kapcsolatos új információhoz jutunk.
Az anya és magzata immunológiai viszonyát döntően az első találkozás határozza meg. Az immunválasz minősége és mértéke attól függ, hogy a magzatra jellemző antigének milyen környezetben jelennek meg, milyen módon kerülnek bemutatásra az immunrendszer sejtjei számára.
1.) A terhesség immunológiai felismerése és az ezzel kapcsolatos problémák
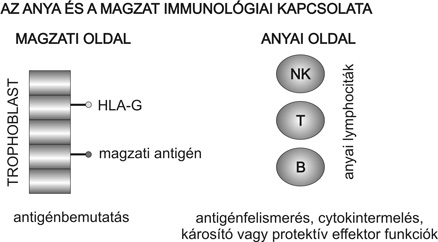
Az emberi méhlepényben a magzati eredetű trofoblaszt sejtek képezik az anyai és magzati felszínek közötti érintkezési határfelületet. Ezek, a magzatra jellemző antigéneket hordozó sejtek a terhesség alatt folyamatos kapcsolatban állnak az anyai vérrel illetve szövetekkel, és így elsőrendűen itt van lehetőség a magzati antigének anyai limfociták általi felismerésére, másrészt a trofoblaszt lehet az anyai immunválasz támadásának célpontja (1. ábra).
Az egyén immunológiai ujjlenyomatának tekinthető polimorf szövetegyezési (HLA) antigének teszik lehetővé, hogy az immunrendszer a saját és idegen struktúrákat megkülönböztesse. Minél nagyobb az eltérés két egyén között ezeknek az antigéneknek a szerkezetében, annál kevésbé tolerálják egymás szöveteit. A trofoblasztról hiányoznak a polimorf HLA antigének, jelen van azonban - a szervezetben szinte egyedülálló módon - egy nem klasszikus HLA antigén, a HLA-G. A HLA-G gén szerkezete hasonló a többi I osztályú HLA gének szerkezetéhez, de azokkal ellentétben korlátozottan polimorf, sajátos promoter régióval rendelkezik, és a mRNS változatos szeletelése következtében több különböző membránhoz kötött vagy szolúbilis izoformát produkál. Az a négy izoforma, mely membránhoz kötött formában expresszálódik transzmembrán és cytoplazmikus domainnel rendelkezik. Két másik izoforma (a szolúbilis HLA-G1 és G-2) negyedik intronjában található stop kódon megakadályozza a transzmembrán és a cytoplazmikus domain transzlációját. Ennek hiányában a molekula nem tud b-2-mikroglobulinnal kapcsolódni, ezért a sejt felszínén csak a teljes hosszúságú HLA-G1 fejeződik ki (Le Bouteiller et al., 2003). A szolúbilis HLA-G kulcsfontosságúnak tűnik a terhesség fenntartása szempontjából. Azon embriók implantálódnak sikeresen, amelyek aktívan szekretálják a szolúbilis HLA-G-t (Fuzzi et al., 2002). Aberráns HLA-G expressziót mutattak ki terhességi toxaemiában habituális vetélésben és in vitro megtermékenyítés sikertelen eseteiben is. Általánosságban elmondható, hogy a szolúbilis HLA-G jelenléte vagy hiánya összefüggést mutat az implantáció sikerével.
A HLA-G expresszióban megfigyelhető különbségek genetikailag meghatározottak. A HLA-G-t kódoló gén 8. exonjának 3'-nem transzlalódó régiójában található egy 14 bp hosszúságú szakaszt érintő deléciós polimorfizmus (Hviid et al., 2004 ). Ez a 14 bp szakaszra kiterjedő deléció vagy inzerció összefüggésbe hozható a mesterséges megtermékenyítés sikertelenségével, és a habituális vetélés fokozott kockázatával, ennek a 14 bázispár hosszúságú szakasznak a jelenléte vagy hiánya ugyanis befolyásolja a termelődő izoformák minőségét, és így meghatározza a membránhoz kötött, illetve szolúbilis HLA-G arányát, következményesen a HLA-G immunmoduláló hatását. A habituálisan vetélő nők férjeinek jelentős részében a HLA-G alléleken hiányzik ez a 14 bp hosszúságú szekvencia, míg feleségeik túlnyomó részében a 14 bp szekvenciát tartalmazó homozigóta HLA-G allélek találhatók (Hviid et al., 2004 ). Ez a genetikai kombináció a magzat, illetve a trofoblaszt által expresszált HLA-G izoformák megváltozott profilját, bizonyos HLA-G izoformák fokozott illetve csökkent expresszióját eredményezi.
A HLA-G több lehetséges funkciója révén befolyásolhatja a terhesség kimenetelét.
a.) A HLA-G immunmoduláló hatása
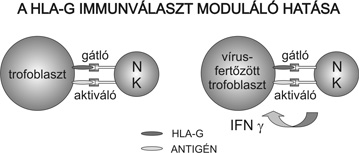
A trofoblaszton kifejeződő magzati antigének, illetve egyéb molekulák kölcsönhatásba lépnek az anya immunsejtjein található receptorokkal. A limfociták azokat az idegen antigént hordozó sejteket támadják meg, melyeken az idegen a sajátot reprezentáló klasszikus HLA antigén környezetében jelenik meg. A T-limfociták klasszikus HLA antigének hiányában nem képesek felismerni az idegen struktúrákat, ezért aktiválódás helyett programozott sejthalálnak esnek áldozatul, és nem pusztítják el a trofoblasztot. A limfociták más csoportjai, a természetes ölősejtek (NK) gátló és aktiváló receptorok segítségével ismerik fel az eliminálandó sejtet (2. ábra).
Az aktiváló receptor az idegen antigént ismeri fel, ezzel egyidejűleg a gátló receptor letapogatja a sejt felszínét, a sajátra utaló struktúrákat keresve. Ha talál ilyent, a gátló jel felülírja az aktivációs szignált, ilyen módon akadályozva meg a saját struktúrák károsítását. A HLA-G mind a gátló, mind az aktiváló NK-sejt receptorokkal képes kölcsönhatásba lépni, így modulálja a deciduális NK-aktivitást. Egyrészt védi a trofoblasztot az NK-sejtek cytotoxikus hatásától, másrészt viszont az aktiváló receptorokkal való kölcsönhatás révén szerepet játszhat az intrauterin vírusfertőzésekkel szembeni védekezésben.
b.) A HLA-G szerepe a congenitalis vírusfertőzések elleni védelemben
A HLA-G szerepet játszhat az intrauterin vírusfertőzések elleni lokális védekezésben is. A vírusok immunválaszt kikerülő stratégiáinak egyike az I osztályú HLA antigének expressziójának gátlása, ugyanis ezen antigének hiányában lehetetlenné válik a vírussal fertőzött sejtek idegenként való felismerése. A veleszületett fejlődési rendellenességek egyik leggyakoribb okozója a humán cytomegalovirus több olyan rövid glycoproteint (unique short protein - US) kódol, amelyek megakadályozzák a HLA-en keresztüli antigénbemutatást. A vírus által termelt US peptidek down regulálják a klasszikus HLA antigéneket, a HLA-G azonban a molekula rövid cytoplasmatikus domainje miatt ellenálló ezzel a hatással szemben (Pizzato et al., 2004). A vírusfertőzés csökkenti ugyan a HLA-G expresszióját, de lényegesen később, és kisebb mértékben, mint a klasszikus HLA antigének expresszióját. A HLA-G még 24 órával a vírusfertőzés után is jelen van, és kapcsolódik a deciduális NK-sejtek felszínén jelen levő, aktiváló KIRDL4 receptorral, melynek következményeképpen az NK-sejtek antivirális hatású interferon gamma-t (IFNgamma) termelnek. A fertőzés későbbi szakaszában a HLA-G expresszió csökkenése miatt megszűnik a gátló receptorok interakciója az NK-sejtekkel, ami tovább fokozhatja az NK-aktivitást. A fenti mechanizmusok révén a HLA-G által modulált NK effektor funkciók fontos szerepet játszanak a fertőzött sejtek eliminálásában.
2.) Az anyai immunválasz
A magzatra jellemző antigének felismerését követően az anyai immunrendszer funkciója, többek közt a cytokintermelés mintázata megváltozik. A cytokinek alacsony molekulasúlyú fehérjék, melyek fontos szerepet játszanak az immunrendszer sejtjei közötti információáramlásban, illetve a sejtek érésének és szaporodásának szabályozásában.
A cytokinek funkciójuk szerint két csoportba oszthatók. A Th1 cytokinek fokozott sejt-közvetítette immunválaszt indukálnak (T-sejt és NK-sejt aktivitás), míg a (Th2) csoportba tartozó cytokinek túlsúlya megnövekedett humorális választ (ellenanyagtermelést) eredményez. Egészséges emberben a kórokozók elleni hatékony védekezés szolgálatában a Th1 csoportba tartozó cytokinek enyhe túlsúlya mutatható ki.
Terhesség alatt a cytokintermelés egyensúlya Th2 irányban tolódik el. Mindezek következtében az immunglobulin-termelés fokozott, a sejt-közvetítette válaszadási készség, különösen az NK-aktivitás csökkent mértékű lesz.
A foetoplacentális egység anyai és magzati oldala cytokineken keresztül kommunikál. Az anya által termelt cytokinek befolyásolják a méhlepény növekedését, a magzat által kifejezett idegen antigének milyensége viszont meghatározza az anya által termelt cytokinek minőségét. A normális lefolyású terhességből származó trofoblaszt sejtekkel stimulált limfociták Th2 típusú cytokineket termelnek. Vetélésből származó trofoblaszt sejtek azonos körülmények között Th1 típusú választ indukálnak.
A Th1 cytokinek a terhesség kimenetele szempontjából kedvezőtlen hatásúak. Az Th1 csoportba tartozó gamma interferon (IFN gamma) cytotoxikus T-limfocitákat és NK-sejteket aktivál, melyek károsíthatják a magzatot. Az IFN gamma gátolja a trofoblaszt növekedését, illetve a Th2 cytokineket termelő sejtek szaporodását, következésképp a Th2 sejtek által indukált immunglobulintermelést is.
Egy másik Th1 cytokin, a TNF és a magzati károsodás közötti kapcsolat is ismert. TNF-alfa-val történő kezelés egérben a terhesség megszakadásához vezet. Szokványosan vetélő nőkben emelkedett TNF alfa szint mutatható ki, ami arra utal, hogy ezen cytokinek szintén közrejátszhatnak a szokványos vetélés kialakulásában.
A Th1 válasz kedvezőtlen hatásával szemben a foetoplacentális egység Th2 típusú cytokinek termelésével védekezik. Az utóbbi csoportba tartozó IL-10 egy 35-40 kDa molekulasúlyú fehérje, melyet T- és B-sejtek egyaránt termelnek. Az IL-10 terhesség alatti hiánya a magzati fejlődés szempontjából előnytelen. Az IL-10 hiányos egerek súlyos károsodásokkal születnek, nagyságuk pedig az ugyanazon anyától született többi egérnek csak kétharmada. A magzati károsodás kivédhető az anyák IL-10 kezelésével, ill. a Th1 cytokinek semlegesítésével (Kuhn et al., 1992).
A normális magzati fejlődést nagymértékben befolyásolja a cytokintermelés egyensúlya. A jelenleg elfogadott koncepció szerint a Th2 irányban eltolt cytokintermelés kedvező, míg a Th1 túlsúly kedvezőtlen a terhesség kimenetele szempontjából. A gén microarray technika új utakat nyitott a placentális cytokintermelés vizsgálatában. Gerard Chaouat és munkatársai rávilágítottak, hogy az egér placentafejlődése során változó mértékben aktiválódnak különböző cytokin gének, közülük egyesek jelenléte például a pete beágyazódásának időszakában elengedhetetlen a normális implantációhoz (Chaouat et al., 2003). A terhesség előrehaladásával differenciáltan expresszálódó gének között egyaránt előfordulnak Th1 és Th2 cytokinek. Ez a meglepő felfedezés megkérdőjelezi azt a klasszikus elméletet, amely szerint a Th1 válasz előnyös, a Th2 válasz pedig káros a terhesség fennmaradása szempontjából. Kritikával kell azonban vizsgálni ezeket az új eredményeket is. A módszer korlátai közé tartozik többek közt, hogy gén array technikával vizsgálva, gyakran még egy homogén szövetminta különböző részei is más eredményt adhatnak, továbbá figyelembe kell venni azt a tényt, hogy a placenta különböző limfocitapopulációk mellett számos egyéb sejtféleséget tartalmaz, melyek funkciói, így cytokintermelése is hormonális szabályozás alatt állnak. Arról sem szabad megfeledkeznünk, hogy az egér terhességvizsgálata során nyert adatok csupán korlátozásokkal extrapolálhatók az emberi szituációra. Ezek az új eredmények tehát nem kérdőjelezik meg a korábbi, perifériás Th2 túlsúlyra utaló adatokat, de árnyalják a képet, és rámutatnak arra, hogy a periférián észlelt változások gyakran más irányúak, mint azok, melyek lokálisan a foeto-maternális határon zajlanak.
Pathológiás terhességek immungenomikai alapjai
Emberben a normális placentális fejlődés különböző szakaszaiban expresszálódó gének nem vizsgálhatók, hiszen normális terhességből származó mintát kizárólag korai, elektív terhességmegszakításból lehetséges nyerni, ezért főképpen a pathológiás és egészséges terhesség összehasonlításáról kaphatunk információt.
A normális terhesség során differenciáltan kifejeződő gének közül több fokozottan expresszálódik toxaemiás terhességben. Normális és pre-eclampsiás terhességből származó placenták összehasonlítása során 221 cytokin-asszociált gén között 162 olyat találtak, melyek expressziójában kétszeres különbség mutatkozott a két csoport között. Ezek között túlnyomórészt Th1 cytokin gének, például néhány, a TNF receptor családhoz tartozó gén (TNF és TNF receptorok) expressziója fokozódik jelentősen a pre-eclampsiás placentában (Chen et al., 1996). Elképzelhető, hogy a Th1 cytokin gének up regulációja szerepet játszik a pre-eclampsia pathogenezisében.
Habituális vetélés
Mind állatokban, mind emberben azok a terhességek sikeresek, amelyekben az anyai és apai HLA antigének különböznek. A HLA gének különbözősége a párválasztásban is szerepet játszik. A szaglóreceptorok génjei a HLA gének közelében helyezkednek el, és azokkal együtt öröklődnek. Állatokban jól ismert a szaglás párválasztásban játszott szerepe, az azonban nem köztudott, hogy a szag alapján történő választás egyben a célszerűséget, a genetikai szempontból legmegfelelőbb partner kiválasztását szolgálja.
Az apa és az anya genetikai különbözősége, túlmenően azon, hogy megakadályozza a genetikai hibák halmozódását, lehetővé teszi a terhesség immunológiai felismerését is, ami elősegíti a terhesség normális lefolyását biztosító, a magzat számára kedvező immunológiai környezet kialakulását.
Habituális vetélőknek azokat az asszonyokat nevezzük, akiknek korábban három vagy több spontán vetéléssel végződő terhességük volt. Az ilyen betegek jelentős részében a genetikai hibák, hormonális és anatómiai rendellenességek kizárása után nem találunk magyarázatot az idő előtti terhességmegszakadás ismételt előfordulására. Megfigyelték azonban, hogy bizonyos HLA alloantigénekkel szignifikánsan gyakrabban társul habituális vetélés, mint másokkal. Ilyen hajlamosító gének előfordulnak a II. osztályú HLA antigéneket, továbbá a HLA-G-t, illetve bizonyos I osztályú HLA antigéneket kódoló gének között. A HLA-DR1, -DR3 és -DR4 jelenléte szignifikánsan magasabb habituális vetélőkben, mint a kontrollpopulációban. Christina Kruse és munkatársai (2004) adatai szerint a habituálisan vetélő asszonyok között szignifikánsan magasabb a HLA-DRB1* 03 antigénnel rendelkezők előfordulása, mint az egészséges kontrollok között. A legalább négy spontán vetélésen átesett nőkben még szorosabb az összefüggés ezzel HLA-allotípussal. Kilencvennégy habituálisan vetélő nő követéses vizsgálata során a HLA-DR1 és/vagy HLA-DR3 pozitív nők 62 %-ának terhessége végződött vetéléssel, míg az egyéb allotípusú habituális vetélőkben csak 29 % volt a vetélések aránya (Kruse et al., 2004). A habituálisan vetélő nők HLA-DR1 vagy DR3 pozitív testvéreinek ötször akkora az esélye a vetélésre, mint HLA-DR1 és DR3 negatív rokonaiknak. Feltehető, hogy ezek a másodosztályú allélek egyes cytokinek hyperszekrécióját előidéző változásokhoz vezetve hajlamosítanak a terhesség idő előtti megszakadására.
A fenti adatok alapján nyilvánvaló, hogy az immunogenomika módszertárának kihasználásával nyerhető eredmények új megvilágításba helyezik az anya és magzata immunológiai kapcsolatáról kialakult klasszikus elképzelést. Várható, hogy ennek alapján idővel új, a pathológiás terhességek kezelésére alkalmas megoldások születnek.
Összefoglalás
Tekintve, hogy a magzat az anya számára immunológiailag idegen, a terhesség normális lefolyásának feltétele egy, a magzat zavartalan fejlődését biztosító kedvező immunológiai környezet kialakítása. Ennek a folyamatnak első lépése a magzati antigének anyai immunrendszer általi felismerése. Ebben, és a megfelelő válasz kialakításában fontos szerepet játszik egy, nem klasszikus HLA molekula, a korlátozott polimorfizmusú HLA-G, melynek különböző méretű és funkciójú szolúbilis vagy membránhoz kötött izoformái alakítják a lokális immunológiai környezetet, és szerepet játszanak az intratuterin fertőzésekkel szembeni védekezésben. A HLA-G expresszió genetikailag meghatározott. A gén adott helyein található öröklött vagy mutáció következtében kialakult változások határozzák meg, milyen izoformák termelődnek, milyen arányban képződik szolúbilis és membránhoz kötött forma.
A felismerés után megváltozott cytokintermelés profiljáról kialakult eddigi ismereteinket részben megerősítették, részben módosították a gén array technika nyújtotta lehetőségek. Meglepő módon több, korábban egyértelműen károsnak tekintett cytokin gén aktiválódik a méhlepényben normális terhesség során, mégis egyértelmű különbség mutatható ki ezen gének aktiváltsági fokában pathológiás és normális terhesség között, az előbbiek javára. A habituális abortuszok genetikai vizsgálata során vált nyilvánvalóvá, hogy bizonyos HLA allotípusok szokványos vetéléssel társultan fordulnak elő. Feltehető, hogy ezek az allélek bizonyos, a terhesség kimenetele szempontjából kedvezőtlen hatású cytokinek hyperszekrécióját idézik elő, és ilyen módon hozzájárulnak a terhesség idő előtti megszakadásához.
Kulcsszavak: terhesség, antigénbemutatás, természetes ölősejt, cytokinegyensúly

1. ábra
2. ábra
Irodalom
Chaouat, Gerard - Ledee-Bataille, N. - Zourbas, S. - Dubanchet, S. - Sandra, O. - Martal, J. - Ostojojic, S. - Frydman, R. (2003): Implantation: Can Immunological Parameters of Implantation Be of Interest for Pre-Eclampsia? Journal of Reproductive Immunology. 59, 205-217.
Chen, G. - Wilson, R. - Wang, S. H. - Zheng, H. Z. - Walker, J. J. - McKillop J. H. (1996): Tumor Necrosis Factor Alpha Gene Polymorphism and Expression in Pre-Eclampsia. Clinical and Experimental Immunology. 104, 154-159.
Fuzzi, Beatrice - Rizzo, R. - Criscuoli, L. - Noci, I. - Melchiorri, L. - Scarselli, B. - Bencini, E. - Menicucci, A. - Baricordi, O. R. (2002): HLA-G Expression in Early Embryos Is a Fundamental Prerequisite for the Obtainment of Pregnancy. European Journal of Immunology. 32, 311-315.
Hviid, Thomas Vauvert F. - Rizzo, R. - Christiansen, O. B. - Melchiorri, L. - Lindhard, A. - Baricordi, O. R. (2004): HLA-G and IL-10 in Serum in Relation to HLA-G Genotype and Polymorphisms. Immunogenetics. 56, 135-141,
Kruse, Christina - Steffensen, R. - Varming, K. - Christiansen, O. B. (2004): A Study of HLA-DR and -DQ Alleles in 588 Patients and 562 Controls Confirms That HLA-DRB1*03 Is Associated with Recurrent Miscarriage. Human Reproduction. 19, 1215-1221.
Kuhn, Ralf - Rajewsky, K. - Muller, W. (1992): IL-4 and IL-10 Deficient Mice. 8th International Congress of Immunology. (Abstr.). 03.
Le Bouteiller, Philippe - Legrand-Abravanel, F. - Solier, C. (2003): Soluble HLA-G1 at the Materno-foetal Interface. Placenta. 17, 10-15.
Pizzato, Nathalie - Garmy-Susini, B. - Le Bouteiller, P. - Lenfant, F, (2004): Differential Down Regulation of HLA-G and HLA-A2 or A-3 Cell Surface Expression Following Human Cytomegalovirus Infection. Journal of Reproductive Immunology. 62, 3-15.