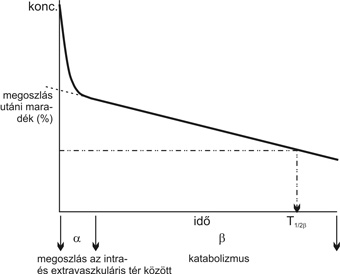
1. ábra * Az IgG kétfázisú kiürülése a keringésből és a béta-fázis (b) felezési idejének (T1/2b) kiszámítása
A legjelentősebb és egyben a vérplazmában legnagyobb mennyiségben jelen levő immunglobulin - az IgG - védelmet biztosít vírusok, baktériumok illetve parazitás fertőzések ellen. Antigénnel történő kapcsolódását követően allergiás és gyulladásos reakciókat vált ki, amellyel aktiválja az immunsejteket és az extravasatio folyamatával a kívánt szöveti helyre "toborozza" őket. Összehangolja az immunrendszer sejtes és humorális faktorait a kórokozók széles spektrumának legyőzése érdekében. Az IgG hiánya (agammaglobulinaemia) - ellentétben más izotípusok (IgM, IgA, és IgE) hiányával - súlyos immundeficienciát, sőt akár letális kimenetelű kórfolyamatokat okoz. E kiemelt szerep zavartalan ellátása érdekében az emlősök összetett folyamatokkal biztosítják az IgG pre-, illetve postnatalis transzportját, azaz a maternális immunitás átadását, valamint a vér mindenkori magas IgG-szintjét.
Történeti áttekintés
Paul Erhlich az 1890-es években fogalmazta meg, hogy az anyai immunitás átadása az újszülöttek egészsége szempontjából alapvető fontosságú annak érdekében, hogy megvédje őket a fertőzéstől életük első néhány hetében, amíg a saját immunvédettségük ki nem alakul (Ehrlich, 1892). Több mint fél évszázaddal később, 1958-ban F. W. Roberts Brambell egy olyan telíthető receptorrendszerről számolt be (valójában az első IgG receptorról), amely az anya utódba irányuló IgG transzportját biztosítja a méhlepényen illetve a vékonybélen keresztül (Brambell et al., 1958). Néhány évvel később ugyancsak ő egy hasonló vagy esetleg azonos receptor létére következtetett, amely megvédi a keringő IgG molekulákat a lebomlástól, és ezáltal biztosítja, hogy a keringés leghosszabb felezési idejű fehérjéi legyenek (1. táblázat; 1. ábra). Az anyai immuntranszport folyamatához hasonlóan ez a mechanizmus is telíthetőnek bizonyult, azaz minél magasabb volt a keringő IgG koncentrációja, annál gyorsabb volt lebomlása a vérpályában (2. ábra). Ebből fakadóan Brambell a fehérjék katabolizmusát egy nem telíthető mechanizmussal, míg az IgG védelmét egy telíthető receptorral magyarázta. Ennek alapján a sejtekbe nem-specifikus endocitózissal felvételre került makromolekulák közül az IgG-t a receptor specifikusan visszajuttatja a véráramba, míg a többi fehérje a sejtben degradálódik (Brambell et al., 1964). Az ötvenes-hatvanas években végzett farmakokinetikai vizsgálatok arra az eredményre vezettek, hogy a legtöbb plazmafehérje, így az IgG is, a vérpálya mentén bomlik le, és egyetlen szerv sem játszik kitüntetett szerepet ebben a folyamatban. Mindezek alapján Thomas Waldman és Warren Strober 1969-ben arra a következtetésre jutottak, hogy a plazmafehérjék lebomlása, illetve az IgG védelme a kapillárisok endotélsejtjeiben zajlik (Waldmann - Strober, 1969).
A neonatalis Fc receptor (FcRn)
A maternális immuntranszport és az IgG katabolizmus folyamatainak biztosítását ugyanaz a receptor - FcRn - valósítja meg, amely az evolúció során e két funkcióhoz és sejttípushoz rendkívüli mértékben adaptálódott. Az FcRn szerkezetileg az MHC-I molekulával szoros rokonságot mutat, vagyis egy három alegységből álló, a sejtmembránban "horgonyzó" nehézláncból és a hozzá másodlagos kötőerőkkel kapcsolódó beta-2 mikroglobulinból (beta2m; könnyűlánc) álló heterodimer (3. ábra). A receptor pH-függő módon, enyhén acidikus környezetben megköti az IgG molekulát, míg semleges-enyhén bázikus közegben disszociál az IgG/FcRn komplex (West - Bjorkman, 2000). E receptort először az újszülött rágcsálók vékonybél enterocitáiból, később azonban számos egyéb epitélsejtből, így a rágcsálók és az ember placentájából, felnőtt emberi vékonybélből, vesehámsejtből és a légutakban is kimutatták. Amint erre korábban utaltunk, a receptor az epitélsejtek mellett az erek endotélsejtjeiben is kifejeződik, ahol az IgG lebomlását szabályozza. Mindkét sejttípusban a sejtek legtöbbször nem-specifikus pinocitózissal veszik fel a makromolekulákat, amelyek ezt követően az endoszómákba, illetve a lizoszómákba kerülnek, és ott az alacsony kémhatás mellett, enzimek révén lebomlanak. A sejtbe került IgG molekula ebből a szempontból kivételnek számít. Amennyiben a sejt FcRn molekulát expresszál, az IgG a korai endoszómális vezikulumokban enyhén acidikus kémhatás mellett specifikusan kapcsolódik a receptorral, és a továbbiakban - az intracelluláris lebomlást elkerülvén - transzcitózissal a sejt ellenoldalára kerül (epitélsejt), vagy visszajut a keringésbe (endotélsejt) (4. ábra) (Ghetie - Ward, 2002).
Mindezen ismereteknek jelentős humánterápiás vonzatai is vannak. Ismert, hogy egyes autoimmun betegségekben, amikor a szervezet saját anyagai ellen termelődik ellenanyag (főleg IgG), a nagy mennyiségben beinjektált IgG (intravénás immunglobulin - IVIG - terápia) jótékony hatású lehet, hiszen általánosan rövidíti valamennyi IgG molekula keringési idejét, és így a kóros immunglobulinok lebomlása is gyorsabb. A molekuláris biológiai technológiák mellett lehetőség nyílt arra is, hogy az IgG Fc részének célzott mutációjával fokozzák az IgG FcRn kötési képességét, és ezáltal hosszabb életidejű immunglobulin molekulákat állítanak elő, amelyeket például a daganatok immunterápiájára lehet használni (Hinton et al., 2004).
A két ismertetett sejttípus mellett az FcRn jelenlétét további sejttípusokból, így a májsejtekből, monocitákból, makrofágokból és dendritikus sejtekből is kimutatták, bár ezek funkciójáról jóval keveset tudunk.
A szarvasmarha FcRn szöveti kifejeződése és funkciója
A szarvasmarhában az IgG termelődése, immunfolyamatokban betöltött szerepe alapvetően megegyezik a többi emlősállatokkal összehasonlítva. Az IgG1 és IgG2 alosztályokat elemezve megállapítható, hogy vérbeli koncentrációjuk csaknem megegyezik, és együttes szérumkoncentrációjuk átlagosan 20 mg/ml. A szarvasmarha IgG vérpályán belüli feleződési üteme a többi emlősállatéhoz hasonlóan mintegy 15-20 nap, és ezzel lényegesen meghaladja a vérbeli IgA, IgM molekulák (3,5-4 nap) félélet idejét. A hasonlóságok mellett a kérődző állatok IgG metabolizmusának jellegzetes különbsége, hogy az IgG1 molekula számos nyálkahártya felszínére (tőgy, vékonybél, alsó légutak, uterus) szekretálódik és ott - az IgA protektív hatását kiegészítve - hatékonyan részt vesz az immunvédelemben. Az elmúlt években igazoltuk, hogy bár az ellés előtt és azt követően is ki lehet mutatni az FcRn jelenlétét a tőgy acinus sejtjeiben, a receptorsejten belüli lokalizációjában jellegzetes különbség figyelhető meg. Míg az ellés előtti időszakban a receptor diffúzan tölti ki a citoplazmát, addig azt követően a hámsejtek lumen felőli oldalán található. Minthogy a tőgy acinus sejtjeiben a korábbiakban csak IgG1 molekulákat detektáltak, feltételezzük, hogy a szarvasmarha FcRn is ezeket a molekulákat köti és szekretálja (Kacskovics et al., 2000; Kacskovics, 2003; Mayer et al., 2005). A receptor szekréciós tevékenységének megerősítésére további szöveteket elemeztünk, amelyekben a korábbi vizsgálatok szintén IgG1 szekréciót mutattak ki. Vizsgálataink során az FcRn kifejeződését a vékonybél kriptasejtjeiben (Mayer et al., 2002), illetve az alsó légutakban is detektáltuk (Mayer et al., 2004).
Tekintettel arra, hogy a többi immunglobulinhoz képest mindkét IgG alosztálynak - ebben az állatfajban is hosszú a felezési ideje - feltételeztük, hogy az FcRn ebben az állatfajban is expresszálódik az endotélsejtekben és védi az IgG molekulákat a gyors lebomlástól. Míg az endotélsejtek FcRn expresszióját immunhisztokémiai vizsgálatokkal igazoltuk (5. ábra), addig az FcRn IgG katabolizmusát befolyásoló szerepét funkcionális elemzésekkel erősítettük meg. Ennek kapcsán először kimutattuk, hogy a 125I jelölt emberi IgG hatékonyan kapcsolódik a szarvasmarha FcRn receptorhoz, sőt ez az interakció lényegesen erősebb, mint a szarvasmarha IgG-FcRn kapcsolat. Tekintettel arra, hogy más állatfajban végzett vizsgálatok közvetlen összefüggést mutattak az IgG-FcRn kapcsolat erősségére, és az IgG felezési idejére vonatkozóan (azaz minél erősebb a kapcsolat, annál hosszabb a felezési idő), feltételeztük, hogy az emberi IgG felezési ideje szarvasmarhában meghaladja a szarvasmarha IgG félélet idejét (Ghetie - Ward, 2002). Természetesen egy idegen immunglobulin befecskendezése a szarvasmarhába immunreakciót vált ki (azaz humán IgG specifikus ellenanyagok jelennek meg), amelyek lényegesen befolyásolják a folyamat értékelését. E nemkívánatos folyamatot úgy tudtuk elkerülni, hogy a humán immunglobulint olyan klónozott borjakba fecskendeztük, amelyek kis mennyiségben maguk is emberi immunglobulint termelnek (vagyis az emberi immunglobulinok számukra nem számítanak idegen fehérjének), mivel az emberi nehéz- és könnyűláncokat tartalmazó kromoszómarégiókat hordozzák (Kuroiwa et al., 2002). E kísérleteink alapján egyértelműen igazoltuk, hogy az emberi IgG felezési ideje ezekben az állatokban lényegesen hosszabb, mint a szarvasmarha IgG felezési ideje, vagyis a szarvasmarha FcRn hatékonyan védi meg a keringő IgG molekulákat a lebomlástól. Kísérletünk további jelentősége, hogy kimutattuk a humán IgG védettségét a szarvasmarhában, azaz az említett transzkromoszomális szarvasmarhák nemcsak termelik a humán IgG-t, hanem az FcRn lebomlásukat megakadályozva magas vérszintet is biztosít (Kacskovics et al., 2005).
A szarvasmarha FcRn génregulációs elemzése riportergén technikával
Mindezen vizsgálati eredményeink kapcsán merült fel bennünk az a kérdés, hogy milyen hatások befolyásolják a szarvasmarha FcRn génexpresszióját. E kérdés tisztázása érdekében először klónoztuk és karakterizáltuk a receptor nehézláncának génjét (FCGRT), amely exon-intron szerkezetét tekintve hasonlónak bizonyult a korábban már elemzett humán és egérgénekkel összehasonlítva (6. ábra). Ezt követően a kódoló szakaszt megelőző mintegy 1800 bp hosszú génszakaszt vizsgáltuk. Elemzéseink kapcsán először arra voltunk kíváncsiak, hogy mennyiben hasonlítanak a különböző állatfajok FCGRT promoter szekvenciái. Ismeretes, hogy a promoter szakaszokon található ún. transzkripciós faktorok kötőhelyei kevésbé érzékenyek a kisebb eltérésekre, mint például a fehérjéket kódoló mRNS, illetve a kötőhelyek közötti szakaszok nukleinsav összetétele alapvetően nem befolyásolja a transzkripció hatékonyságát (a köztes szakaszok hosszának lényeges változása azonban természetesen hat rá). Ez magyarázza, hogy az evolúció során a promoter könnyebben változik meg, mint a fehérjét kódoló exonok. Mindezek alapján az egyes állatfajok rokon génjeinek promoter hasonlósági elemzése a transzkripciós faktor kötőhelyek jellege és helye alapján lehetséges (Berezikov et al., 2004). Homológiavizsgálatunk alapján megállapíthattuk, hogy míg a szarvasmarha és a humán FCGRT promoter szakaszai között bizonyos mértékű hasonlóság kimutatható (7. ábra), addig ugyanez nem mondható el a szarvasmarha és az egér, illetve a humán és az egér FCGRT vonatkozásában (ez utóbbi megállapítást mások is megerősítették (Tiwari - Junghans, 2005). Mindezek jól tükrözik a tényt, hogy az egyes állatfajokban expresszálódó FcRn receptorok jellegzetes különbségeket mutatnak sejttípus és a sejtek fejlődésspecifikus vonatkozásában (Tiwari - Junghans, 2005).
Vizsgálataink következő fázisában a szarvasmarha promoter transzkripciós faktor kötőhelyeit elemeztük TESS és TFSEARCH programokkal (a programok a TRANSFAC 4.0 adatbázist használták; [Schug - Overton, 1997; Heinemeyer et al., 1998; Wingender et al., 2001]). Az így kapott lehetséges transzkripciós faktor kötőhelyeket három csoportba soroltuk: 1. "tejfehérje" motívumok: STAT5, NF1, GR/PR, YY1 - amelyeket a legtöbb, tejtermelés kapcsán kifejeződő gén promoterében ki lehetett mutatni; 2. "akut fázis" motívumok: c-Rel, IRF1/IRF2, NF-kappaB, IL-6 - amelyeket számos, az akut fázis idején aktiválódó gén promoterében lehet kimutatni; végül 3. "általános" motívumok: CREB, SP1 - amelyek a transzkripciós aktiváció során bizonyultak nélkülözhetetlennek számos kísérletben (8. ábra).
Hangsúlyozzuk azonban, hogy ezek az elemzések pusztán a kezdeti tájékozódásban segítenek, valódiságukat további kísérletes munkával kell megerősíteni. Ezen az úton haladva a továbbiakban a promoter elemzését az ún. luciferáz rendszerrel vizsgáltuk. Ennek lényege, hogy a promotert egy olyan vektorba illesztettük, amely egyben a luciferáz enzim kódoló szakaszát is tartalmazza (pGL3 vektor). A vektort szarvasmarhasejtekbe transzfektáltuk és a promoter aktivitására az általa indukált luciferáz aktivitásából következtettünk. Esetünkben tehát a luciferáz enzim aktivitását - amelyet a luciferin hozzáadásával luminométerben vizsgáltunk - az előtte álló génszakasz, azaz a szarvasmarha FcRn promotere szabályozza. Előkísérleti elemzéseink alapján az izolált génszakasz promoter jellegűnek bizonyult, mert a luciferáz aktivitás a promoter nélküli "üres" vektorral összehasonlítva kb. harmincszoros emelkedést mutatott (9. ábra).
A bFcRn nehézlánc promoterének számítógépes elemzése igen magas valószínűséggel jelzett egy NF-kappaB kötőhelyet (8. ábra), és ezért transzkripciós faktor kötőhely vizsgálatainkat e kötőhely elemzésével kezdtük meg. Vizsgálataink során HC11 (egér emlőmirigy epitélsejtvonal), JAR (humán trofoblaszt) és HEK293 (humán embrionális vesehám) sejtvonalakba a szarvasmarha FcRn nehézlánc promoterét (luciferáz), s egy olyan konstrukciót transzfektáltunk, amely egy citomegalovírus promoter által expresszióra késztetett p65 fehérjét fejez ki. A p65 az NF-kappaB transzkripciós faktor egyik alegysége, amely vagy homodimer, vagy pedig a sejtekben natív módon is előforduló másik alegységgel (p50) heterodimert képez, és az adott DNS szegmenshez kötődve aktivál (Li - Verma, 2002). Kísérletünk során meggyőződtünk arról, hogy az NF-kappaB fokozza a szarvasmarha promoter aktivitását (10. ábra). Ezt az eredményünket további vizsgálatokkal (az NF-kappaB kötőhely mutációval történő semlegesítése, electromobility shift assay, supershift assay) is megerősítettük.
A szarvasmarha FcRn elemzése transzgén technikával
Mivel az FcRn receptor legalább két eltérő funkció ellátásában vesz részt, nevezetesen a maternális immunitás pre- és postnatális átadása, illetve a vér mindenkori magas IgG szintjének biztosítása, feltételezhető hogy az evolúció során a receptor fehérjeszintézisének szabályozására legalább két, az eltérő szövetspecifitást biztosító mechanizmus alakult ki. Ahhoz, hogy az in vitro kísérletekben azonosított szabályozó elemeket, illetve azok in vivo szerepét vizsgálni tudjuk, olyan transzgenikus állatmodellt kellett létrehoznunk, amely az elméletileg lehetséges legpontosabb módon "másolja le" mind a gén szövet- és fejlődésspecifikus kifejeződését, mind pedig a génről átíródó fehérje mennyiségét. A "hagyományos" transzgén konstrukciókkal létrehozott transzgenikus állatok az ismert szabályozó elemek optimális kombinációja esetében is, döntő többségükben a transzgénintegráció helyétől függő génkifejeződést mutatnak, melyhez igen gyakran ektopikus expresszió (olyan szövetben is kifejeződnek, ahol az endogén gén nem termelődik) és a kópiaszámtól függetlenül változó mennyiségű géntermék keletkezése is társul.
Egy olyan gén esetében, mint a szarvasmarha FcRn receptor, ahol a legfontosabb szabályozó elemekről egyelőre csak korlátozott ismereteink vannak, az egyik lehetséges megoldás egy ún knock in, génkicserélt, transzgenikus állat létrehozása lenne, melyben az FcRn gén kódoló szakaszát kicserélnénk egy könnyen nyomon követhető indikátor génre, például lac Z-re, és ebben a modell állatban próbálnánk választ kapni arra, hogy van-e a szabályozó hatású molekuláknak (például hormonoknak) olyan kombinációja, mellyel az állatot kezelve szövetspecifikus módon befolyásolni tudjuk az FcRn receptor mennyiségét és/vagy fejlődési szakasztól függő megjelenését. Ilyen típusú transzgenikus szarvasmarhát azonban még senkinek sem sikerült létrehoznia, az egér endogén FcRn receptorának ily módon történő vizsgálata pedig azért nem volna célszerű, mert a szarvasmarha (általánosabban a kérődző) FcRn receptor vélhetően olyan tulajdonságokkal is rendelkezik, melyek más fajok, így az egér FcRn receptorára nem jellemzőek. Ilyen például az IgG1 öt-tízszeres koncentrációja a kolosztrumban a szérumhoz képest, melyért feltehetően az FcRn receptor felelős.
Ez esetben tehát az optimális megoldást egy olyan transzgenikus modellállat létrehozása jelenti, amelyben a vélhetően teljes, ún. "expressziós domén" biztosítja a gén integrációs helytől független, kópiaszámfüggő kifejeződését (11. ábra). A mesterséges kromoszómák, illetve mesterséges kromoszóma típusú vektorok (YAC - Mega Yeast Artificial Chromosome, BAC - F-factor-based Bacterial Artificial Chromosome; PAC - P1-derived Artificial Chromosome) alkalmasak nagyméretű genomikus fragmentek befogadására, ezért megfelelőek az általunk tervezett transzgenikus kísérlet vektorának. Mindezek alapján a szarvasmarha FcRn receptor nehézlánc teljes kódoló szakaszát tartalmazó ~100-40 kb méretű BAC klónokat izoláltunk és karakterizáltunk, majd injektálásukkal transzgenikus egérvonalakat állítottunk elő. Mivel az FcRn egy heterodimer molekula - egy nehézlánc és egy könnyűlánc (beta2m) alkotja, hangsúlyoznunk kell, hogy rendszerünkben a szarvasmarha-nehézlánc illetve az egér-könnyűlánc fogja a receptort kialakítani. Korábbi in vitro elemzésünk során azt tapasztaltuk, hogy az egérhez közeli, rokon patkány beta2m funkcionális egységet alkot a szarvasmarha nehézlánccal, és képes az IgG molekulákat specifikusan megkötni (Kacskovics et al., 2000). Ennek alapján feltételezzük, hogy a szarvasmarha FcRn nehézlánc funkcionális FcRn receptort képez az egér beta2m molekulával is, hiszen a patkány és az egér beta2m között nincs értékelhető eltérés a receptor IgG kötőpontján.
A transzgenikus egerek szarvasmarha FcRn nehézlánc expresszióját májból izolált RNS Northern-blot elemzésével ellenőriztük, és megállapítottuk, hogy az FcRn expressziója a vizsgált két vonalban kópiaszámfüggő. Ez az eredmény alátámasztja kezdeti várakozásainkat, azaz a BAC transzgenezis valóban a transzgén által meghatározott, a beépülés helyétől független génkifejeződést eredményez, és lehetővé teszi különböző, génregulációt célzó in vivo kezelések elvégzését.
Következtetések
Eddigi eredményeink azt mutatják, hogy a szarvasmarha neonatalis Fc receptor (FcRn) nemcsak a tőgyben, hanem más szervek azon sejtjeiben fejeződik ki, amelyek a nyálkahártya immunvédelmében közreműködő IgG1 szekrécióját biztosítják. További elemzéseink megerősítették, hogy ez a receptor a szarvasmarha vérér endotélsejtjeiben is kifejeződik, és hasonlóan az eddig vizsgált fajokhoz, megakadályozza a keringő IgG gyors lebomlását. Tisztázásra vár, hogy az epitélsejtekben milyen módon történik az IgG transzcitózisa, milyen tényezők befolyásolják a receptor intracelluláris lokalizációját, és milyen hatással bír a tőgyszövetben tapasztalt átrendeződés a sejtek IgG transzportjára. Fontos kérdés, hogy milyen faktorok befolyásolják a receptor expresszióját ezekben a sejtekben, és hogyan lehetne azt mesterségesen befolyásolni. A további elemzéshez transzgenikus egérvonalakat állítottunk elő, amelyek alkalmasnak tűnnek eredményeink in vivo kísérletekkel történő kiegészítésére, ill. a szervezetben zajló összetett folyamatok pontosabb elemzésére.
Pályázati támogatások: KI - OTKA035209, OMFB-01605/2002; BZS - 01606/2002

1. ábra * Az IgG kétfázisú kiürülése a keringésből és a béta-fázis (b) felezési
idejének (T1/2b) kiszámítása
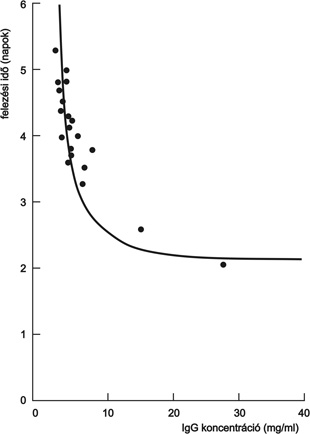
2. ábra * Összefüggés az IgG katabolizmusa és plazma koncentrációja között
egerekben (Brambell et al., 1964)
IgA IgD IgE IgG IgM molekulaméret (kDa) 160, 400 175 190 150 950, 1150 struktúra monomer, monomer monomer monomer pentamer, dimer hexamer valencia 2, 4 2 2 2 10, 12 szérumkoncent- 1,5-2,6 0,04 0,0003 9,5-12,5 0,7-1,7 ráció (mg/ml) szérum 6 3 2,5 23 5 felezési idő
1. táblázat * Az emberi immunglobulin izotípusok jellemzői
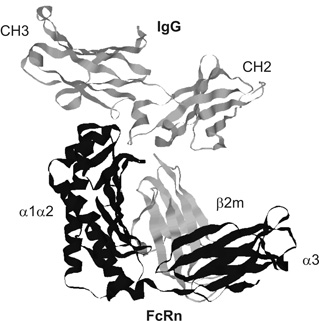
3. ábra * A heterodimer FcRn egy nehézláncból és egy könnyűláncból (beta2m) áll. A
képen a nehézlánc extracelluláris doménjei (alfa1-alfa2-alfa3) látszódnak, a
transzmembrán és citoplazmikus régiót nem tüntettük fel. Az FcRn az IgG CH2-CH3
doménjével kapcsolódik (West - Bjorkman, 2000).
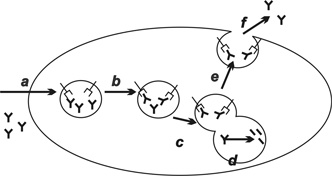
4. ábra * Az FcRn által közvetített IgG-védelem sematikusan. a - az IgG
pinocitózissal a sejtbe kerül (pl. endotélsejt); b - H+ jut az endoszómába,
csökkentve annak kémhatását és lehetővé téve az FcRn-IgG kapcsolódást; c - az
endoszóma a lizoszómával egyesül, de az FcRn-IgG komplex nem kerül a
lizoszómába; d - a nem kötődött IgG-t a lizoszómában a proteázok lebontják; e -
az endoszóma a sejtmembránnal egyesül, ahol az FcRn-IgG komplexet fiziológiás
kémhatás éri; f - a megváltozott kémhatás hatására a komplexből felszabadul az
IgG (Lobo et al., 2004).
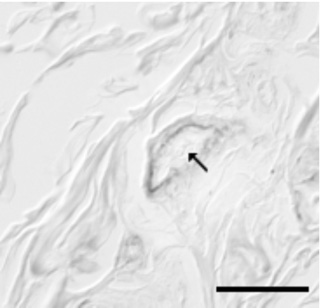
5. ábra * Szarvasmarha FcRn immunhisztokémiai detektálása bőralatti kötőszövet
ereiben (nyíl: ér, horizontális csík: 50 micro m)
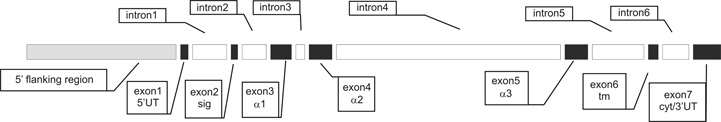
6. ábra * A szarvasmarha FcRn nehézláncának (FCGRT) exon/intron szerkezete
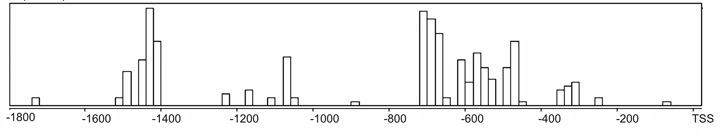
7. ábra * A szarvasmarha és a humán FcRn nehézlánc gén (FCGRT) promoter
szakaszainak elemzése CONREAL programmal (TSS - transzkripciós starthely). Az
oszlopok a két promoter szakasz (1800 bp) pozíció és transzkripciós faktor
szerinti hasonlóságát mutatják.
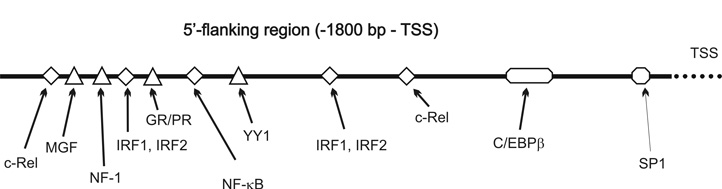
8. ábra * A szarvasmarha FcRn nehézlánc gén (FCGRT) promoter szakaszának
feltételezett transzkripciós faktor kötőhelyei TESS és TFSEARCH programokkal
elemezve.
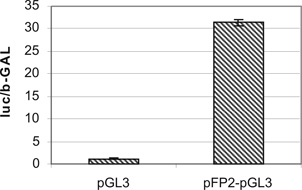
9. ábra * A szarvasmarha FcRn nehézlánc gén (FCGRT) promoter szakaszának
elemzése luciferáz rendszerben. Az izolált mintegy 1800 bp hosszú kódoló régió
előtti génszakasz (bFP2-pGL3) promoter jellegűnek bizonyult, mert a luciferáz
aktivitás a promoter nélküli "üres" vektorral (pGL3) összehasonlítva kb.
harmincszoros emelkedést mutatott.
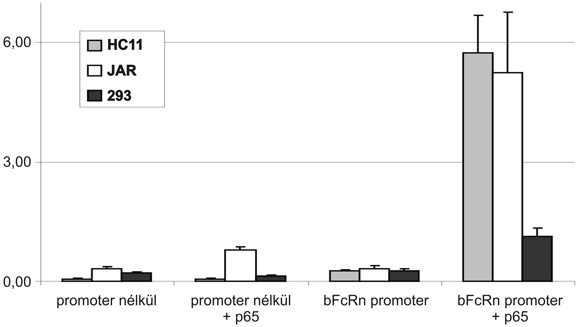
10. ábra * A szarvasmarha FcRn nehézlánc promoter indukálása az NF-kappaB
transzkripciós faktorral (p65) három különböző sejtvonalban.
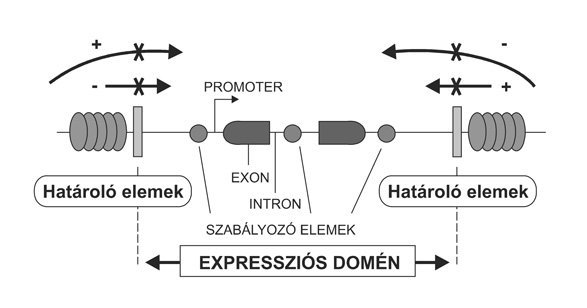
11. ábra * A szövet- és fejlődésspecifikus, magas szintű génkifejeződéshez
szükséges szabályozó elemek bemutatása
Irodalom
Berezikov, Eugene - Guryev, V. - Plasterk, R. H. - Cuppen, E. (2004): CONREAL: Conserved Regulatory Elements Anchored Alignment Algorithm for Identification of Transcription Factor Binding Sites by Phylogenetic Footprinting. Genome Research. 14, 1, 170-178.
Brambell, F. W. Rogers - Halliday, R. - Morris, I. G. (1958): Interference by Human and Bovine Serum and Serum Protein Fractions with the Absorption of Antibodies by Suckling Rats and Mice. Proceedings of the Royal Society of London. Series B. 149, 1.
Brambell, F. W. Rogers - Hemmings, W. A. - Morris, I. G. (1964): A Theoretical Model of Gammaglobulin Catabolism. Nature. 203, 1352-1355.
Ehrlich, Paul (1892): Über Immunität durch Vererbung und Säugung. Zeitschrift für Hygiene und Infektionskrankheiten. 12, 183-203.
Ghetie, Victor - Ward, Elizabeth S. (2002): Transcytosis and Catabolism of Antibody. Immunologic Research. 25, 2, 97-113.
Heinemeyer, Thomas - Wingender, E. - Reuter, I. - Hermjakob, H. - Kel, A. E. - Kel, O. V. - Ignatieva, E. V. - Ananko, E. A. - Podkolodnaya, O. A. - Kolpakov, F. A. - Podkolodny, N. L. - Kolchanov, N. A. (1998): Databases on Transcriptional Regulation: TRANSFAC, TRRD and COMPEL. Nucleic Acids Research. 26, 1, 362-367.
Hinton, Paul R. - Johlfs, M. G. - Xiong, J. M. - Hanestad, K. - Ong, K. C. - Bullock, C. - Keller, S. - Tang, M. T. - Tso, J. Y. - Vasquez, M. - Tsurushita, N. (2004): Engineered Human Igg Antibodies with Longer Serum Half-Lives in Primates. The Journal of Biological Chemistry. 279, 8, 6213-6216.
Kacskovics Imre (2003): A tehéntej immunglobulinja - a jövő precíziós fegyvere a bélfertőzések ellen. Magyar Tudomány. 4, 461-469.
Kacskovics Imre - Kis Z. - Mayer B. - West, A. P. - Tiangco, N. E. - Tilahun, M. - Cervenak, L. - Bjorkman, P. J. - Goldsby, R. A. - Szenci O. - Hammarström, L. (2005): FcRn Mediates Elongated Serum Half-life of Human IgG in the Cattle. The Journal of Immunology. (közlésre benyújtva)
Kacskovics Imre - Wu, Z. - Simister, N. E. - Frenyo L. V. - Hammarstrom, L. (2000): Cloning and Characterization of the Bovine MHC Class I-like Fc Receptor. The Journal of Immunology. 164, 4, 1889-1897.
Kuroiwa, Yoshimi - Kasinathan, P. - Choi, Y. J. - Naeem, R. - Tomizuka, K. - Sullivan, E. J. - Knott, J. G. - Duteau, A. - Goldsby, R. A. - Osborne, B. A. - Ishida, I. - Robl, J. M. (2002): Cloned Transchromosomic Calves Producing Human Immunoglobulin. Nature Biotechnology. 20, 9, 889-894.
Li, Qiutang - Verma, Inder M. (2002): NF-kappaB Regulation in the Immune System. Nature Reviews Immunology. 2,10, 725-734.
Lobo, Evelyn D. - Hansen, R.J. - Balthasar, J. P. (2004): Antibody Pharmacokinetics and Pharmacodynamics. Journal of Pharmaceutical Sciences. 93, 2645-2668.
Mayer Balázs - Doleschall M. - Bender B. - Bartyik J. - Bősze Z. - Frenyó V. L. - Kacskovics I. (2005): Expression of the Neonatal Fc Receptor (FcRn) in the Bovine Mammary Gland. The Journal of Dairy Research. (közlésre elfogadva)
Mayer Balázs - Kis Z. - Kaján G. - Frenyó L. V. - Hammarstrom, L. - Kacskovics I. (2004): The Neonatal Fc Receptor (Fcrn) Is Expressed in the Bovine Lung. Veterinary Immunology and Immunopathology. 98,1-2, 85-89.
Mayer Balázs - Zolnai A. - Frenyó L. V. - Jancsik V. - Szentirmay Z. - Hammarstrom, L. - Kacskovics I. (2002): Redistribution of the Sheep Neonatal Fc Receptor in the Mammary Gland Around the Time of Parturition in Ewes and Its Localization in the Small Intestine of Neonatal Lambs. Immunology. 107, 3, 288-296.
Schug, Jonathan - Overton, G. Christian (1997): TESS: Transcription Element Search System on the WWW. Computational Biology and Informatics Laboratory, School of Medicine, University of Pennsylvania
Tiwari, Bhavana - Junghans, Richard P. (2005): Functional Analysis of the Mouse Fcgrt 5' Proximal Promoter. Biochimica et Biophysica Acta. 1681, 2-3, 88-98. Waldmann, Thomas A. - Strober, Warren (1969): Metabolism of Immunoglobulins. Progress in Allergy. 13, 1-110.
West, Anthony P. Jr. - Bjorkman, Pamela J. (2000): Crystal Structure and Immunoglobulin G Binding Properties of the Human Major Histocompatibility Complex-Related Fc Receptor. Biochemistry. 39, 32, 9698-9708.
Wingender, Edgar - Chen, X. - Fricke, E. - Geffers, R. - Hehl, R. - Liebich, I. - Krull, M. - Matys, V. - Michael, H. - Ohnhauser, R. - Pruss, M. - Schacherer, F. - Thiele, S. - Urbach, S. (2001): The TRANSFAC System on Gene Expression Regulation. Nucleic Acids Research. 29, 1, 281-283.