MOLEKULÁRIS ONKOLÓGIA
A RÁKGENOMIKA ELSŐ ÉVTIZEDÉBEN
Oláh Edit
az MTA doktora, Országos Onkológiai Intézet Molekuláris Genetikai Osztály
e.olah @ oncol.hu
Ma mintegy huszonhét évvel tovább élünk, mint száz évvel ezelőtt. A rákos megbetegedések azonban továbbra is óriási népegészségügyi problémát jelentenek. Sőt, a helyzet további romlásával számolhatunk, mivel a népesség elöregedése miatt a megbetegedések számának tényleges növekedése várható. Ma még a rák a betegek mintegy felének a halálát okozza a gazdaságilag fejlettebb országokban. A kedvezőtlen előrejelzések ellenére minden korábbinál nagyobb lehet a reményünk arra, hogy fordulóponthoz értünk a betegség elleni küzdelemben. Ugyanis a ráksejtek genetikai állományának, génjeinek tanulmányozása az utóbbi években bevezetett új genomikai technológiákkal annyi új ismeretet tárt fel a rák genetikai alapjairól, hogy az új tudás már az előttünk álló évtized(ek)ben az onkológiai klinikai gyakorlat forradalmi átalakítását ígéri.
A referátum a rákkutatás területén az utóbbi évtizedben végbement óriási fejlődést próbálja érzékeltetni, bemutatva a friss tudományos ismeretek első klinikai alkalmazásait és azok perspektíváit. Szó lesz az EU nagy prioritású programjairól, amelyek a genomikai megközelítések révén nyert kutatási eredmények gyors klinikai alkalmazását kívánják elősegíteni a rák legyőzése céljából.
A daganatképződés genetikai/genomikai alapjai
A nyolcvanas évek végéig tartotta magát az a nézet, hogy a rák kialakulásáért szinte kizárólag környezeti és életmódbeli tényezők felelősek. A genetikai tényezők szerepét elhanyagolhatónak ítélték. Valóban igaz, hogy a daganatos betegségek jelentős hányada megelőzhető lenne a provokatív rákkeltő hatások megszüntetésével. Gondoljunk csak a dohányzás ártalmaira a légúti és szájüregi rákok kialakulásában. A 90-es évekre azonban kiderült, hogy a genetikai változások alapvető fontosságúak a sejtek rákos átalakulásában.
Bár a rák rendszerint nem örökletes, mindig génhiba következménye, létrejötte során bizonyos gének mutációja – változása – következtében a sejtek elvesztik ellenőrzésüket a normális sejtosztódás és sejtnövekedés felett.
A rák nem egyetlen gén mutációjának következménye. A rák kialakulása sokkal inkább egy többlépcsős, több gént érintő folyamat, amely magába foglalja az örökletes és környezeti tényezők (például kémiai rákkeltő anyagok) összetett kölcsönhatásait. A rák soktényezős kóreredetét támasztja alá az a tény, hogy előfordulási gyakorisága az életkor előrehaladtával növekszik. Emellett, kimutatott örökletes hajlam esetén sem mindig fejlődik ki a betegség.
Amikor az első génhiba öröklött, a rákot örökletesnek tekintjük. Ezzel ellentétben, nem örökletes ártalmak miatt bekövetkező mutáció esetén a rákot szerzettnek nevezzük, a szerzett daganatok rendszerint sporadikus előfordulásúak. Az örökletes daganatok – a minden testi sejtben jelen lévő öröklött káros mutáció miatt – gyakran családi halmozódást mutatnak, és a daganatos megbetegedések a szerzett daganatokhoz hasonlítva fiatalabb korban alakulnak ki. Az első mutációt továbbiak követik, és a felhalmozódó mutációk túlélési, illetve szaporodási előnyt biztosítanak az érintett sejteknek és végül a kialakult ráksejteknek. Mivel a daganatok kialakulásának fő hajtóerejét a testi sejtekben felhalmozódó mutációk adják, a rákot napjainkban genetikai betegségként határozzuk meg. A rák a genetikai betegségek leggyakoribb előfordulású formája, lényegében az egyetlen genetikai betegség, amely a születés után szerzett mutációk következménye. Most lássuk a káros mutációkat hordozó rákgéneket.
Daganatkeltő gének
A rákgének (cancer genes) megnevezés az emberi genom olyan génjeit jelöli, amelyek bizonyos mutációk megszerzése után közvetlenül járulnak hozzá a daganatképződéshez, így annak kóroki meghatározóivá válnak. Eddig az emberi genom mintegy 25 ezer kódoló (fehérjét meghatározó) génje közül mintegy háromszázról igazolódott, hogy káros mutációik révén részt vesz a daganatképződésben. Ez azt jelenti, hogy az emberi génállomány több mint 1 %-a rákgénné alakulhat.
A daganatképződéssel kapcsolatban a gének három nagy csoportját különböztetjük meg: onkogének, tumorszuppresszorgének és stabilitásgének. Az onkogének a humán genom proto-onkogénjeiből funkciónyeréssel járó mutációk következtében kialakuló gének. A sejtek szintjén egyetlen hibás allél (génváltozat) jelenléte már befolyásolja a sejt megjelenő tulajdonságait (fenotípusát). A tumorszuppresszorgének funkcióvesztéssel járó mutációk révén vesznek részt a daganatképződésben. A sejtek szintjén mindkét allél inaktivációja vagy csökkent működése szükséges a malignus fenotípus megjelenéséhez. A tumorszuppresszorgének, mint például a RB1, APC, VHL, TP53 gének mindkét allélját érintő inaktiváció elsődleges fontosságú, mondhatjuk sebességmeghatározó a daganatképződés szempontjából (ezért gatekeeper, magyarul ’kapuőr’ géneknek is hívják őket). A stabilitás-gének (más néven caretaker vagy magyarul ’gondnok’ gének) lényegében közvetett szuppresszorok, hiszen különböző DNS-hibajavítási rendszer tagjai, és a genom integritásának fenntartásában vesznek részt. Meghibásodásuk a mutációk felhalmozódását teszi lehetővé szerte a genomban. Más stabilitásgének a sejtosztódás különböző folyamatait szabályozzák (pl.: BRCA1, BLM, ATM).
Bár potenciálisan minden gén működését érintő mutáció jelentős lehet a daganatképzésben, ma úgy gondoljuk, hogy kizárólag az onkogének és a tumorszuppresszorgének mutációi képesek közvetlenül befolyásolni a nettó sejtszaporodást, ezáltal biztosítva a szelektív szaporodási előnyt a mutáns sejteknek. Ez azzal magyarázható, hogy az onkogéneket és a szuppresszorgéneket érő mutációk közvetlen hatást fejtenek ki a daganatképződésre a jelátadó útvonalakon működő fehérjetermékeik révén.
Az onkogének és a tumorszuppresszorgének mutációinak élettani hatására alakulnak ki a ráksejtek legjellemzőbb tulajdonságai, mint a szabályozástól függetlenné vált sejtszaporodás, a halhatatlanság, azaz a végtelen szaporodás képességének megszerzése, a gátolt differenciálódás (speciális feladatok végzése), új erek képzése, szöveti invázió és áttétképződés, valamint az apoptózis (genetikailag programozott sejthalál) elkerülése.
A rákgének szabályozása alatt álló útvonalak
A fokozott vagy csökkent működés miatt rosszul működő szignálutak jelentik a fő hajtóerőt a rákos növekedés, túlélés, terjedés és áttétképződés számára.
A jelátadás folyamata az élővilág sejtjeiben genetikailag determinált. A jelpályákat és azok bonyolult hálózatait csak az utóbbi évtizedben kezdték feltárni. A rákgének (aktivált onkogének és inaktivált tumorszuppresszorgének), fehérjetermékeik révén kisajátítják maguknak a daganatképződés szempontjából meghatározó jelpályákat. A hiba nélkül működő onkogének és szuppresszorgének fehérjetermékei normális esetben a sejtek osztódását, differenciálódását, halálát és a sejtek közötti kommunikációt irányítják, hibás működésükkel tehát ezek a kulcsfolyamatok sérülnek.
A normálisan működő onkogének az autók gázpedáljához hasonlíthatóan a haladást biztosítják, a tumorszuppresszorgének pedig a fék szerepét töltik be. Ráksejtekben a gázpedál beragadt, a fék is elromlott, az autó pedig ellenőrizetlenül száguld. Michael Bishop, az első onkogén egyik Nobel-díjas felfedezője sokkal szebb hasonlattal élt, amikor az egészséges sejtek jelátadó folyamatait pontosan szabályozó géneket egy nagyszerűen működő zenekarhoz hasonlította. Ebben valamennyi zenész hibátlanul muzsikál, aminek az eredménye csodálatos harmónia. Egy gén hibája még csak fals hang a zenekarban, több gén hibájáról tudjuk, hova vezet.
A jelátadó utak egymással sok ponton kapcsolódnak, bonyolult, a sejtet átszövő hálózatokat alkotnak, amelyek bemutatására egy falfelület is kevés lenne (Oláh et al., 2006).
Mostanában különösen sok figyelem fordul a daganatok kialakulásának kezdeti és végső történéseire. A daganatos átalakulás akkor kezdődik, amikor egy szaporodásra képes sejtet (őssejtet vagy az őssejt részlegesen differenciálódott utódsejtjét) mutáció éri a „kapuőr” (gatekeeper) útvonalon. Néhány rák esetében azonosították a gatekeeper géneket (RB1 a szem, APC a vastagbél, VHL a vese, NF1 pedig az idegrendszer rosszindulatú megbetegedéseiben). A legtöbb, gyakori előfordulású daganat esetében azonban nem ismerjük ezeket a korán meghibásodó kulcsgéneket. Azt sem tudjuk, hogy például a tüdőrák, emlőrák, prosztatarák, hólyagrák vagy az agy rosszindulatú daganatai több gatekeeper-útvonal valamelyikén keresztül iniciálódnak-e, vagy csak egyetlen útvonalon. A legtöbb gatekeeper gént a családi rákszindrómák tanulmányozása során fedezték fel az elmúlt években. Az emlőrákkal kapcsolatos rákgének (BRCA1, BRCA2) felfedezésében munkacsoportunk is részt vett, erről a Magyar Tudományban korábban már beszámoltunk (Oláh, 2005). Legújabban pedig – széleskörű nemzetközi együttműködésben – a hererákra hajlamosító első genetikai változásokat sikerült azonosítani (Nathanson et al., 2005). (A Nature Genetics folyóirat 2005. novemberi számának Research Highlights fejezete hívja fel a figyelmet erre a közleményre – a szerkesztő megjegyzése.)
Kevés szó esett eddig a daganatos halálozásban leginkább bűnös áttétképződésről. Úgy tűnik, hogy nincsenek olyan rákgének, amelyek kifejezetten az áttétképződéssel lennének kapcsolatban. Az áttétképződés korai szakaszait jellemző biokémiai folyamatok némelyikét, köztük a sejtek fokozott mozgékonyságát és a matrixbontó proteázok termelését (utóbbi enzimek segítenek a ráksejteknek a környező szövetek feloldásában, így a terjedésben) alaposan tanulmányozták. A háttérben álló genetikai változásokról azonban nem sokat tudunk. Ma úgy gondoljuk, hogy a kialakult daganatban az áttétképződéshez nincs szükség újabb genetikai rendellenességekre, és hogy a daganatos folyamatnak inkább a korai, mint a késői szakaszában dől el az, hogy a daganat áttéteket képez-e vagy sem. Ez látszólag ellentmond annak, hogy a rák genetikai betegség, amelynek kifejlődése szomatikus szinten történik. A makroevolúció folyamatához hasonlóan a ráksejt evolúciója sem áll meg, ezért újabb és újabb tumorsejtvariánsok képződnek, amelyeknek egyre nagyobb a terjedési és áttétképző képességük.
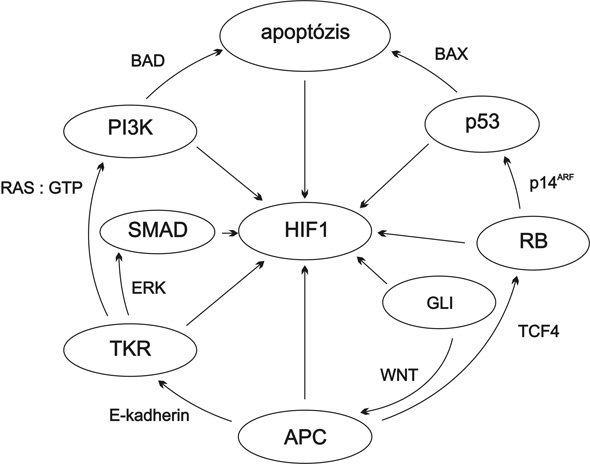
Az elsődleges és az áttéti daganatok növekedéséhez is szükség van a tápanyagellátást biztosító új erek kialakulására (angiogenezisre). Az új erek a daganatsejtek és a gazdaszervezet – a tumorban is jelen lévő – kötőszöveti sejtjei közötti kölcsönhatás eredményeként alakulnak ki. Az utóbbi időszak fontos eredménye az angiogenezis molekuláris ellenőrző folyamatainak feltárása. A VHL gén (veserák tumorszupresszor génje) által kódolt fehérje része a HIF1 lebontását – oxigén jelenlétében – végző ubiquitin ligáz komplexnek. Oxigénhiányos állapotban vagy a VHL mutációja esetén a HIF1 transzkripciós faktor stabil marad, ami citokinek (például VEGF) kifejeződéséhez és végül angiogenezishez vezet. Kiderült, hogy valamennyi onkogén és tumorszuppresszorútvonal kisebb-nagyobb mértékben kapcsolódik az angiogenezishez. Ezt szemlélteti a HIF1 útvonal központi helyzete a 1. ábrán. A daganatok érképződésének, vér- és oxigénellátásának hátterében álló folyamatok megértése és ehhez kapcsolódóan a tumor–gazdaszervezet kölcsönhatása egyre nagyobb figyelmet kap a daganatok biológiájának tanulmányozásában és új terápiák tervezésében.
Az új rákgenetikai/genomikai ismeretek klinikai alkalmazása
Az utóbbi évtizedben a technológiák forradalma övezte a betegségek kutatását. A betegség molekuláris mintázatának (profiljának) meghatározásában elért óriási fejlődés egyértelműen az onkológia területén éreztette leginkább a hatását. A daganatprofilok meghatározására kidolgozott microarray technológiákat a DNS (genomika), az RNS (transzkriptomika) és legújabban a fehérjék (proteomika) szintjén is bevezették. A microarray technológia robusztus megközelítést jelent, gének és géntermékek ezreinek egyidejű elemzését téve lehetővé. A rákgenomika a ráksejtek molekuláris mintázatát hasonlítja össze az egészséges sejtekével a sokak által csak machine research-nek nevezett kutatások során. Láttuk, hogy a rák „sokgénes” betegség, a genom és a proteom betegségeként is meghatározható. DNS-szinten a daganatokat több tucat változás jellemzi, ezek száma az RNS-kifejeződés szintjén több száztól több ezerig változik. Nem könnyű feladat az óriási adathalmazban az „ocsút a búzától elkülöníteni”, de mondhatjuk, hogy az új nagy áteresztőképességű technológiákat éppen a rák titkainak kutatására találták ki. A kutatás első éveit követően már imponáló a fontos felfedezések listája:
• rákra hajlamosító gének felfedezése
• szignálutak feltárása
• terápiás célpontok kijelölése
• a kórlefolyást jelző génkifejeződési profilok, „prognózis gének” meghatározása
• a daganat egyéni molekuláris osztályozása, amitől a jövőben egyénre szabott terápiát várunk.
Napjainkban óriási erőfeszítések történnek a célból, hogy a nagyszerű kutatási eredményeket minél hamarabb hasznosítsák a klinikai gyakorlatban. A következőkben ezek lehetőségeiről és korlátairól olvashatunk. Előtte azonban tisztázzuk a rákgenomika és a molekuláris rákgenetika hozzájárulását.
A kutatás minden szintjén, az alap- és klinikai kutatásokban is alkalmazzuk a rákgenomikai megközelítéseket. Ezeknek köszönhetően egyre több adat támasztja alá azt az elképzelést, hogy minden egyes rákbeteg a kóros molekuláris átrendeződések sajátos együttesével jellemezhető. A klinikai rutin gyakorlatban (molekuláris diagnosztika, prognosztika, terápia területén) a beteg (vagy egészséges) emberek egyedi eseteiben molekuláris genetikai módszerekkel elemezzük a genomikai kutatásokkal feltárt genetikai változások jelenlétét vagy hiányát. Vegyük például az öröklött rákhajlam kimutatásának esetét. Genomikai elemzésekkel sikerült a betegségre hajlamosító egyes rákgéneket felfedezni, de annak kimutatása, hogy a humán genom egészséges génje van-e jelen, vagy egy káros mutáció következtében rákra hajlamosító gént örökölt-e a vizsgált személy, azt molekuláris genetikai vizsgálatokkal döntjük el. Hasonló a helyzet a farmakogenomikai-farmakogenetikai elemzésekkel.
A rákra hajlamosító gének felfedezése szolgáltatta az első példát a kutatási eredmények klinikai hasznosítására, lehetővé téve a nagy kockázatban levők azonosítását, a betegség megelőzését vagy korai észlelését. E területen szerzett tapasztalatainkról a Magyar Tudomány hasábjain a közelmúltban beszámoltunk (Oláh, 2005). Jelen helyen a daganatok molekuláris „kézjegyének” meghatározásával és a klinikai hasznosítás perspektíváival foglalkozunk.
A tumorszövetek molekuláris osztályozása DNS microarray-ek segítségével
Az előrehaladott daganatokat bonyolult genetikai és proteomikai változások jellemzik, ezek az egyes daganatok és betegek szintjén nagyfokú klinikai heterogenitásában nyilvánulnak meg. A bonyolult változások (profilok) meghatározása meghaladja a hagyományos kórtani osztályozás lehetőségeit (utóbbi a daganat morfológiáján, differenciáltságának fokán és az áttét jelenlétén vagy hiányán alapul).
Az utóbbi időben nagyon sok közlemény jelent meg azt bizonyítva, hogy a DNS microarray-ek alkalmasak a daganatok elemzésére és új, molekuláris alapú osztályozására. 1999-ben a vérképzőrendszer daganatain végzett vizsgálatokkal igazolták először, hogy a génkifejeződési profilok meghatározásával új lehetőség nyílt a tumorosztályok finom megkülönböztetésére és a kórlefolyás előrevetítésére. Ötven génből álló génkészlet segítségével az akut mieloid leukémiát (AML) és az akut limfoid leukémiát (ALL) sikerült nagyon pontosan megkülönböztetni. Ezt követően sokféle tumoron végeztek ilyen profilmeghatározást. Köztük a nyirokrendszer, az emlő, tüdő, petefészek, prosztata, gyomor és az agy rosszindulatú daganatai esetében is elkülöníthetővé váltak a kedvező kórlefolyású, hosszabb túlélést eredményező daganatok a rossz prognózisú esetekből. Nem hagyható említés nélkül Laura van ’t Veer munkacsoportjának úttörő közleménye (2002), amelyben nyirokcsomóáttét nélküli fiatal emlőrákos betegek tumorszöveteiben rossz prognózist előrevetítő génkifejeződési mintázatok feltárásáról számoltak be. Ezek a hagyományos klinikai paraméterekkel nem azonosítható „rossz prognózis” mintázatok lényegében arra hívták fel a figyelmet, hogy az áttétképző fenotípus már a daganat előrehaladás korai szakaszában beprogramozódott. A klinikai és szövettani paraméterek alapján a nyirokcsomó érintettségét nem mutató, fiatal emlőrákos betegek 90 %-a részére a daganat sebészi eltávolítását követően ma ismételt gyógyszeres kezelést írnak elő. E fiatal nők többségében azonban kezelések nélkül sem fejlődne ki áttétes daganat, így részükre a kezelés semmilyen előnnyel nem jár, sőt kénytelenek elszenvedni annak mellékhatásait. Kiderült, hogy a „rossz prognózis” profil ugyanolyan megbízhatóan elkülönítette az áttétképzésre nézve nagy kockázatban lévő csoportot, mint ahogy az a hagyományos klinikai-patológiai osztályozással megtehető.
Az új molekuláris tumorosztályozás óriási előnye, hogy csökkenti a felesleges kezelések számát. A bemutatott tanulmány világosan szemlélteti a génkifejeződési profilvizsgálatok lehetséges hatását a kezeléssel kapcsolatos döntésekre és végső soron a betegség kimenetelére nézve.
Nem fér kétség ahhoz, hogy igen nagy a génkifejeződési profilmeghatározások jelentősége a betegség osztályozásában és a kórjóslat (prognózis) felállításában. Számos nehezítő körülményt kell azonban figyelembe venni, mielőtt az új technikák rutin klinikai alkalmazásra kerülhetnek. Nagy előrelépés szükséges e területen a módszerek, elemzések és a felhasznált kontrollok standardizálásának vonatkozásában, valamint az adatok validálásában. További problémát jelent, hogy az eddigi tanulmányok kisszámú betegeset kiértékeléséből születtek, ami jelentősen limitálja sok molekuláris osztályozó statisztikai jelentőségét.
Célzott kezelések, gyógyszer-érzékenységi és rezisztencia-profilmeghatározás
A diagnosztikai és prognosztikai célú felhasználás mellett a genomikus profilvizsgálatokat gyógyszerkifejlesztésre, a gyógyszerérzékenység és rezisztencia-profiljának meghatározására is használják a kutatók.
A génkifejeződési profilírozás (expression profiling) új kezelési célpontok azonosításához és számos, célzottan ható terápiás készítmény kifejlesztéséhez és elfogadásához vezetett. Ilyen szer például a trastuzumab (Herceptin), mely az ErbB2 fehérjét fokozottan termelő emlő- és petefészektumorok ellen hat, az imatinib mesilate (Gleevec), amely a Bcr-Abl fúziós kináz és a c-Kit kináz ellen hatásos krónikus mieloid leukémiában (CML), akut limfoid leukémiában (ALL) és gasztrointesztinális sztróma tumorokban (GIST). Végül említhetők a sejtfelszíni tirozin kináz gátlók, például az erlotinib (Tarceva), amelyek az epidermális növekedési faktor receptorát (EGFR) támadják. A témában érdeklődők kitűnő olvasmányt találnak Jeney András és Kralovánszky Judit (2005) szerkesztésében megjelent könyvben.
Ezek a gyógyszerek a racionális gyógyszertervezés új korszakának kezdetét jelzik, amelyben jól kiválasztott molekuláris célpontok a gyógyszerfejlesztési folyamat mozgatórugói. Bár az előrehaladott betegséget ezen új készítmények sem gyógyítják meg, de jelentősen javíthatják az életminőséget és a betegség folyamatának jelentős lelassításával meghosszabbítják az életet.
Az új készítmények használata kapcsán tanultuk meg, hogy a DNS-szintű változások (mutációk) sokkal megbízhatóbban jelzik a molekuláris célpontot, mint a génkifejeződés rendellenességei. Példaként említhető a GIST, ahol a legtöbb esetben a Kit fehérje nagyon erős kifejeződése látható a sejtekben, de csak azok a daganatok válaszolnak jól az imatinib kezelésre, amelyekben a KIT gén mutált. Ugyanezt figyelték meg a gefitinib (Iressa) kezelések során: csak olyan viszonylag ritka előfordulású tüdőrák ellen használ a gyógyszer, amelyben az EGFR gén mutációt szenvedett; a csupán fokozott EGFR-kifejeződésű tüdőrákos esetekben hatástalan (Paez et al., 2004). A készítmény alkalmazásának lehetőségeit, kritériumait ezért tovább vizsgálják, és egyelőre az USA-ban és Európában visszavonták.
Az emberi genomszekvencia megfejtése a gyógyszerérzékenység és rezisztencia molekuláris alapjainak újabb széles skálájú elemzését teszi lehetővé. A kémiai genomika a bonyolult genetikai hozzájárulások feltárásában jelent teljesen új megközelítést (Huang – Sadee, 2003). Nagy előrehaladás várható a Humán Genom Project melléktermékeként megismert több millió, az egyes nukleotidokat érintő polimorfizmusok (SNP) azonosításától és elemzésétől, azaz hogy azok milyen mértékben befolyásolják az egyes betegek esetében a gyógyszerkezelésekre adott választ.
Hatvan évvel az első rákgyógyszerek bevezetése után még napjainkban sem tudjuk megmagyarázni azok szelektív hatását. Vajon miért érzékenyebbek a ráksejtek ezekre a készítményekre, függetlenül attól, hogy milyen hatásmechanizmusú gyógyszert alkalmazunk (antimetabolitot, DNS-keresztkötőt, alkiláló szert vagy topoizomeráz gátlót).
Még a legújabb célzott hatású készítmények kapcsán sincs magyarázat a szelektív gyógyszerhatásra. Az ERBB2 és ABL tirozin kinázok például a legtöbb egészséges sejtben kifejeződnek. Miért várjuk akkor azt, hogy a géntermékek működésének gátlását célzó terápia különbséget tesz a ráksejtek és a normális sejtek között? Vannak javaslatok a „sejtfüggés” jelenségére, bár molekuláris alapja ennek sem ismert.
Egyre gyakrabban jut eszünkbe James Watsonnak, a DNS kettős spirál felfedezőjének egyik korábbi megállapítása, miszerint a rákot akkor tudjuk legyőzni, ha válaszolni tudunk arra a kérdésre, hogy „Mitől sejt a sejt?”. A kérdés megválaszolásában sokat várhatunk a sejthálózatok tanulmányozásától. (Az új rendszerbiológiai kutatások élvonalában örvendetesen gyakran találkozunk magyar szerzői nevekkel: lásd Barabási – Oltvai, 2004; Almaas et al., 2004).
Az egyénre szabott terápia jövője
A rákterápia jelenleg egyes molekuláris célpontok ellen irányul. Elképzelhető, hogy a jövőben a rákgének által ellenőrzött szignálutak több csomópontját veszik célba. Ilyen megközelítéssel – legalábbis elméletben – kisebb gyógyszeradagokkal nagyobb hatékonyság és kevesebb toxikus mellékhatás érhető el. Könnyen lehetséges ugyanis, hogy a szignálutak különböző pontjain ható, jól kiválasztott gátlószereknek a hagyományos kezelésekben használtnál lényegesen alacsonyabb koncentrációjával is elérhető lesz a célzott útvonal teljes kikapcsolása. A megvalósítást az tenné lehetővé, hogy a gátlószerek az útvonal különböző pontjait gátolnák. A vázolt elképzelések alapján a molekuláris profilmeghatározások újrafogalma-zott célkitűzése a sejthálózatok feltérképezése, mivel azok kijelölik az egymással kapcsolatban álló gyógyszercélpontok optimális készletét. Az új kombinációs terápiák használatától a nem kívánatos toxikus mellékhatások elkerülése is várható. Az új elgondolások helyességét azonban igazolni kell egészséges sejteken is, ahol meg kell határozni a gyógyszerek kombinált toxikus hatásait.
A kulcsfontosságú jelátadó útvonalak működési állapotának feltérképezése az egyénre szabott terápia kiindulópontja lesz. A vázolt forgatókönyv alapján a terápiát az egyes daganatokra jellemző molekuláris hibákra tervezhetjük. Annak függvényében leszünk képesek új kombinációs vagy célzott terápiák kifejlesztésére, hogy mennyi új információval szolgálnak az újonnan formálódó robusztus technológiák (fehérje array-ek, RNSi) a jelátadásról (benne a fehérje–fehérje, fehérje-DNS és/vagy a fehérje–RNS kölcsönhatásokról). A kezelés hatékonyságának meghatározása a kezelések korai fázisában várhatóan elősegíti a korai beavatkozások megtételét és a beteg számára a pozitív kifejletet.
A következő évtized – Európa a rák ellen
A rákkutatóknak a következő évtized is bőven ad munkát. Az európai rákkutatás versenyképességének fokozására és az új tudományos eredmények gyakorlati hasznosításának elősegítésére az európai rákszervezetek vezetői (a szerző részvételével) egy megvalósíthatósági tanulmányt készítettek. Az EU-támogatást élvező (EUROCAN+ PLUS) csoport vállalta, hogy a következő két évben feltárja a tagországokban folyó rákkutatás legfontosabb akadályait, segíti a nemzeti rákkutatások európai integrálását, javaslatot tesz az EU 7. Keretprogramjának témaprioritásaira.
A genomikai kutatások támogatása és az eredmények egészségügyi hasznosításának elősegítése az EU jelenlegi (2002–2006 közötti) 6. Keretprogramjának első számú prioritása. A rák leküzdésére (Combating Cancer) az EU 435 millió euró pályázható támogatást biztosít a nemzeti rákkutatási támogatások kiegészítésére, ezzel is jelezve a rákgenomikai kutatások kiemelt fontosságát. Magyarországon húsz éve folynak nemzetközi szinten elismert molekuláris onkológiai kutatások. Ugyanakkor az EU-tagországokban végzett friss felmérés szerint hazánk (még az új tagországok között is) sereghajtó a rákkutatás nemzeti támogatottságát illetően. Magyarországon ma a GDP 0,0012 %-a jut a rákkutatás támogatására kormányzati és alapítványi forrásból összesen, ez 0,08 eurót jelent egy főre. (www.ecrm-forum.org/report/ECRM_report.pdf).
A 6. Keretprogramban meghirdetett EU pályázati kiírás témáit az 1. táblázat ismerteti. Az EU rákgenomikai pályázatainak elbírálásában 2003 óta szerzett tapasztalatai arról győzték meg a szerzőt, hogy a közeljövő legnagyobb kihívását továbbra is a genomika területén született tudományos eredmények klinikai gyakorlati alkalmazása jelenti, ami új típusú multidiszciplináris együttműködést feltételez. Láttuk, hogy a genomi és proteomi microarray technológiák klinikai rutin-alkalmazhatóságáig még sok a tennivaló. A technikák standardizálása és több nagy és statisztikailag alátámasztott adatbank független kiértékelése után várható, hogy közelebb jutunk az egyes betegek személyére szabott terápiákhoz. Az a megfigyelés, hogy viszonylag kisszámú útvonal zavara felelős sok daganatféleségért, arra enged következtetni, hogy a célzott kezelésekben használt rákgyógyszerek a rákbetegségek széles skáláján bevethetőek lesznek.
A terápia sikertelenségéért felelős áttétes daganatos betegek szervezetében a ráksejtek százmilliárdjai vannak jelen. Mai szemmel nézve reménytelennek tűnik a kiirtásuk. A daganatsejtekben levő rengeteg mutáció révén ugyanis a ráksejtek gyorsan létrehozzák a terápiát kijátszó variánsaikat. Másrészről azonban a legtöbb ilyen előrehaladott állapotú rák „válaszol” a durva terápiás beavatkozásokra. A közeljövőben az egyre jobban feltárt „ráksejt-útvonalak” egyre pontosabb célbavétele az új generációs gyógyszerekkel óvatos optimizmusra ad alapot.
A genomikai forradalom utáni időszakban is érdemes feltenni magunknak a kérdést, hogy hosszú távon a daganatos megbetegedések és halálozások csökkentésére az egyre újabb, egyre jobb gyógyszerek kifejlesztése jelenti-e az optimális megoldást. A nyugati társadalmakban élvezhető hosszabb élettartam sokkal inkább az eredményesebb betegségmegelőzés következménye, mint a jobb kezeléseké. Régóta tudott, hogy a rák leggyakoribb formái a közismert rákkeltő hatások (például a dohányzás, a napozás) korlátozásával megelőzhetők. Más daganatok, mint például az emlő-, prosztata-, méhnyak-, és vastagbélrák, korán észlelhetők, így a daganatos megbetegedések és halálozások száma is csökkenthető. Legalább harminc-negyven év szükséges ahhoz, hogy egy hámsejt annyi genetikai hibát halmozzon fel, amennyi elég az áttétes betegség kialakulásához. Sok időnk van arra, hogy a daganatok még a hagyományos kezelési módokkal is gyógyíthatók legyenek. Az új molekuláris diagnosztikai vizsgáló módszerek nyújtotta korai daganatészlelés és a betegség megelőzése a következő évtizedekben is a legbiztosabb módja lesz a daganatos halálozások csökkentésének.
Kulcsszavak: rákgenomika, rákgenetika, rákgének, jelátadó útvonalak

1. ábra • A sejtszaporodást és sejtvesztést szabályozó fontosabb – a „rákgének” által használt – genetikai útvonalak (oválisok). Figyelemre méltó, hogy az összes onkogén és tumorszuppresszor gén által használt útvonal részt vesz a ráksejtek tápanyagellátását biztosító új erek képzésében – az angiogenezis folyamatában –, amit a HIF1 útvonal központi helyzete mutat (Vogelstein – Kinzler, 2002 után). Rövidítések: APC – adenomatosus polyposis coli; GLI – glioma-asszociált onkogén; HIF1 – hipoxiával indukálható transzkripciós faktor; PI3K – foszfoinozitid 3 kináz; TKR – tirozin kináz receptor.
Integrated Projects (IP)
Molekuláris célpontok
Sugárterápia
Preklinikai vizsgálati modellek
Fertőzések szerepe a daganatok kialakulásában
Daganatok immunszabályozása
Az apoptózis modulációja
Networks of Excellence (NoE)
Klinikai fázisvizsgálatok
Ritka rákok
Nagykockázatú populációk
IP/NoE
Funkcionális onkogenomika
Molekuláris képalkotó eljárások
Rákregiszterek
Specific Targeted Research Projects (STREP)
Familiáris rákok
A „minimális” betegség észlelése és kezelése
Tumor–gazdaszervezet kölcsönhatások
Rezisztencia a gyógyszeres kezelésekkel szemben
Gyermekkori rákok
Terminális állapotban levő betegek ellátása
Őssejtek a daganatképződésben
Innovatív technológiai megközelítések
A képalkotó eljárások felbontóképességének javítása
STREP/ Coordinated Actions (CA)
Áttétképződés (emlő)
Prognosztikai és prediktív markerek
Fájdalommal kapcsolatos mechanizmusok
Specific Support Actions (SSA)
Konferencia (sejtdifferenciálódás és rák)
SSA/CA
Megvalósíthatósági tanulmány: Rákkutatás koordinálása
1. táblázat • „A RÁK ELLENI KÜZDELEM” az EU 6. Keretprogramjában
(témák és pályázati formák)
Irodalom
Almaas, Eivind – Kovács B. – Vicsek T. – Oltvai Z. N. – Barabási, A.-L. (2004): Global Organization of Metabolic Fluxes in the Bacterium Escherichia Coli. Nature. 427, 839–843.
Barabási, Albert-László – Oltvai Zoltán N. (2004): Network Biology: Understanding the Cell’s Functional Organization. Nature Reviews. Genetics. 5, 101–113. http://www.nd.edu/~networks/Publication%20Categories/01%20Review%20Articles/NetworkBio_Nature%20Rev%20Genetics%205,% 20101-113%20(2004).pdf
Danial, Nika N. – Korsmeyer, Stanley J. (2004): Cell Death: Critical Control Points. Cell. 116, 205–219.
Futreal, P. Andrew et al. (2004): A Census of Human Cancer Genes. Nature Reviews. Cancer. 4, 177–83.
Huang, Ying. – Sadee, Wolfgang (2003): Drug Sensitivity and Resistance Genes in Cancer Chemotherapy: A Chemogenomics Approach. Drug Discovery Today. 8, 356–363.
Hunter, Kent W. (2004): Host Genetics and Tumour Metastasis. British Journal of Cancer. 90, 752–755.
Jeney András – Kralovánszky Judit (szerk.) (2005): Onkofarmakológia. Medicina, Budapest
Nathanson, Katherine L. et. al. (magyar szerzők: Olah E. – Geczi L. – Bodrogi I.) (2005):
The Y Deletion Gr/gr and Susceptibility to Testicular Germ Cell Tumor.
The American Journal of Human Genetics. 77, 1034-43.
Ntzani, Evangelia E. – Ioannidis, John P. A. (2003): Predictive Ability of DNA Microarrays for Cancer Outcomes and Correlates: An Empirical Assessment. The Lancet. 362, 1439–1444.
Oláh Edit (2005): A BRCA1 és BRCA2 gének. Magyar Tudomány. 8, 989–1000.
Oláh Edit – Kökény Sz. – Papp J. – Bozsik A. – Keszei M. (2006): Modulation of Cancer Pathways by Inhibitors of Guanylate Metabolism. Advances in Enzyme Regulation. 46, (In Press)
Paez, J. Guillermo – Janne, P. A. – Lee, J. C. et al., (2004): EGFR Mutations in Lung Cancer: Correlation with Clinical Response to Gefitinib Therapy. Science. 304, 1497–1450.
Shay, Jerry W. – Roninson, Igor B. (2004): Hallmarks of Senescence in Carcinogenesis and Cancer Therapy. Oncogene. 23, 2919–2933.
Vogelstein, Bert – Kinzler, Kenneth W. (2002): The Genetic Basis of Human Cancer. McGraw-Hill, Toronto
van ’t Veer, Laura J. – Dai, H. – van de Vijver, M. J. – He, Y. D. – Hart, A. A. M. – Mao, M. et al. (2002): Gene Expression Profiling Predicts Clinical Outcome of Breast Cancer. Nature. 415, 530–536.
Wulfkuhle, Julia – Espina, V. – Liotta, L. – Petricoin, E. (2004): Genomic and Proteomic Technologies for Individualisation and Improvement of Cancer Treatment. European Journal of Cancer. 40, 2626–2632.
<-- Vissza a 2006/3 szám tartalomjegyzékére
<-- Vissza a Magyar Tudomány honlapra
[Információk] [Tartalom] [Akaprint Kft.]