AZ IMMUNGENOMIKA ALAPJAI ÉS JÖVŐJE
– RENDSZERSZEMLÉLETŰ BIOLÓGIA –
Falus András
az MTA levelező tagja, egyetemi tanár, intézeti igazgató
Semmelweis Egyetem Genetikai Sejt- és Immunbiológiai Intézet,
Immungenomikai Kutatócsoport, Magyar Tudományos Akadémia
faland @ dgci.sote.hu
Buzás Edit
az orvostudományok kandidátusa, egy. docens
Semmelweis Egyetem Genetikai Sejt-
és Immunbiol. Int. – buzedi @ dgci.sote.hu
Petrányi Győző
arez MTA ndes tagja, egyetemi tanár
Országos Gyógyintézeti Központ
petranyi.home @ axelero.hu
1. Genetika – genomika
A genetika, azaz öröklésbiológia, a vertikális biológiai információátadás tudománya napjainkban átlépett egy tudománytörténelmi küszöböt. A közvetett, majd megfigyeléseken és kísérleteken alapuló „klasszikus” genetika után, a molekuláris biológiai technológiai forradalom nyomán bekövetkezett sok organizmus, többek között az emberi genom nukleotidsorrendjének gyakorlatilag teljes feltárása. Ez a fejlemény azzal vált mára, a harmadik évezred fordulójára korszakalkotóvá, hogy létrehozta az informatika és a biológia valóban tudományos mérföldkőszerű egymásra találását – a bioinformatikát. A genomikai, nagyrészt még további finomításra, kiegészítésekre váró „adatóceán” az emberi gondolkodás történetében eddig nem tapasztalt új helyzetet teremtett. Sokunk meggyőződése, hogy számos tekintetben most lépünk át egy új korszakba, napjainkban kezdődik a bioinformatikai alapú új „írásbeliség” a biológiában. Úgy gondoljuk, hogy nem véletlen, hogy a biológia (orvostudomány, mezőgazdaság) kérdésköre, a megközelítési stratégiák elérték a komplex informatikai megközelítés igényét, hiszen a biológiai rendszerek funkciói és működészavarai csak hálózatokban és azok modelljeivel érthetőek meg. A sejten belüli intracelluláris, a sejtek közötti intercelluláris és a szervrendszerek közti fiziológiás (neuronális, endokrin, immunológiai) hálózatok egyébként rendkívül emlékeztetnek szociológiai hálózati rendszerekre (Radda – Viney, 2004).
Ez a paradigmaváltás három, tudománytörténeti értelemben egyenként is jelentős előrelépés időbeli és motivációs egybeesése következtében vált reális lehetőséggé.
Az első alap a genomprogramok első, „lexikális” szakaszának befejezése. Mint tudott, 2001 első hónapjai óta már baktériumok, az élesztő, az ecetmuslica, a fonálféreg és egyes növények mellett az emberi genom, legújabban pedig az egér, a kutya lényegében teljes genomiális géntérképe rendelkezésre áll, a világháló adatbázisaiból lehívható és elemezhető. Bár a gének annotációja (azonosítása) még sok időt vesz igénybe, ez a lexikális tudásanyag új genetikai információs minőséget jelent.
Emellett óriási és naponta bővülő adatbázist jelentenek a pontmutációk (single nucleotide polymorhism – SNP) tömegének feltárása, hiszen a minden genomban megtalálható milliós nagyságrendű SNP-k egyenként külön és független allélként, genetikai markerekként kerülhetnek felhasználásra. A mérés technikai kivitelezése ma már nagykapacitású (high-throughput) rendszerekben is megoldott.
A második, a nagyteljesítményű microarray (chip) eljárás, melynek speciális jellegzetességei nagyságrendekkel emelik az egyidejűleg vizsgálható gének számát, szerkezeti (nukleotidsorrend) és funkcionális (génkifejeződés-mRNS) információk tömegét képes nyújtani. A génchipek (génlapok) rendezetten (microarray), sorokban és oszlopokban kis felületen is több tízezer ismert nukleotidszálat tartalmaznak, ezekhez kapcsolódik a jelzett minta nukleinsav. A leolvasás letapogató optikai eljárással történik.
Végül a harmadik, a bioinformatika. Ez az új biostatisztikai/biomatematikai megközelítés korrelációs, clusterképző eljárásokkal és egyéb, naponta bővülő szoftvermegoldásokkal elemzi a genomiális/expressziós adatbankok és a génchiptechnika által szolgáltatott adathalmazt, s biológiai következtetések levonására alkalmas elemzést nyújt.
A bioinformatika különleges értéke az in silico megközelítés, tehát a nemzetközi adatbázisokhoz kapcsolódó számítógépes munka (dry lab), ahol esetleg laboratóriumi munkától (wet lab) elkülönülten is végezhető korszerű, kreatív, de egyben „génhalászaton” alapuló genomikai kutatás. Ez lehetőség térben (távolról) és időben (régebben) végzett adatgyűjtés értékelésére.
2. Az immunválasz modelljei és genomikai predikciója
A genomika/posztgenomika korszakában, élve az adódó technológiai, informatikai fejlődéssel, nem egyes géneket, hanem gén- és géntermékhálózatokat, mintázatokat érdemes vizsgálni. Nem véletlen, hogy az elterjedt modellként vizsgált, autoimmunitásra fokozottan hajlamos egerekben vagy transzgenikus állatokban az ún. trait analízis (Sospedra – Martin, 2004), a funkció (vagy a kóros funkció) kapcsolt gének hálózatára utal, mint például az inzulinhiányos cukorbetegség (IDDM), reumatoid arthritis (RA), systemas lupus erythematosus (SLE), pajzsmirigybetegségekben, ami a kórképek humán megfelelőjének poligénes jellege miatt nem is meglepő.
Másrészről, egy-egy jelenséget (például immuntolerancia) vizsgálva, a limfocitaaktiváció során anti-apoptotikus gének sorozata aktiválódik – itt is adódik a génhálózatokat, expressziós mintázatokat feltáró genomikai megközelítés.
A már ismert gének összefüggéseinek feltárása mellett igazi „génhalászat” is végezhető. Különböző stimulációkra (anti-CD3, anti-CD28, mitogének, ionomicin és kombinációik) például a T sejten belül eltérő expressziós mintázatok alakulnak ki, ezek analízise révén eddig nem, vagy csak más funkciójukban ismert gének tucatjait ismerjük fel.
Az immunológus, ideértve az immunbetegségekkel foglalkozó klinikust is, célja a szervezet védekező reakcióinak valamilyen előrebecslése. Itt említhető például a patogénekre, a tumorra, az allergénekre, illetve az autoantigénekre való immunválasz, de természetesen az immunhiányok predikciója is. Korábbi ismereteinket kiegészítve ma már úgy gondoljuk, hogy például a CD4+ helper T sejtek széles kategóriáján belül az immunválasz kimenetele szempontjából nagyon fontosak a nagyrészt fékező hatású CD4+ CD25+ regulátoros sejtek (Treg). Csak a genomika, az expressziós mintázat globális analízise lesz képes jelentős támpontot adni a CD4+ effektor és a CD4+ regulatorikus sejtek sejtbiológiai különbségére, de feltehetően itt találjuk meg a funkcionális különbség ma még molekulárisan alig feltárt lényegét is. Ilyen eljárással derült ki például, hogy a Foxp3 gén szelektíven fejeződik ki a Treg sejtekben (Wang et al., 2003). Ez a predikciós lehetőség ad új, individuálisabb megoldásokat az immunfarmakológia illetve a vakcináció stratégiája és technológiája számára (Wang – Falus, 2004).
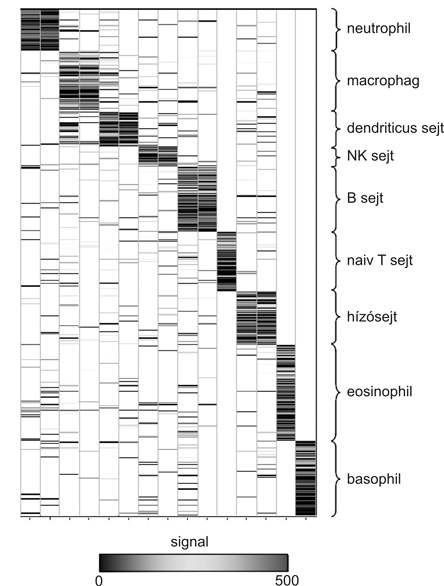
Az immungenomika ma már elterjedten használja az egyes sejtek expressziós mintázatát, a sejtspecifikus immuntranszkriptomot (1. ábra) (Sallusto – Mackay, 2004).
A génprofilanalízisek segítségével a betegségek molekuláris mechanizmusához és terápiás (akár génterápiás) megoldásokhoz juthatunk közelebb.
3. Az „immungenom” és a komparatív immungenomika
Mai tudásunk szerint az emberi genom 23-24 ezer génjéből mintegy 1300-1400 áll lényegi kapcsolatban a természetes és szerzett immunválasszal. Ez a nagyon jelentős szám az emberi genom több mint huszadát, 5,5-6 %-át teszi ki (2. ábra) (Kelley et al., 2005).
Ide tartoznak többek között az IgSF-be (Immunglobulin szupergén család) tartozó proteinek, lektinek, citokinek (és receptoraik), kemokinek, integrinek, az MHC I és MHC II molekulák, a természetes (innate) immunválasz receptorai és a komplementfehérjék. Érdekes, hogy az immungenom szereplői legtöbbször hálózati kapcsolatban állnak egymással.
Az emberi genomban az immungenomhoz tartozó gének jellegzetes klaszterekben fordulnak elő. (Részletes információ: www.genomesapiens.org). Ilyenek a nagy interleukin családok az 1. kromoszómán vagy az MHC cluster (~ 4 Mbp) a 6. kromoszóma rövid karján. Utóbbiban az eddig annotált gének 40 %-a ismert immunológiai funkcióval rendelkezik. Az Ig és TCR V gének közelségének funkcionális oka van, ez az antigénfelismerésben a sokféleséget biztosító génátrendeződés, amely hatalmas repertoire-okat eredményez.
Az immungenom génjeinek jellegzetessége a poligénia. A filogenezis különböző állomásaiból származó (például C. elegans, Drosophila, egér, ember) élőlények homológ génklasztereinek összevetése is számos érdekes következtetés levonására ad alkalmat, nyilvánvaló egyes géncsoportok és klasztereik nagyfokú konzerváltsága, ugyanakkor jelentős és gyors evolúciója is.
Sok immunológiai funkcióval kapcsolt gén poligénikus, melyek jelentős része génduplikációval jött létre. Ilyen a cisz duplikációval keletkezett NK receptorcsalád a 19. kromoszómán, ahol több mint ötven homológ bázissorrendű gén található (KIR, LILR, CD66 stb.)
Ugyancsak nagyon lényeges jellegzetessége az immungenomba tartozó géneknek a polimorfizmus. Az MHC és a non-MHC (például Nod2) gének mintázata jellegzetes része a poligénes betegségek pathomechanizmusának. Ezen a területen a genomléptékű SNP vizsgálatoktól nagyon sok lényeges eredmény várható a közeli jövőben.
Az egér és az emberi genom összehasonlítása szerint az immungenom (és a reprodukcióban szereplő gének) mutatják a legnagyobb variabilitást, azaz allélikus eltéréseket. Ennek az oka feltehetően abban a plaszticitásban rejlik, ami a patogének elleni védekezés szükségszerű flexibilitását eredményezi. Igen sok a paralog (duplikálódott) régió az immungenomban, ennek az oka az egyik magyarázat szerint a közös ősi gének nagy területet magába foglaló duplikációja is lehetett. A másik magyarázat szerint a gének függetlenül duplikálódtak, és valamiféle szelekciós előny miatt rendeződtek a törzsfejlődés során régiókba.
Az immungenom vizsgálatának érthető motivációs hátteret ad az a tény, hogy nagyon sok immungenomhoz tartozó gén betegségekkel való asszociációja jól ismert (Knudsen – Green, 2005).
4. Szupergén családok
Az immungenetikai megközelítés egyik lehetséges útja a géncsaládok vizsgálata. Az alábbiakban néhány, mai tudásunk alapján fontos géncsaládot írunk le. Az érdeklődő minderről sokkal bővebben kaphat (rendszeresen felújított) információt a géncsaládok adatbanki honlap hozzáférésén: http://supfam.org.
Immunglobulin szupergén család (IgSF)
A konzervált molekuláris modulokat tartalmazó immunglobulin szupergén család (IgSF) gerincesekben mai tudásunk szerint legalább ezer tagot számlál. A konzerválódott molekuláris modul jelentőségére (például az antigén kötésének itt megjelent funkciójára) utal, hogy a törzsfejlődésnek abban a szakaszában, ahova az ízeltlábúak tartoznak, még „csak” 150-200 IgSF molekula tartozott. Az IgSF-ek esetében kiugróan jelentős funkciónyerésre (gain of function) jellemző, hogy az általánosan elterjedt szerin-treonin kinázok (például protein kinaz C vagy A) esetében sokkal kisebb (kb. kétszeres) a különbség a rovarok és a gerincesek között. Az ismert immunválasszal kapcsolt IgSF funkciók (immunglobulin L és H láncok, TCR, CD3, MHC I, MHCII, 2mikroglobulin, CD4, CD8, FcR, illetve közvetve CD80, CD86, CD7, CD47) mellett nem immunológiai aktivitások is szerepelnek, például az izomelaszticitásban szereplő gigantikus méretű titin, melyben 247 Ig domén található. Az Ig doméneknél a proteázokkal szembeni jelentős rezisztencia mellett a más molekulákkal való interakciós képesség is jelentős lehet abban, hogy az IgSF elem ennyire elterjedt az élővilágban konzervált szerkezetben.
Az IgSF család polimorfizmusának része a glikozilációs mintázat variábilitása is. Hasonlóan konzerváltak más molekulacsaládok, például a veleszületett immunitásban jelentős Toll-receptorok, illetve a Nod2 és a CEM15 géncsaládja is. Külön géncsaládba tartozik a jelentőségében egyre inkább kiemeltnek értékelt, a B sejtes hipermutációért és osztályváltásért felelős „activation-induced cytosine deaminase” (AID) enzim génje is (Conticello et al., 2005). Érdekes, hogy a jelátviteli utak komponenseiben a törzsfejlődés során ugyancsak van eltérés. Mégis, legalábbis az NFkB esetében úgy tűnik, az intracelluláris jelképzés nagyon konzervatív, hiszen az IL1, LPS, TNFa és a PDGF mellett az oxidált LDL is ugyanahhoz az NFkB-t tartalmazó szignaloszóma útba torkollik a sejtek belsejében. Az endogén antigének processzálásában szereplő proteoszóma komplexnek is számos új vonatkozása került napvilágra genomikai módszerekkel (Moshe et al., 2004).
B7 géncsalád
Az elmúlt évtizedben teljesen elfogadásra került, hogy a sikeres immunválasz során a receptor-ligand (például TCR-peptid/MHC) kölcsönhatás ki kell egészüljön a koreceptorok, illetve a kostimulációs kölcsönhatások jellegzetes mintázatával. Az immunválasz sikeréhez a többszörös szignálok szimultán létrejötte szükséges. A „klasszikus” CD28-B7, illetve CTLA4-B7 kapcsolat mellett a genomikai analízis és a bioinformatika számos további kostimulációs kapcsolatot identifikált. Ilyen a ICOS- ICOS-L kapcsolat, előbbi a CD28, utóbbi a B7 homológja (B7h).
A mieloid sejtek esetében nemrég azonosítottak egy TREM nevű géncsaládot, amelynek tagjai a megfelelő mintázat felismerése után aktiválódnak.
IL1-IL1R géncsalád
A gyulladásos immunválaszban szereplő IL1-IL1R család is, melynek szerepe lényeges az adaptív és a természetes immunválasz összekapcsolásában. Ma legalább tíz receptor és tíz ligand ismert ebben a géncsaládban, köztük szolubilis receptorok és természetes antagonisták is előfordulnak. Ugyancsak itt említendők az immunválasz számos részében lényeges kemokin-kemokinreceptor párok is.
5. A fő hisztokompatibilitási komplex, MHC-HLA
A fő hisztokompatibilitási komplex (Major Histocompatibility Complex – MHC) az élőlények egyik legnagyobb és legösszetettebb géncsaládja, melynek nélkülözhetetlen szerepe van a környezethez való alkalmazkodásban, illetve a környezet patogén hatásainak kivédésében. Minderre a „saját” versus „idegen” struktúrák felismerő képessége és az egyedülállóan nagy polimorfizmus sajátságai révén képes. Az antigénfelismerő gének (immunglobulin SF géncsalád) egyeden belüli sokféleség (egyedeken belül megnyilvánuló diverzitás) egészül ki az MHC populációs sokféleségével. Az MHC az antigénből származó peptidek megragadásához különböző polimorf „befogó” struktúrákat kialakítani képes géneket tartalmaz. Az MHC egyes lokuszainak variációs készsége nagyon nagy, mivel sok pontmutációs „forró pont” található e területen. Ennek következtében képes egy megváltozott környezet új antigénjeit/peptidjeit is megragadni, új fehérjestruktúrákat kialakítani és átörökíteni. A genomika és proteomika törvényszerűségei az MHC rendszer működésében találkoznak a legkézzelfoghatóbban, hiszen a különböző peptidstruktúrák és az azokat befogó MHC alfa/béta láncok által képzett „peptidcsapdák” térbeli szerkezetei számítástechnikai szimulációs módszerekkel megrajzolhatók, és a különböző peptidek és allotípusok esetében egyeztethetők. Ez például a nem is olyan távoli jövőben alapját képezheti a személyre szabott vakcinatervezésnek.
Az emberi rasszok is jellegzetes HLA polimorf sajátságokkal (fenotípus, haplotípus) rendelkeznek, melyek a migráció és a környezet jellegzetes patogén mikroflórájának hatása következtében alakultak ki. Ezek a populációs jellegzetességek magyarázzák az egyes népcsoportok fertőzésekkel és más betegségekkel szembeni eltérő érzékenységét, illetve rezisztenciáját.
Az MHC molekulák elsőrendű feladata a saját-idegen felismerésben való aktív és pasz-szív részvétel, mely folyamatot az antigén-processzálás és a peptidprezentáció biztosítja.
A 6. kromoszómán (egérben a 17. kromoszómán) a fő hisztokompatibilitási komplexen belül, az MHC II. HLA-DR és az MHC I HLA B szakasz között, jellegzetes helyet foglal el négy, az aktiváció során a veleszületett immunválasz egyik legfontosabb folyamatának, a komplementaktivációnak központi szereplőjével, a C3-mal funkcionális kapcsolatban levő komplementfehérje: a C4A, C4B, B faktor és a C2 génje. A filogenetikailag rendkívül konzervált, MHC III-nak nevezett szakasz genetikai eltérései jelentős funkcionális következményekkel járhatnak.
6. Példák a klinikai immunológiai genomikai diagnosztikából
Az onko-immunogenomika nyújtja talán a leglátványosabb példákat. „Lymphochipek” segítségével, amelyek ma már a kereskedelemben is hozzáférhetőek, és amelyek az emberi limfociták kifejeződő génkészletét tartalmazzák, eredményesen tudták alcsoportokra bontani az ún. „diffúz, nagysejtes B sejt limfóma” szindrómát, amit eddig a hagyományosabb szövettani, immunológiai, sőt molekuláris módszerekkel sem értek el. Az expressziós microarray eljárással a betegeket két csoportra sikerült osztani: a germinális centrum B-, illetve az aktivált B-jellegű betegekre. Az eredmény jelentősége az, hogy az előbbiek betegségkilátásai (például túlélési idő) sokszorosan jobbak az utóbbiakénál. Mindkét megközelítés a kezelési stratégiák vonatkozásában jelent hatalmas segítséget a klinikus orvosnak. Melanoma esetén az emberi genomból hét gént kiemelve, ezek expressziós mintázatán át sikerült például a májáttétekre vonatkozó predikciót sokkal pontosabbá tenni, ami ugyancsak annak ad nagyobb esélyt, hogy a klinikus a megfelelő terápiát a megfelelő időben alkalmazza. A hét kiemelt génből három a lokális immunválasz kimenetelével volt kapcsolatban (Kashani-Sabet, 2004).
A fertőzési genomika a mikroorganizmusok és a gazdaszervezet kölcsönhatásának egyedi és fajspecifikus elemeit képes vizsgálni terjedő és súlyos vírusfertőzések (például hepatitis, HIV), az egyre nagyobb és kiterjedtebb rezisztenciával jellemezhető bakteriális és gombafertőzések vonatkozásában. A nem túl távoli jövőben lehetségesnek látszik olyan DNS/cDNS microchip előállítása, amely potenciálisan minden ma ismert vírus, baktérium és mikroszkopikus gomba összes specifikus génjét tartalmazza. Lehetségesnek látszik tehát a mikrobiológiai diagnosztika felgyorsulása, akár egyetlen csepp vérből, és az is, hogy a megfelelő rezisztenciagének kimutatásával például az antibiotikum-érzékenység is az eddigieknél sokkal gyorsabban kerüljön megállapításra. Hatalmas lehetőség a vakcinakészítés genomikai megközelítése, a mikroorganizmusból a megfelelő immunológiai „céltáblák” (epitópok) hatékony és gyors kiemelése, sőt a beteg egyéni genetikai jellegzetességeihez igazított egyéni vakcinatervezés is.
Az allergogenomikai kutatásban és gyakorlatban sikerült például új, eddig nem ismert vagy funkciójukban nem azonosított géneket (például kemokinreceptorokat) találni atópiás dermatitiszben, illetve gyerekkori asztmában. Az érintett gének között eddig nem azonosított gének is vannak, ezek annotációja (funkcióazonosítása) folyamatban van, remélhetőleg vannak köztük olyanok is, amelyek új gyógyszercélpontokként jelölhetőek ki.
Az immunterápiák során ma már elterjedten alkalmaznak természetes vagy biotechnológiai módszerekkel előállított hatóanyagokat (például interleukinokat, interferonokat). Az immungenomika nagy ajándéka, hogy lehetségessé vált azon gének, génmintázatok felismerése, amelyek prediktív potenciállal rendelkeznek arra nézve, hogy az adott beteg hogyan fog a terápiára reagálni. Külön érdekesség, hogy ezek a gének jelentős etnikai különségeket mutatnak, esetenként markánsan eltérőek, például az orientál, illetve a kaukazoid népcsoportoknál (Wang et al., 2004).
7. A „nem várt, váratlan” eredmények az immunválaszban
Az immungenomika nagy értéke, hogy a hipotézis (vö.: prekoncepciós) alapú kutatás kizárólagossága helyett (ahol nyilvánvalóan már ismert géneket és termékeiket hipotézisek alapján tesztelünk) ma már eredményalapú kutatás is végezhető, ez a génhalászat. Itt „előítélet” nélkül ismerhetjük fel eddig nem ismert vagy ebben az összefüggésében nem feltételezett molekulák szerepét (3. ábra).
Teljesen nyilvánvaló, hogy a két megközelítés nem kompetitív, gazdagítja egymást. Néhány példa:
Dendritikus sejtekben (DC) a mikrobákkal aktivált génexpressziós változások zöme az első négy órában zajlik le. Így derült ki, hogy az IL-2 DC-ben is expresszálódik. Kiderült, hogy szklerózis multiplexben a léziókban a granulocita kolónia stimuláló faktor szintje jelentősen változik (ennek terápiás következményei is vannak, ez potenciális új terápiás eljárás). Kiderült a víztranszportban szereplő aquaporinok jelentősége a DC funkcióban (Moon et al., 2004), de így írták le az antigénprezentációban szerepelő plexin A1 és a neuropilin géneket is. Emellett rengeteg EST-t (expressed sequence tag), tehát még nem azonosított génszakaszt is találnak, melyek annotációján folyamatosan dolgoznak. Az intraepitheliális limfociták (IEL sejtek) genomikai analízise is sok új, „nem várt” információt adott. Nagyon jelentős eredmények várhatók a metilációs mintázatot mutató microarray-ek terjedésétől is, ami az epigenetikai eltérések egyik, ma divatos megközelítésének eszköze is.
8. Az immunológia posztgenomikai korszaka, epigenetika, biobankok és rendszerbiológia
Az ún. „posztgenomiális” korszakban a feladatok, amelyek a kutatók és az alkalmazók előtt állnak, igen nagyok. A hiányzó részek adatainak teljes feltárása és a már eddig is feltárt dokumentációs hibák kijavítása után sok, eddig nem létező műfajú munka következik. Ide tartozik a gének annotációja (azonosítása), a gének közti episztázisos kölcsönhatások és a ma még teljesen misztikus genomikai szinkronizációk, genomiális imprintingek (például metilációs mintázatok) jelentésének megfejtése. Az epigenetika körébe tartozik a már említett, a második repertoire-t létrehozó AID enzimrendszer funkciójának megértése is.
Már most is nagyon hatékony SNP haplotípus könyvtárak („hap-map” programok) állnak rendelkezésre (Evans et al., 2004) és naponta szaporodó on-line honapok és letölthető szoftverek sorozata segíti a kutatót, klinikust egyaránt (1. táblázat). A microarray-génchip technika hatalmas teljesítőképessége, miniatürizálhatósága (nanotechnológia), automatizálhatósága egymást erősítően kapcsolódik az informatikai technológia robbanásszerű fejlődéséhez, új, egyre jobb szoftverek kifejlesztéséhez és a nemzetközi számítógépes hálózati rendszerekhez. A megfelelő, valid, gyakorlati alkalmazáshoz is közelítő immungenomikai munka alapfeltétele a rasszokat és nemi különbségeket is jól reprezentáló biobankok kialakítása, amelyek a genomikai kutatás alapvető forrásai.
Az immunválasz bonyolult, sejtek és szolubilis molekulák sokasága által létrehozott, élettani (például hormonális, idegi), genetikai (örökletes) és környezeti tényezők által sok szinten szabályozott rendszer. Az immunológiai működés genomszintű megértése tehát nyilvánvalóan kizárólag rendszerszinten történhet. Az immunválasz megértése és eredményes befolyásolása csak a rendszerbiológia keretében és szemléletével valósulhat meg.
Talán nem véletlen, hogy a magyar kezdeményezésre 2004-ben elindult Immungenomikai Világkongresszus sorozat második találkozója már az immungenomika és az immun-bioinformatika közös konferenciája lesz, 2006 októberében, Budapesten.
Kulcsszavak: immunológia, bioinformatika, genomika, géncsaládok, immungenom, MHC, biobank, epigenetika, tumor, allergia, fertőzés

1. ábra • Az „immuntranszkriptom” az immunválaszban részt vevő sejtek génexpressziós mintázatának eltéréseit mutatja be. (Charles Mackay előadása alapján, Immungenomikai Világkongresszus, 2004. október, Bp.)

2. ábra • Az „immungenom”. A genom területén a gének 5,5-6 %-a az immunválasszal kapcsolatos géneket tartalmaz (John Trowsdale előadása alapján, Immungenomikai Világkongresszus, 2004. október, Budapest).
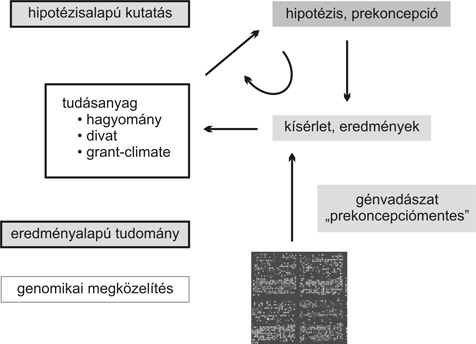
3. ábra • A „hipotézis”-alapú és a kísérlet-alapú kutatási stratégiák különbözősége és összetartozása
• MGI Mouse Genome Informatics (www.informatics.jax.org)
• GenBank Nemzetközi Genomikai Adatbázis (www.ncbi.nlm.nih.gov)
• TRANSFAC The Transcription Factor Database (www.gene-regulation.com)
• CSNDB The Cell Signalling Networks Database
• MIPS Munich Information Centre for Protein Sequences
• Bodymap Emberi és
egérgén expressziós adatbázis,
Tokió
(http://bodymap.ims.u-tokyo.ac.jp)
• SHIGEN SHared Information of GENetic Resources, Japán (www.shigen.nig.ac.jp)
• Kabat Antibodies – struktúrák és szekvenciák.
• ProDom Protein Domain adatbázis (http://protein.toulouse.inra.fr/prodom/current/html/home.php)
• GOLD Genomes OnLine Database.
• Cytokines Információs központ a citokinekről (receptorai és azok 3-D struktúrái) (http://cmbi.bjmu.edu.cn/cmbidata/cgf/CGF_Database/cytweb)
• The SNP Consortium (http://snp.cshl.org)
• SIB 21-es emberi kromoszóma cSNP (cDNA-n belüli SNP) adatbázisa.
• NCBI SNP adatbázis (www.ncbi.nlm.nih.gov/SNP)
• Utah SNPs adabázis (www.genome.utah.edu/genesnps)
Folyóiratgyűjtemények:
• Nucleic Acids Research kutatási eredményei (http://nar.oupjournals.org)
• ENTREZ. MEDLINE és szekvencia-adatbázisok együtt (www.ncbi.nlm.nih.gov/entrez)
• PubMed Central Tudományos folyóiratok gyűjteménye (www.pubmedcentral.nih.gov)
1. táblázat • Immungenomikai adatokat (is) tartalmazó adatbankok és bibliográfiai források
Irodalom
Conticello, Silvestro G. – Thomas, C. J. – Petersen-Mahrt, S. K. – Neuberger M. S. (2005): Evolution of the AID/APOBEC Family of Polynucleotide (Deoxy)cytidine Deaminases. Molecular Biology and Evolution. 22, 367–377.
Evans, David M. – Cardon, L. R. – Morris, A. P. (2004): Genotype Prediction Using a Dense Map of SNPs. Genetic Epidemiology. 27, 375–384.
Kashani-Sabet, Mohammed (2004): Melanoma Genomics. Current Oncology Reports. 6, 401–405.
Kelley, James – Walter, L. – Trowsdale, J. (2005): Comparative Genomics of Major Histocompatibility Complexes. Immunogenetics. 2005; 56: 683-695.
Knudsen, Thomas B. – Green, Maia L. (2005): Response Characteristics of the Mitochondrial DNA Genome in Developmental Health and Disease. Birth Defects Research Part C, Embryo Today. 72, 313–329.
Moon, Chulso – Rousseau, R. – Soria, J. C. – Hoque, M. O. – Lee, J. – Jang, S. J. – Trink, B. – Sidransky, D. – Mao, L. (2004): Aquaporin Expression in Hhuman Lymphocytes and Dendritic Cells. American Journal of Hematology. 75, 128–133.
Moshe, Yakir – Boulaire, J. – Pagano, M. – Hershko, A. (2004): Role of Polo-like Kinase in the Degradation of Early Mitotic Inhibitor 1, a Regulator of the Anaphase Promoting Complex/Cyclosome. Proceedings of the National Academy of Sciences of the USA. 101, 7937–7942.
Radda, George K. – Viney, Ian (2004): From Gene Function to Improved Health: Genome Research in the United Kingdom. Journal of Molecular Medicine. 82, 74–90.
Sallusto, Federica – Mackay, Charles R. (2004): Chemoattractants and Their Receptors in Homeostasis and Inflammation. Current Opinion in Immunology. 16, 724–731.
Sospedra, Mireia – Martin, Roland (2004): Immunology of Multiple Sclerosis. Annual Review of Immunology. 27 Sep. 2004. [Epub ahead of print] trait analysis
Wang, Bin – Lin, D – Li, C – Tucker, P. (2003): Multiple Domains Define the Expression and Regulatory Properties of Foxp1 Forkhead Transcriptional Repressors. The Journal of Biological Chemistry. 278, 24259–2468. http://www.jbc.org/cgi/content/full/278/27/24259
Wang, Ena – Lichtenfels, R – Bükur, J – Ngalame, Y – Panelli, MC – Seliger, B – Marincola, FM. (2004): Ontogeny and Oncogenesis Balance the Transcriptional Profile of Renal Cell Cancer. Cancer Research. 64, 7279–7287.
Wang, Ena – Falus András. (2004): Changing Paradigm through a Genome-based Approach to Clinical and Basic Immunology. Journal of Translational Medicine. 2, 2–4.
<-- Vissza a 2006/3 szám tartalomjegyzékére
<-- Vissza a Magyar Tudomány honlapra
[Információk] [Tartalom] [Akaprint Kft.]