Rendszerszemléletű biológia; posztmodern genomika túl a géneken?
Falus András
az MTA levelező tagja, egyetemi tanár, intézetigazgató
Genetikai, Sejt- és Immunbiológiai Intézet, Semmelweis Egyetem
faland @ dgci.sote.hu
A tudományos eredmények gyorsuló növekedése és az információ interneten megvalósuló áramlása együttesen határozzák meg korunkat. A korábban elképzelhetetlen hatékonyságú kommunikációs felületek révén a „fejlett” világ tudományossága szinte egy nagy közös „cybertérben” zajlik a tervezéstől a pályázáson át a gyakorlati megvalósulásig és a piacok eléréséig. A tudományos közösség sosem látott lehetőséget kap a legkorszerűbb tudás megszerzésére a világhálón keresztül, a tudomány igazi demokratizálásának útja az interneten át vezet.
Az élőtudományok a többi tudományhoz képest még különlegesebb helyzetben vannak, hiszen amellett, hogy betagolódnak a fent említett tudáshálózati közegbe, kutatásuk tárgya maga a hatalmas információtartalmú élő anyag, melyben a variációk mértéke (például a DNS nukleotid varianciája és egyes szakaszok ismétlődése) csak kozmikus gigadimenziókkal érzékelhető. A komplex életjelenségeket vizsgáló biológia egésze ma mindinkább módosul, és a jelenségeket hálózati rendszerekként értelmezni képes rendszerszemléletű biológiává (systems biology) alakul. A rendszerszemléletű biológia azért bontakozhatott ki, mert létrejött a genomika (széles értelemben, idevéve a proteomika és metabolomika területeit is), az emberi intellektus egyik leglátványosabb teljesítménye a 3. évezred elején, a globalizált tudás előremutató példája.
A genetika, azaz öröklésbiológia a vertikális biológiai információátadás tudománya, napjainkban, az összes gén egyidejű vizsgálata révén globális genetikát tesz lehetővé. A genomika azonban ennél többet: genom alapú, genom léptékű biológiát jelent. Ez a teljessé váló hatalmas, interneten elérhető genomiális adatbázisok, a nagy áteresztőképességű nano-biotechnológiák, a bioinformatika és a komputertudományok ötvözeteként rendszerszemléletet hozott a biológiai tudományokba, illetve az orvostudomány minden résztudományába is. A bioinformatikai, biostatisztikai/biomatematikai megközelítés korrelációs, klaszterképző eljárásokkal és egyéb, naponta bővülő szoftvermegoldásokkal elemzi a genomiális/expressziós adatbankok és a génchiptechnika által szolgáltatott adathalmazt, majd biológiai következtetésekre alkalmas elemzést nyújt.
A bioinformatika különleges értéke az in silico (tehát komputerrel végzett) megközelítés, tehát a nemzetközi adatbázisokhoz kapcsolódó számítógépes munka (dry lab), ahol esetleg laboratóriumi munkától (wet lab) elkülönülten is végezhető korszerű, kreatív, de egyben „génhalászaton” alapuló genomikai kutatás. Ez lehetőség térben (távolról) és időben (régebben) végzett adatgyűjtés értékelésére, és ez teszi a genomikát, a proteomikát és a most kezdődő metabolomikát igazán integratív egészségtudománnyá (systems medicine).
Genomika, metodikarendszer és szemlélet
Az emberiség kultúrtörténetének évezredei alatt az élet „princípiumainak” természettudományos megközelítése tükrözte a mindenkori élettelen (kémia, fizika), matematikai és élőtudományainak színvonalát. A biológia az a természettudomány, amely az élő rendszerek felépítésének és működésének természettudományos megismerésével foglalkozik. A Watson–Crick-tézisek, tehát a dezoxiribonukleinsav (DNS) kettős helikális szerkezetének mint modell felismerése és a „három nukleotid=1 aminosav” kódolási séma megértése óta beszélünk molekuláris biológiáról, amely szemléletével és a vizsgáló módszerek kiterjesztésével átalakította a biológia, a biomedicinális tudományok teljes körét. A genetika, az öröklésbiológia, az időben vertikális biológiai információátadás tudománya napjainkban átlépett egy tudománytörténeti küszöböt. A közvetett, majd megfigyeléseken és kísérleteken alapuló „klasszikus” genetika után, a molekuláris biológiai, biotechnológiai forradalom nyomán bekövetkezett sok organizmus, többek között az emberi genom nukleotidsorrendjének gyakorlatilag teljes feltárása. Ez a hatalmas, nagyrészt még további finomításra, kiegészítésekre váró „adatóceán” az emberi gondolkodás történetében eddig nem tapasztalt új helyzetet teremtett. Sokunk meggyőződése, hogy sok tekintetben most lépünk át egy új korszakba, napjainkban kezdődik az „írásbeliség” a biológiában. Az ezredforduló egy rendkívül jelentős paradigmaváltással, a genomikai megközelítés bevezetésével esik egybe.
A genomika a DNS-szintű variációk és a génexpressziós mintázat bioinformatikailag kiértékelt biológiai összhangzattana (genom alapú biológia). Így például az onkogenomika genom alapú rákkutatást, a farmakogenomika genom léptékű gyógyszertant és az immungenomika genomtudásra alapuló immunológiát jelent.
A genomika három, tudománytörténeti értelemben egyenként is jelentős előrelépés időbeli és motivációs egybeesése következtében vált reális lehetőséggé.
Genomprogramok
Az első alap a genomprogramok „lexikális” szakaszának befejezése. Mint tudott, 2001 első hónapjai óta már baktériumok, élesztő, a szőlőmuslica, fonálféreg és növények mellett az emberi genom teljes géntérképe rendelkezésre áll, a világháló adatbázisaiból lehívható és elemezhető. Ma mintegy négyszáz faj genomjának teljes bázissorrendje ismert, további ezerötszáz faj vizsgálata van folyamatban. Bár a gének annotációja (azonosítása) még sok időt vesz igénybe, ez a lexikális tudásanyag új genetikai információs minőséget jelent.
Mai tudásunk szerint az emberi faj nagyon egységes, a rasszok (például orientál versus kaukazoid) között kevesebb mint 0,1 % eltérés mutatható ki nukleotidbázis szinten. Meglepő eredmény volt az is, hogy csak mindössze 26-28 ezer gén található a humán genomban. Ennyi gén emberben mintegy 3,2 milliárd (3,2×109) bázispár formájában jelenik meg, tehát a humán genom sokkal „hígabb”, mint például az apoptóziskutatással elhíresült Caenorhabditis elegans nevű fonálféreg genomja, ahol a kb. 19 ezer gén az emberi genomnak kevesebb mint egyharmadán (97×106 bázispár) helyezkedik el, vagy akár a fugu hal genomdenzitása. A génsűrűség az emberi genomon belül is meglehetősen egyenetlen, a legnagyobb génsűrűség a 17, 19, 22-es kromoszómákon tapasztalható, míg a 4, 13, 18-as és az ivari kromoszómák (X és Y) génekben viszonylag szegények. Úgy tűnik, hogy míg a „háztartási” (például az anyagcsere alapfolyamatait meghatározó) gének száma és polimorfizmusa nagyjából állandó, a külvilággal való kommunikációért felelős gének száma markánsan emelkedik az élővilág fejlődésének magasabb fokán. Ami a gének annotációját (funkcionális azonosítás) illeti, a helyzet már kevésbé biztató, és a már annotáltak között is nagyon sok a téves adat, ezek javítása folyamatosan történik. A bázissorrend meghatározása („szekvenálás”) során a teljesítőképesség elképesztően felgyorsult. A sorok írója 1985-ben az egér C2 génjében a 183 bázispár sorrendjét fél év alatt határozta meg, ma már sok százezer bázist tudnak naponta elolvasni. Sőt, a kipróbálás alatt lévő nanoszekvenálás mintegy egymillió bázispár/másodperces sebességgel fogja ontani az adatokat, tehát egy emberi genom leolvasása egy órán belül megtehető. A mai mintegy 10 000 $/genom költségeket pedig 1000 $ alá kívánják szorítani.
Túlnyomó a nem kódoló, régebben információ híján „junk” (szemét) DNS-nek nevezett rész aránya (~98,7 %!), lásd később. A genomprogramok egyik legfontosabb hozadéka az SNP-k (single nucleotide polymorphism, pontmutáció) sokaságának feltárása, amely sokak szerint a genetika történetének legígéretesebb, és gyakorlatban (például farmakogenomika) is használható, genomszintű polimorfizmusmintázatok meghatározására is alkalmas genotipizálási módszernek ígérkezik. A HapMap projekt publikusan elérhető adatbázisa (www.hapmap.org) az összes ismert SNP-t tartalmazza, mai tudásunk szerint az emberi genom mintegy 20 millió SNP-t tartalmaz.
Microarray („génchip”) technológia
A második, a nagyteljesítményű microarray (chip) eljárás, melynek speciális jellegzetességei nagyságrendekkel emelik az egyidejűleg vizsgálható gének számát, szerkezeti (nukleotidsorrend) és funkcionális (génkifejeződés-mRNS) információk tömegét képes nyújtani. A génchipek (génlapok) rendezetten (microarray), sorokban és oszlopokban több tízezer ismert nukleotidszálat tartalmaznak, ezekhez kapcsolódik a jelzett minta nukleinsav. A fluoreszcens festékekkel láthatóvá tett kötődési mintázatot a komputer értékeli, és ismerve a génlapon levő elrendezést, a pozitív/negatív reakció alapján jellemzi a minta genetikai tartalmát. Egyszerre több tízezer (akár a teljes genom) gén kifejeződése értékelhető ezzel az eljárással. Ma már fehérjelapok is rendelkezésre állnak, tehát a proteomika is használja ezt a nagy teljesítőképességű, összehasonlító elemzésekre alkalmas biológiai nanotechnológiát. A génchip technika sok szinten alkalmazható, legelterjedtebb a génexpressziós profilok jellemzése. Immunológiai példával élve: B limfocitákon elvégezhető az immunglobulin receptorok, citokinreceptorokon ható jelek vagy például hisztamininhibitorok hatásának molekuláris nyomon követése. Kitűnően azonosíthatóak a genetikai beavatkozások (pl. antiszensz hatások, RNS interferencia, domináns negatív mutáció, génkiütés) minden génre kiterjedő hatásai is. A microarray technológiát ma már nagyobb genomi eltérések, metiláció, transzkripciós faktor, proteomikai, valamint mikro-RNS (lásd később) mintázat meghatározására is alkalmazzák.
Bioinformatika, rendszerszemléletű biológia
Végül a harmadik fundamentum, talán a legfontosabb, a bioinformatika. Ez az új biostatisztikai/biomatematikai megközelítés korrelációs és halmazelméleti eljárásokkal elemzi a genomiális/expressziós adatbankok és a génchip technika által szolgáltatott adathalmazt, és biológiai következtetések levonására alkalmas elemzést nyújt.
Az egyes chipekről bekerülő adathalmaz bioinformatikai elemzése nyomán a számítógép klaszterekbe rendezi a kapott információkat. Erre egy példa a hierarchia klaszter korrelációs analízis. Itt egy olyan mátrixábrázolás az elemzés eredménye, ahol az egyes oszlopok az egyedi mintákat, az egyes sorok az egyes géneket jelentik. A számítógépes összerendezés lényege az, hogy a többé, majd egyre kevésbé hasonló géneket kifejező mintákat csoportokba rendezve tüntetik fel. A chipanalízis teljes logisztikája tehát úgy fest, hogy az egyes mintákból származó egyedi microarray adatok bioinformatikai összegzése után számítógépes adatbankok meglévő mintázatkönyvtárai segítségével szerkezeti homológiára, illetve feltételezhető funkcióra vonatkozó következtetéseket vonhatunk le. Lehetséges bizonyos nukleinsav motívumok (például transzkripciós faktorok kötésére alkalmas „válaszelemek”) keresése, ami például egy biológiai hatás sokrétűségének megértéséhez vihet közelebb. A következtetések természete diagnosztikai és prognosztikai egyaránt lehet, továbbá mára gyakorlat lett olyan géncsoportok kiemelése, amelyeknek predikciós potenciáljuk van, tehát előre jeleznek valamely, például betegségi állapot, szövődmény, mellékhatás stb. bekövetkezését. Nagyon elterjedőben vannak az ún. „szomszédosság”-értékelő algoritmusok, amelyekkel egy-egy génlap mintázatából egymással biológiai összefüggésben álló folyamatsorok (például jelátviteli vagy apoptotikus kaszkádok) genetikai mechanizmusa, és így például „betegségutak”, és azokban új gyógyszercélpontok tárhatóak fel. A géncsoportok, hálózatok komplex, egységes mintázatvizsgálata a rendszerszemléletű biológia (systems biology), ez a mai biológiai gondolkodás talán leglényegesebb új paradigmája.
A bioinformatika különleges ajándéka az in silico megközelítés, tehát a nemzetközi adatbázisokhoz kapcsolódó számítógépes munka, ahol esetleg laboratóriumi munka nélkül is végezhető korszerű, kreatív, de egyben „génhalászaton” alapuló genomikai kutatás. Ez a lehetőség térben (távolról) és időben (régebben végzett adatgyűjtés értékelése). Ma már lehetséges szövettani blokkokból is rendezett „microarray-t” készíteni, esetenként akár több száz szövettani blokkból kiemelt hengerek együttes metszése nyomán létrehozott készítményen. Ezen akár nukleinsavexpressziós (például in situ génamplifikáció), akár proteomikai analízis is végezhető.
Posztgenetika, mikro-RNS-ek, pyknonok, „haploidomics”
Mint említettük, a genom 98,7 %-a nem fehérjét kódol, ezt a hatalmas részét a genomnak sokáig „szemét” (junk) DNS-nek nevezték (jó példáját adva a nevetséges, a valódi tudományosságra legkevésbé sem jellemző emberi nagyképűségnek). A látszólag értelmetlen ismétlődések, például a fraktálgeometria nyelvén kódolva, mint sokan feltételezik, jelentős információt hordoznak.
Kiderült emellett, hogy a nem kódoló genom jelentős részéről is megtörténik az RNS-kópia átírása. Hamarosan megtudtuk, hogy egy hajtű alakú DNS előalakból két enzim közreműködésével hamarosan 22 nukleotid méretű ún. mikro-RNS (miRNS) alakul ki (1. ábra). A miRNS-k összes funkcióját még távolról sem ismerjük, de egyik ezek közül az ún. gene silencing, azaz a valódi génekről átíródó messenger RNS inaktiválása a miRNS által (haploidomics). A miRNS-ek száma mára elérte a több százat, és jelentőségüket jól sejteti az a ma még inkább leíró és csak hiányosan magyarázott eredmény, hogy egyre több tumorban, onkogének és tumor szuppresszor gének szabályozásában ismernek fel a normálistól eltérő miRNS-mintázatot. Újabb ugrást jelent a pyknonok azonosítása. 2006 áprilisában tudtuk meg, hogy a nem kódoló részben több millió olyan igen konzervatív, rövid szakasz (pyknon), illetve százezernél több pyknonmintázat található, amelyeknek megfelelő nukleotidszakaszok szinte minden ismert génben is kimutathatóak. Ezek az új eredmények a génexpresszió, az egyedfejlődés (és azok rendellenességei) a jó- és rosszindulatú sejtosztódás szabályozásának egy újabb szintjét vetítik előre, és gyökeresen módosítják a kódoló-nem kódoló szakaszok kapcsolatáról alkotott elképzeléseinket. Ma már nagyon sok információnk van a nem kódoló DNS-sel kapcsolatos betegségekről, és a lista naponta bővül (http://www.junkdna.com/junkdna_ diseases.html).
Paradigmaváltás a molekuláris biológiai kutatásban, a gének, génhálózatok és szakirodalmi hálózatok felhasználása
A génhalászat stratégiája egyben tudománytörténetileg is gyökeresen új megközelítést jelenít meg. Eddig, az ismeretek alapján, „prekoncepciók” alapján történt a hipotézis felállítása, és a kísérletek a már ismert elemekre (például fehérjék), tudásra, „divatokra” alapozódtak. A genomikai szemlélet, a nano-biotechnológia (például az összes gén expresszióját együtt vizsgálni képes microarray, vagy akár több millió pontmutáció egyidejű detektálása) és a bioinformatika segítégével, ma már lehet előzetes teória nélkül is kutatni (2. ábra). Kicsit profanizálva, ez hipotézisen alapuló kutatás helyett eredményekre építő kísérleti munkát jelent. Természetesen nagyon helytelen és tudománytalan e kettőt szétválasztani, csak arra próbáltam utalni, hogy a rendszerszemléletű biológia előtt ez a korlát már leomlott, minden biológiai összetevő vizsgálható, függetlenül előzetes tudásunktól. A szerző meggyőződése, hogy a genomikai technológiákból származó adatóceán segíteni fogja a kutatói intuíció és hipotézisalkotás tevékenységét.
Az orvostudomány ma mindinkább (motivációs és financiális okokból egyaránt) a nagy tömegeket érintő ún. komplex betegségek (például asztma, szív- és érrendszeri kórképek, daganatos betegségek, elhízás kóros formái) felé fordul. Ezen betegségek mindegyikét sok örökletes és környezeti tényező együttesen határozza meg, és legtöbbjük az egyes etnikumokban más módon jelenik meg. A vezető tendencia ma egyre inkább az, hogy nagy többközpontú, egyre gyakrabban nemzetközi tudáshálózatok dolgoznak együtt, és a tudományos kutatás komplex betegségútvonalak génhálózati hátterének feltárása felé irányul, amely szinte azonnal új gyógyszerek lehetőségét is kínálja. A vizsgálatok, kiegészülve a bioinformatikai modellekkel ma már nemcsak egyes gének sorozatát képesek feltárni, de lehetséges olyan „neuronális” kapcsolatrendszerek, gén- és géntermékhálózatok azonosítása is, mely a komponensek egymáshoz való viszonyáról információkat nyújt. Az „omics” korszakban a kutatási (például genomikai, proteomikai, metabolomikai, glukomikai, lipidomikai stb.) eredmények mellett ma már bizonyos szofverekkel a vonatkozó szakirodalom szavait is lehet elemezni. Ekkor például több százezer közlemény szövegelemzése nyomán kialakított „consensus hálózatokra” vetítik egy kísérlet eredményeit, ezzel behelyezve azt a „bibliomikai” hálózatba. A bibliomikai és genomikai adathálózatok egymásra vetítése már konkrét eredményeket is hozott. Ennek eredményeképpen 2006-ban igen meglepő és nagy hatású közlemények láttak napvilágot a neuropszichiátriai területen a skizofrénia és az autizmus témájában. A megfelelő klinikai adatbázis, a szakirodalom állításainak hálózatos elemzése és a hatalmas teljesítményű genomikai nano-biotechnológia együtt számos új betegségútvonal (disease pathway) mechanizmusára derített fényt.
Orvosbiológiai kollaborációs gridek, nemzetközi hálózatok
Nem állunk távol az igazságtól, ha hatalmas, valódi munkamegosztáson alapuló nagy nemzetközi (például EU) munkacsoportok összekapcsolódását prediktáljuk. A klinikus, a maga empirikus és műszeres eszközrendszereivel és adatbankjával, a kutató a nagy teljesítőképességű genomikai mérési rendszereivel és az informatikus az elemző, értékelő és modellalkotási lehetőségeivel együtt – és csakis együtt – képes jelentős eredményeket elérni a diagnosztikában, a terápiában. Ezt a gridet támogatják a nagy kohortok biológiai mintagyűjteményei (biobankok), az innovációs szakember, illetve a mellettük ma már kötelezően feladatot kapó bioetikus és kommunikációs szakember is (3. ábra).
Itthoni helyzet
Hazánk az elmúlt négy-öt évben egyre több nemzetközi bioinformatikai projektbe kapcsolódott be, e folyamatot az Európai Unióhoz történt csatlakozás nagymértékben gyorsította. A hazai genomikai kutatás az elmúlt három évben jelentős és látványos sikereket ért el. Szinte a csatlakozás után azonnal egy európai pályázat elnyerése nyomán létrejött a Genomikai Kutatás az Emberi Egészségért konzorcium (www.humangenom.hu). A pályázók, köztük e sorok írója, a hazai felsőoktatás és akadémiai szféra genomikával foglalkozó kutatását képviselik, és a konzorcium azóta is jelentős koordinációs tevékenységet folytat. Létrejött a hazai biobankrendszer internetes központja (www.biobank.hu), melyben eddig több tucat hazai genetikai/genomikai kutatást, diagnosztikát folytató munkahely egyesítette erőit.
2004-ben hazai kezdeményezésre megvalósult a nem várt nagy érdeklődéssel kísért Immungenomikai Világkongresszus (www.diamond-congress.hu/bci2004). 2006-ban az immungenomika már a vadonatúj immuninformatikával (=immunomika) kombinálódik (www.bcii2006.org).
Nagyon jelentős fejlemény, hogy a hazai felsőoktatás nagy intézményeiben megkezdődött, illetve szervezés alatt van a bioinformatika oktatása (például http://bioinfo.elte.hu, http://ramet.elte.hu/~miklosi/Bioinformatika/2005SOTE) és az, hogy már számos egyetemen megindult a bioinformatikus doktoranduszképzés. 2006-ban megalakult a Magyar Bioinformatikai Társaság (http://www.renyi.hu/~hsb/), amely a közelmúltban tartotta az első konferenciáját az MTA-n (http://www.renyi.hu/conferences/HSB_alakulo/program.html).
Pozitív jövőkép, orvosbiológiai kutatás és a nemzetközi trendek
A jövő az integratív genomika és a bioinformatika alapján egyértelműen új utat jelöl ki az orvosbiológia fejlődésében, a megelőzésben, diagnosztikában és a gyógyításban, gyógyszer-, védőoltás-fejlesztésben egyaránt. A tudáshálózatok és a bioinformatika a genomika révén jelentősen nagyobb esélyt adnak az életminőség javításának, az átlagéletkor emelésének és a genomikát egyértelműen prioritásként kezelő nagy nemzetközi (például az előző és a most induló 7. Keretprogramban) források bevonásával a hazai tudományos kutatás, illetve egészségügyi ellátás javításának.
E sorok írója nem kívánja a divatos pesszimizmus vagy elegánsnak tűnő szkepticizmus mögé rejteni lelkesedését. Örül, hogy kortárs lehet, egy hatalmas ugrás többé-kevésbé közeli nézője, szerény résztvevője. Örül, hogy azok közé tartozhat, akik elkezdhetik a genomika oktatását, terjesztését a következő generáció számára, és részt vehet az egyre inkább felértékelendő ismeretterjesztésben, ami érthető, igaz és érdekes képet ad a nem szakmabeli kortársaknak. Örül, mert meggyőződése, hogy egy józan, reális, nem-ideologizált tudomány nem csúszik sem a démonizálás, sem pedig a bálványgyártás hibájába. Örül, mert meggyőződése, hogy a genomika tudománya áldás és nem átok, mert például megérteni a daganatok és az allergia molekuláris genetikai profilját, diagnosztizálni és megakadályozni az Alzheimer-kórt, feltárni az emberi fejlődés őstörténetét, molekuláris részleteiben megismerni a prekambriumi tengerek élővilágát nagyszerű, gazdagító közös tudást jelent. Ugyanakkor természetesen tudja, hogy mint oly sok más tudomány, a genetika/genomika is hordoz veszélyeket az emberi személyiségi jogok esetleges megsértésétől kezdve, az illegális, reproduktív klónozási horror kísérletezgetésekig, az ökológiai veszélyektől egészen a genetikai beavatkozások nem kiszámítható mellékhatásáig. Tudja továbbá, hogy a genomika (hasonlóan más tudományokhoz) korántsem mindenható, bizonyos (orvos)biológiai kérdések (például magasabbrendű agyműködés, pszichikai funkciók) nem lesznek kizárólagosan genomikai szinten megoldhatóak. (Innen is látszik, hogy a redukcionizmus korlátoltsága a genomikát sem hagyja érintetlenül.) Mégis, meggyőződése, hogy a sokszor eltúlzott veszélyek megfelelő nyilvánossággal és legitimált szabályokkal kezelhetőek, a visszaélések korlátozhatóak, és nemzetközileg szankcionálhatóak.
Bízhatunk abban, hogy a genomika várható fejlődése, a hatalmas paradigmaváltás, a genomika rendkívüli nemzetközi pályázati favorizálása és az érthető nyilvánosság révén mind többek számára derülhet ki, hogy a tudomány kiemelt erkölcsi és anyagi megbecsülést érdemlő gazdagító érték, és szépsége révén pozitív esztétikai kategória egyben.
Kulcsszavak: bioinformatika, genomika, komplex orvosbiológiai kutatás, rendszerszemléletű biológia, útvonalanalízis

1. ábra • A hajtűszerű mikro-RNS előalakból 22-23 nukleotidbázis méretű mikro-RNS alakul ki, mely komplementaritás esetén gátolja a miRNS-ek működését.

2. ábra • A tudományos kutatás gondolati stratégiájának új útja a genomika és a rendszerszemléletű biológia korszakában
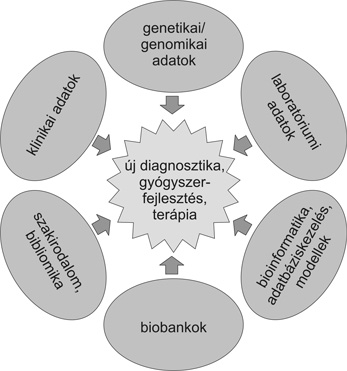
3. ábra • A többközpontú klinikai genomikai kollaborációk sémája
IRODALOM
Falus András (2006): Fejezetek a genomléptékű biológiából és orvostudományból. Semmelweis, Budapest
Pongor Sándor – Falus András (2005): Bioinformatics as a Problem of Knowledge Representation: Applications to Some Aspects of Immunoregulation. In: Falus András (ed.): Immunogenomics and Human Disease. John Wiley & Sons Ltd. London, 107–132.
Radda, George K. – Viney, Ian (2004): From Gene Function to Improved Health: Genome Research in the United Kingdom. Journal of Molecular Medicine. 82, 74–90.
Wang, Ena – Falus András (2004): Changing Paradigm through a Genome-based Approach to Clinical and Basic Immunology. Journal of Translational Medicine. 2, 2–4.
<-- Vissza a 2006/11 szám tartalomjegyzékére
<-- Vissza a Magyar Tudomány honlapra
[Információk] [Tartalom] [Akaprint Kft.]