Szöveti destrukció,
korai diagnosztika és célzott terápia reumatoid artritiszben
Poór Gyula
egyetemi tanár, az MTA doktora
Országos Reumatológiai és Fizioterápiás Intézet, Semmelweis Egyetem, Budapest
poor.gyula @ orfi.hu
A reumatoid artritiszt (RA) az általa okozott szerteágazó és súlyos klinikai kép, valamint a betegség számos vonatkozásban még ma is megfejthetetlen kialakulása és patomechanizmusa alapján a reumatológiai betegségek királynőjének tartjuk.
A kórkép elsősorban a fiatal középkorú nőket támadja meg, és hazánkban összesen mintegy 70-80 ezer beteg érintettségével számolhatunk. Az RA egy autoimmun hátterű, krónikus progresszív sokízületi gyulladás (poliartritis), mely az ízületek destrukciója és deformitása révén a betegek fájdalmát, mozgáskorlátozottságát, rokkantságát és életminőségük jelentős romlását idézi elő (Harris, 2005). A kórkép nemcsak az ízületeket érinti, hanem ízületen kívüli tünetekkel is jár. A kiserek szisztémás gyulladása (vaszkulitisz) például gyakorlatilag minden szervben, így a koszorúsereken és az agyi ereken is megjelenhet, speciális szöveti károsodást okozva. A tüdőkben jellegzetes diffúz kötőszövetszaporulat (intersticiális fibrózis) alakulhat ki, esetenként a bőrhöz és más szervekhez hasonlóan kerek árnyékok az ún. reumatoid csomók kíséretében. A vesében hosszabb fennállás esetén fehérjetermészetű szerves anyag, amiloid képződhet, a vesefunkció jelentős beszűkülését vonva maga után. Mindezek a szervi manifesztációk a reumatoid artritiszben szenvedő betegek várható élettartamát mintegy tíz évvel rövidítik meg kortársaikhoz képest (O’Dell, 2004).
Mit lehetett tenni a betegség ellen mondjuk száz évvel ezelőtt, a festőfejedelem, Pierre-Auguste Renoir korában (1. ábra) aki a kórképben szenvedve élete végén már csak úgy tudott tolókocsiból festeni, hogy az ecsetet a nyomorék kezéhez kötötte (lásd Renoir Múzeum, Cagnes-sur-Mer)? A szalicilátokon kívül nem sokat, melynek mellékhatásai közismertek, és állítólag Renoir halálában is komoly szerepet játszott a szalicil okozta gyomor-vékonybél vérzés. Szerencsére az utóbbi évtizedben a helyzet alapjaiban változott meg, és a reumatoid artritisz kórfolyamatának megismerésében és érdemi befolyásolásában szakterületünk nagyon komoly sikereket ért el. Mára már elmondható, hogy a kezünkben vannak a betegség elleni fellépésnek hatékony eszközei, melyek a betegség kialakulásának és kórfejlődésének (etiológia és patogenezis) mélyebb megismeréséből, a korai fázisban történő diagnosztikából és prognosztikából, valamint az időben elkezdett erélyes és célzott gyógyszeres terápiából állanak, mely utóbbi a biológiai terápiás szerek alkalmazását is magában foglalja. Az alábbiakban erről a három egymást feltételező és segítő kutatási irányról lesz szó, mely ma már nagy részben a rutin betegellátás szerves részévé is vált.
A kórfolyamat alapjainak megismerése
A reumatoid artritisz patogenezisének (Smith – Haynes, 2006) lefolyását didaktikusan három időbeli szakaszra (iniciális, centrális, destruktív) bontjuk, azonban tudjuk, hogy a folyamatok egymás mellett, egymással kölcsönhatásban is zajlanak (1. táblázat).
Az iniciális szakban a szervezet betegségre való fogékonyságát a közös (shared) epitop megléte adja, ami a HLA (humán leukocita antigén) láncának 3. hipervariabilitási régiójában meghatározott, 70-74 közötti aminosavszekvenciát jelent. Emögött leggyakrabban a glutamin (Q), leucin (K), arginin (R), alanin (A), alanin (A) sorrend verifikálható. A karakterisztikus aminosav szekvenciát a 6-os kromoszómán lévő, az MHC (major histokompatilibitási complex) II. osztályába tartozó speciális HLA DRB1 genetikai szubtípusok kódolják. Ezek a HLA DRB1*01 (*0101, *0102) a HLA DRB1*04 (*0401, *0404, *0405, *0408) és a HLA DRB1 *10 (*1001). Vizsgálataink alapján elmondható, hogy a hazai populációban *0101 és a *0401 a két leggyakoribb betegségre hajlamosító szubtípus.
A betegség előidézésében a genetikai háttér mellett különböző virális (retrovírusok, Epstein–Barr-vírus, hepatitis B és C, humán herpeszvírus C, parvo vírus B19 stb.) és bakteriális (mikobaktériumok, E. Coli, proteusz, chlamydia stb.) infektív antigéneknek is szerepük lehet. Saját vizsgálatainkban a hepatitis B és C vírusfertőzés szerepét írtuk le RA-ban, és javasoltuk az artritisz-szűrésekben kötelezővé tenni a vizsgálatot (Csepregi et al., 2000, 2004). A feltételezett patomechanizmus a molekuláris mimikri jelensége, mikor is az infektív antigén és a szervezet szöveti struktúrája közötti genetikai hasonlóság miatt a keletkezett antitestek a szervezet egyes szöveteivel is reakcióba lépnek (2. ábra).
A centrális gyulladásos szakaszban az exogén antigén prezentálásában az említett MHC II. fehérjemolekulákat felszínükön hordozó különböző immunológiai sejtek (makrofágok, monociták, dendritikus sejtek, B-limfociták stb.), míg az antigén felismerésében a CD4+ T helper (Th) limfociták receptorai vesznek részt. A találkozás a Th sejtek aktiválódását indítja el, mely a kóros immunológiai történés beindulásának a kulcsa. Az utóbbi évek kutatásai igazolták, hogy a Th sejtek teljes aktivációjához az antigén felismerésén túlmenően egy kostimuláció is szükséges. RA esetén ezt a legfontosabb második szignált a CD80/86+ antigén prezentáló sejtek és a CD28+ T helper sejtek interakciója jelenti, mely folyamatot a CTLA-4 nagy aviditású receptor expressziója képes leállítani. Ezután a véráramból hazatérnek, vagyis az ízületi (szinoviális) membránra jutnak az aktiválás alatt álló Th sejtek, amihez a posztkapilláris venulákban a Th sejtek és az endothel sejtek közötti elektív adhézió és a kemokinek hatására az érlumenből történő sejtkilépés szükséges.
A legfontosabb történések helyszínén a szinoviális membránon a T helper sejtek aktiválódása kétirányban folytatódik. A celluláris (Th1) vonalon a makrofágok/monociták jelentős mennyiségű proinflammatorikus citokint (a gyulladást elősegítő kisméretű fehérjemolekulát), közülük is elsősorban a tumor nekrózis faktor (TNF) a-t termelnek. A humorális (Th2) vonalon a gyulladást gátló antiinflammatorikus citokinek (például: interleukin 4, 10,13) közreműködésével a B-limfociták, majd a plazmasejtek aktiválódnak és a reumatoid artritiszre jellemző ellenanyagokat (például: reumatoid faktor, anti-filaggrin) termelnek. Jelen ismereteink szerint a reumatoid artritisz egyértelműen Th1 túlsúlyú, TNF dominanciájú kórkép (3. ábra).
A TNF -nak és az általa beindított citokin kaszkádnak a különböző effektor molekulák (például: prosztanoidok, kemokinek, adhéziós molekulák stb.) révén nemcsak az akut ízületi gyulladásban van kulcsszerepe, hanem a krónikus ízületi destrukcióban is. Itt az alapfolyamat a krónikus szinoviális sejtburjánzás (proliferáció), mely az ún. pannuszképződést eredményezi, ami rákúszva az ízületeket alkotó porcfelszínre és csontvégekre azok károsodását, adott esetben pusztulását hozza létre. A csontfelszívódás (reszorpció) létrejöttében a nagy mennyiségű proinflammatorikus citokin mellett a TNF szupercsaládba tartozó RANKL-nak (receptor activator of nuclear factor -B ligand) van újonnan felfedezett meghatározó szerepe. Az RA-hoz társuló porckárosodásban a termelt citokinek a porcsejtek katabolizmusát fokozzák; a metalloproteináz enzimek elsősorban a porcmátrix degradációját idézik elő.
A reumatoid artritisz etiopatogenezisének megismerésén túl, a betegség elleni hatékony fellépés kulcskérdése a korai fázisban történő diagnosztika és prognosztika.
Korai diagnosztika és prognosztika
A betegség korai diagnózisának alapját ma is a klinikai tünetek adják, melyek közül a szimmetrikus kéz kisízületi és csuklótáji duzzanatot, valamint a reggeli kézmerevséget kell kiemelni (Harris, 2005). Gyanúnkat a betegek magasabb vörösvértest-süllyedése és CRP (C-reaktív protein) értéke, valamint a radiológiai vizsgálattal talált jellegzetes eltérések (ízületközeli csontvesztés és kimaródások) erősíthetik meg.
A reumatoid artritisz kórisméjének kimondásához szinte nélkülözhetetlenek a specifikus immunszerológiai markerek, melyek megjelenése a patomechanizmus kapcsán vázolt folyamat következménye. Azokat a megbízható metodikával talált ellenanyagokat tekintjük optimálisnak, amelyek szenzitivitása és specificitása magas, a vérből nagyon korán, sokszor a betegség egyértelmű klinikai tüneteinek megjelenése előtt kimutathatóak, és képesek a kórkép súlyosságát, kimenetelét prognosztizálni (Scott, 2002). Korábban a magas titerben jelenlévő reumatoid faktor, míg ma az anti-citrullinált peptideket tekintjük a betegség legjobb laboratóriumi indikátorainak (van Venrooij et al., 2004). Az anti-citrullinált peptidek vagy más néven anti-filaggrinok humán autoantitest családjának (2. táblázat) utóbbi években történt felfedezése nemcsak diagnosztikai és prognosztikai lehetőségeinket bővítette, hanem a betegség patomechanizmusáról alkotott elképzeléseinkre is hatással volt. A citrullináció a humán szervezetben fiziológiásan végbemenő folyamat, mikor is sejthalál esetén a megnövekedett intracelluláris kalciumkoncentráció hatására aktiválódik a PAD (peptidyl arginin deimináz) enzim, és fehérjéket citrullinál. Az immunológia tudománya által egyelőre meg nem válaszolt kérdés csak az, hogy egyes szervezetekben miért képződnek a citrullinált proteinek (autoantigének) ellen ellenanyagok, míg másokban nem, valamint az, hogy ezek az autoantitestek milyen szerepet töltenek be a reumatoid artritisz kórfolyamatában. Saját munkacsoportunk vizsgálatában az RA-ban szenvedő betegek anti-filaggrin pozitivitása és a HLA DRB1 antigén shared epitopjainak hordozása között szignifikáns összefüggést találtunk, ami azt jelzi, hogy az antigén-prezentálásnak kiemelkedő jelentősége lehet az anti-filaggrin képződésben (Schmidt et al., 2006).
Az RA korai diagnosztikájában az anti-citrullinált peptidek népes családjából elsősorban az anti-ciklikus citrullinált peptidet, valamint újabban az anti-vimentint tartjuk a legértékesebbnek. Az anti-filaggrin pozitivitást a HLA DRB1 shared epitópok meglétével, a magas gyulladásos aktivitással, a kiterjedt klinikai tünetekkel és a röntgenen észlelt korai elváltozásokkal együtt a betegség súlyosságát előrejelző prognosztikai faktorként is felhasználjuk (Rojkovich et al., 2000).
Természetesen a korai diagnosztika és prognosztika azért lett kiemelkedő fontosságú a betegséggel kapcsolatban, mert ma már rendelkezünk azokkal a hatékony terápiás készítményekkel, melyek időben elkezdve a betegség progresszióját megállíthatják, és a beteg szenvedéseit érdemben befolyásolhatják.
Erélyes és célzott gyógyszeres terápia
A reumatoid artritisz kezelésében a gyógyszeres és a nem-gyógyszeres eljárásokat együtt alkalmazzuk. A nem-gyógyszeres lehetőségek közül a krónikus, hullámzó kórképben kiemelendő a betegségre és az életmódbeli tényezőkre vonatkozó betegfelvilágosítás és a betegek pszichés vezetésének a jelentősége, melyekkel a beteget partnerré tudjuk tenni a gyógyítás folyamatában. Ezek mellett gyógytorna és egyéb fizioterápiás kezeléseket, segédeszközöket alkalmazunk, illetve a beteg állapotától függően ortopédiai beavatkozásokra kerülhet sor. A gyógyszeres kezelésben a tüneti szerként használt nem-szteroid és szteroid gyulladásgátlók, valamint az ún. betegségmódosító, „bázisterápiás” készítmények egyaránt fontos szerephez jutnak (4. ábra).
Tekintettel arra, hogy a betegség progresszióját a kezdettől számított első hat-tizenkét hónapban tudjuk a legjobban befolyásolni, ezért a korai erélyes bázisterápia jelenti a betegek számára a legnagyobb esélyt (Smolen – Steiner, 2003). Ez különösen igaz rossz prognózisú betegség fennállásakor. A betegségmódosító készítmények közül elsőként mindig a konvencionális szereket alkalmazzuk, elsősorban a Th limfociták és a makrofágok citokintermelését csökkentő methotrexátot és leflunomidot. Ezen készítmények hatástalansága esetén nyúlunk az ún. biológiai szerekhez, melyek a betegség kialakulásában szerepet játszó egy-egy folyamatba célzottan avatkoznak be (O’Dell, 2001).
Ma a legfontosabb biológiai terápiás vonalat a celluláris (Th1) immunválaszban kulcsszerepet játszó TNF blokkolása, valamint a humorális immunválaszban meghatározó B-sejtek (CD20+) gátlása jelenti. Az anti-TNF terápia részben monoklonális ellenanyagok (infliximab, adalimumab), részben szolubilis TNF receptor (etanercept) révén kivitelezhető (Nash – Florin, 2005). Világszerte több mint egymillió beteget kezeltek már ezen biológiai terápiás szerekkel, és a korábban alkalmazott készítményekhez képest RA-ban is jóval nagyobb hatékonyság és progressziógátlás volt általuk elérhető (Feldmann et al., 2005). A potenciális mellékhatások közül a fokozott infekcióveszélyre, így a lappangó TBC fellángolására kell elsősorban odafigyelni (Hochberg et al., 2005). A TNF blokkoló készítmények ma már a hazai betegek számára is hozzáférhetővé váltak.
A célzott biológiai beavatkozások a reumatoid artritisz patogenetikai történéseinek más lépéseire is kiterjednek. Így biztató, illetve eredményes próbálkozások történtek az antigén-prezentálás és felismerés, a kostimuláció és a limfocita-adhézió és migráció gátlása, valamint a késői destrukcióban fontos metalloproteináz enzimek és RANKL blokkolása területén (Sacre et al., 2005). A jelenleg még kísérletes eljárások közé sorolható génterápia és őssejtterápia az RA-ban szenvedő betegek számára is újabb perspektívákat nyithat meg.
Összefoglalásképpen elmondható, hogy a reumatoid artritisz mint az egyik legfontosabb mozgásszervi kórkép diagnosztikájának és kezelésének leírt gyakorlata hűen tükrözi azt a hatalmas fejlődést, melyet a reumatológia az elméleti alapok megismerése és azok mielőbbi hasznosítása terén az utóbbi években megtett. Ez az út a molekuláris genetikától az immunológián és az osteológián át a biológiai terápia rutinszerű alkalmazásáig és még tovább vezet.
Kulcsszavak: reumatoid artritisz, patogenezis, korai diagnosztika, erélyes és célzott terápia


1. ábra • A reumatoid artritiszben szenvedő Pierre-Auguste Renoir fényképe és önarcképe
A Iniciális szakasz (etiológia)
• Genetikai fogékonyság
• Exogén vagy endogén antigének
(pl. infektív ágensek)
B Centrális gyulladásos szakasz
• Antigén-prezentálás és felismerés
• Limfocita-adhézió és migráció
• A celluláris és humorális
immunválasz aktiválódása
C Késői destruktív szakasz
• Krónikus szinovális proliferáció,
porc- és csontkárosodás
1. táblázat • A reumatoid artritisz patogenezisének három szakasza
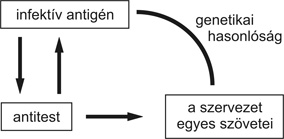
2. ábra • Az infektív antigének patogenetikai szerepének feltételezett mechanizmusa reumatoid artritiszben (molekuláris mimikri)
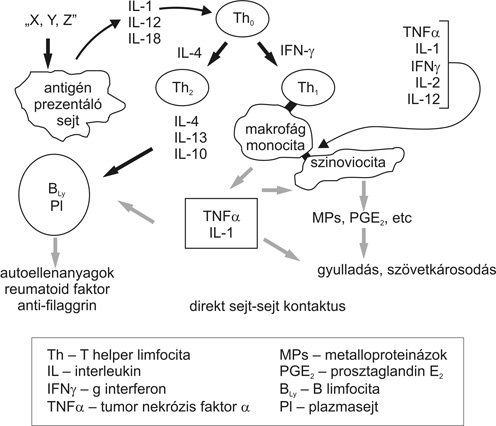
3. ábra • A centrális gyulladásos szakasz történései reumatoid artritiszben a szinoviális membránon. Az aktivált Th sejtek szerepe a celluláris (Th1 ) és humorális (Th2 ) immunválasz elindításában
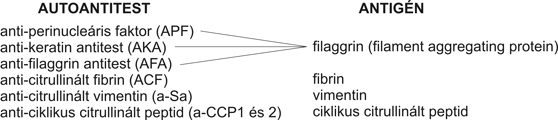
AUTOANTITEST ANTIGÉN
anti-perinucleáris faktor (APF)
anti-keratin antitest (AKA) filaggrin (filament aggregating protein)
anti-filaggrin antitest (AFA)
anti-citrullinált fibrin (ACF) fibrin
anti-citrullinált vimentin (a-Sa) vimentin
anti-ciklikus citrullinált peptid (a-CCP1 és 2) ciklikus citrullinált peptid
2. táblázat • Az anti-citrullinált peptidek (anti-filaggrinok) és autoantigénjeik humán családja
4. ábra
Irodalom
Csepregi Antal – Rojkovich B. – Héjjas M. – Horányi M. – Nemesánszky E. – Poór Gy. (2000): Chronic Seropositive Polyarthritis Associated with Hepatitis B Virus-Induced Chronic Liver Disease. A Sequel of Virus Persistance. Arthritis and Rheumatism. 43, 232–233.
Csepregi Antal – Poór Gy. – Nemesánszky E. (2004): Hepatitis C Virus and Rheumatoid Arthritis: Further Pieces to the Puzzle. Journal of Rheumatology. 30, 1016–1017.
Feldmann, Marc – Brennan, F. M. – Foxwell, B. M. et al (2005): Anti-TNF Therapy: Where Have We Got to in 2005? Journal of Autoimmunity. 25, Supplement: 26–28.
Harris, Edward D. Jr. (2005): Clinical Features of Rheumatoid Arthritis. In: Harris, Edward D. Jr. – Budd, R. C. – Genovese, M. C. – Sergent, J. S. – Ruddy, S. – Sledge, C. B. (eds.): Kelley’s Textbook of Rheumatology. 7th Edition. Elsevier, Philadelphia, 1043–1078.
Hochberg, Marc C. – Lebwohl, M. G. – Plevy, S. E. et al. (2005): The Benefit/Risk Profile of TNF-Blocking Agents: Findings of a Consensus Panel. Seminars in Arthritis and Rheumatism. 34, 819–836.
Sacre, Sandra M. – Andreakos, E. – Taylor, P. et al. (2005): Molecular Therapeutic Targets in Rheumatoid Arthritis. Expert Reviews in Molecular Medicine. 7, 1–20.
Nash, Peter T. – Florin, Timothy H. (2005): Tumour Necrosis Factor Inhibitors. Medical Journal of Australia. 183, 205–208.
O’Dell, James R. (2001): How Is It Best to Treat Early Rheumatoid Arthritis Patients? Best Practice & Research in Clinical Rheumatology. 1,125–37.
O’Dell, James R. (2004): Rheumatoid Arthritis. In: Goldman, Lee – Ausiello, Dennis (eds.): Cecil Textbook of Medicine. 22nd Edition. WB Saunders, Philadelphia, 1644–1653.
Schmidt Zsuzsa – Blazsek A. – Brózik M. – Gergely P. Jr. – Hittner Gy. – Merétey K. – Poór Gy. (2006): Lack of Anti-Cyclic Citrullinated Peptide-Antibody and HLA DRB1*0401 Might Partly Explain the Benign Synovitis in Polymyalgia Rheumatica and Rheumatoid Arthritis. Annals of the Rheumatic Diseases. 65, 71. (abstract):
Scott, David L. (2002): The Diagnosis and Prognosis of Early Arthritis. Arthritis and Rheumatism. 46, 286-90
Smith, J. Bruce – Haynes, Mark K. (2002): Rheumatoid Arthritis: A Molecular Understanding. Annals of Internal Medicine. 136, 908–922.
Smolen, Josef S. – Steiner, G. (2003): Therapeutic Strategies for Rheumatoid Arthritis. Nature Reviews. Drug Discovery. 2, 483–488.
Rojkovich Bernadette – Paksy A. – Poór Gy. (2000): A korai rheumatoid arthritis aktivitását és kimenetelét jelző prognosztikai tényezők vizsgálata. Magyar Reumatológia. 41, 85–92.
van Venrooij, Walther J. – Vossenaar, E. R. – Zendman, A. J. (2004): Anti-CCP Antibodies: The New Rheumatoid Factor in the Serology of Rheumatoid Arthritis. Autoimmunity Reviews. Supplement. 1, S17–92004.
<-- Vissza a 2006/10 szám tartalomjegyzékére
<-- Vissza a Magyar Tudomány honlapra
[Információk] [Tartalom] [Akaprint Kft.]