Mozgásszervi megbetegedéseket utánzó neuropátiás fájdalmak patomechanizmusa és terápiája
Tajti János
egyetemi docens, Szegedi Tudományegyetem Neurológiai Klinika Szeged
MTA–SZTE Neurológiai Kutatócsoport – tajti @ nepsy.szote.u-szeged.hu
Vécsei László
az MTA levelező tagja, tanszékvezető egyetemi tanár
Szegedi Tudományegyetem Neurológiai Klinika Szeged
MTA–SZTE Neurológiai Kutatócsoport – vecsei @ nepsy.szote.u-szeged.hu
A mozgásszervi megbetegedések differenciál-diagnosztikájában gyakran komoly nehézséget jelent egyes neuropátiás kórképek korai felismerése. Különösen sok gondot okoz a végtagokban jelentkező fájdalmakkal járó kórképek esetében a diabétesz okozta fájdalmas neuropátia. A szegmentális elhelyezkedés miatt a kezdeti herpes zoster infekció, illetve annak késői utóhatásaként a poszt-zoszteres neuralgia megnehezítheti az egyes betegségek elkülönítését. Gondot jelenthet továbbá a betegségek differenciálásában a fej-nyak tájékon jelentkező atípusos fájdalmakkal induló, majd ebből kialakuló occipitális vagy trigeminális neuralgia. Az alábbiakban áttekintjük a fájdalmak elkülönítését patomechanizmusuk alapján, valamint a tényeken alapuló orvoslás szabályait, figyelembe véve az említett kórképekben a fájdalomcsillapítás korszerű lehetőségeit.
A fájdalom típusai és jellemzői
Nociceptív fájdalom
A Nemzetközi Fájdalom Társaság (IASP) meghatározása szerint a nociceptív fájdalom olyan pszichofiziológiai jelenség, melynek neurobiológiai alapja a nociceptio, a szövetkárosító ingerek (noxák) percepciója. A noxákat a bőrben, az izmokban, a fasciákban, az ízületekben, a csonthártyákban, a különböző zsigerek hámjában és falában elhelyezkedő nociceptorok érzékelik. A magas ingerküszöbű nociceptorok a vékony velős hüvelyű (Ad) és velőtlen (C) rostok perifériás termináljai. A nociceptív fájdalom sérülést, gyulladást követően jelentkezik, s élettani szempontból hasznos, az életet védő szerepet ellátó fiziológiás jelenség. Figyelmeztet a kialakult vagy fenyegető szövetkárosodásra, s annak elhárítását célzó magatartást és reflexeket vált ki. A nociceptorok élesen elkülönülnek az alacsony ingerküszöbű elsődleges érző neuronoktól, melyek mechanikus (vibráció, nyomás) vagy termikus (hideg, meleg) ingerekre aktiválódnak. Az alacsony ingerküszöbű, vastag mielin hüvellyel rendelkező axonok (Ab) gyors információáramlást tesznek lehetővé a perifériáról a központi idegrendszerbe, de nem kapcsolódnak a fiziológiás fájdalom kialakításához. Az Ab rostok aktivációja normál körülmények között csak a nem fájdalmas érzéskvalitások létrehozását eredményezi (Woolf, 1997).
Neuropátiás fájdalom
A neuropátiás fájdalom alatt értjük azon fájdalomformát, melynek oka az idegrendszer sérülése vagy működéscsökkenése. Ezen definíció szerint a károsodás bekövetkezhet a szomato-szenzoros pályarendszerben a C- és az Ad rostok területén (perifériás idegrendszer), illetve a spino-thalamo-kortikális rendszer bármely szintjében (központi idegrendszer). A neuropátiás fájdalomnak védő szerepe nincs, így krónikus szenvedéshez vezethet (Cruccu et al., 2004). A neuropátiás fájdalom prevalencianagysága pontosan nem ismert, becsült adatok alapján az átlagos populáció 1-1,5 %-a érintett (Bowsher, 1991; Carter – Galer, 2001). Amíg a fájdalom akutan jelentkezve a szervezet legfontosabb védekező mechanizmusa, a krónikus fájdalom mögött tartós egészségkárosodás keresendő. A három hónapnál hosszabb ideje tartó, folyamatosan fennálló fájdalmat nevezzük krónikusnak. A neuropátiás fájdalomban szenvedő betegeknek nagymértékben romlik az életminőségük (Meyer-Rosberg et al., 2001). A krónikus fájdalomtól szenvedő páciens sajátosságai: folyamatos panasz a fájdalomra; különböző testtartások felvétele, mely a beteg tapasztalatai szerint a fájdalmat csökkentik; a panaszok gyakrabban kifejezettebbek, mint a mögöttük észlelt elváltozások; megváltozott életforma, fokozott ingerlékenység, alvászavar, étvágytalanság, szorongás és depresszió. A neuropátiás fájdalom jelentkezhet spontán vagy kialakulhat inger hatására. A spontán jelentkező fájdalmat a betegek „égő”/„lüktető”/„hasogató”/ „áramütésszerű” szavakkal jellemzik. Paresztéziának tartjuk a nem fájdalmas fonákérzést (például hangyamászásszerű), a dizesztézia a fájdalmas fonákérzést fedi (például égő-parázsló). A stimulus kiváltotta fájdalom mechanikus, termikus vagy kémiai ingerek hatására keletkezik. Az allodinia esetében fájdalmat egyébként nem okozó inger hatására kellemetlen fájdalom alakul ki. A hiperalgézia fokozott fájdalomérzést jelent, enyhe fájdalmas stimulus esetén. A neuropátiás fájdalom tüneteit az idegi sérülés következtében kialakuló kóros idegrendszeri aktivitásfokozódással magyarázhatjuk. A neuropátiás fájdalom diagnózisának felállítása során fontos jel a károsodásnak megfelelő területen kialakuló érzészavar, valamint az anamnézisben szereplő idegkárosodáshoz vezető alapbetegség, mint például a diabétesz mellitus vagy herpes zoster.
Klinikum
Herpes zoster (övsömör, HZ)
Varicellainfekciót követően a vírus inaktív állapotban visszamarad a spinalis hátsógyöki érző ganglionokban (DRG) és a ggl. trigemináléban (Gasser-dúc). Bókay János már 1928-ban pusztán epidemiológiai alapon feltételezte a HZ és a varicella közös etiológiáját. A későbbi korok modern vizsgálati módszerei sejtését igazolták. Ismeretlen és ismert (immunszuppresszió, paraneoplaziás szindróma, tumormetasztázis a gerincoszlop csigolyáiban) aktiváló tényezők hatására a vírus az axontranszport segítségével eljut az ideg ellátási területének megfelelő dermatómába. A bőrben „erythema, vesicula, crusat stádiumokon” át jellegzetes elváltozást okoz. A bőrjelenségek előtt már akár egy héttel erőteljes fájdalmak jelentkezhetnek, melyek a lokalizációnak megfelelően utánozhatnak degeneratív gerincoszlopi vagy végtagízületi megbetegedéseket. A bőrtünetek lezajlását követően egy hónappal még mindig meglévő fájdalmakat nevezzük poszt-zoszteres (PZN) vagy poszt-herpeszes neuropátiás (PHN) fájdalomnak.
Diabétesz okozta fájdalmas polineuropátia (PDN)
PDN esetében a felső végtagokon „kesztyű”-, az alsó végtagokon „zokniszerű” lokalizációban jelentkeznek a fájdalmak és az érzészavarok (tactilis, algeticus, vibratios) disztál felé fokozódó jelleggel. A kórkép hátterében – a perifériás idegben – metabolikus funkciózavar okozta mielin- és/vagy axonkárosodás van. A betegség, főleg kezdetekor végtag kisízületi megbetegedéseket mimikálhat.
Trigeminusz neuralgia (arcidegzsába, TN)
A trigeminusz ideg területén, rendszerint féloldalon jelentkező, igen heves, villámcsapás-szerű, rövid ideig tartó fájdalmakból álló roham, melyet a fájdalmas arc eltorzulása kísérhet (tic douloureux). Pontos etiológiája nem ismert, de feltételeznek vírusfertőzést, vaszkuláris kompressziót vagy demielinizációt a n. trigeminusz agytörzsi belépési régiójában. Gyakran atípusos módon kezdődik (a nyak, a vállak mozgása, a rágás provokálja a prozopalgiát), differenciál-diagnosztikus nehézséget jelentve, mivel sokszor csak évek múlva alakulnak ki az említett jellegzetes tünetek.
Terápiás elvek a neuropátiás fájdalmakban
A neuropátiás fájdalom igen gyakori betegség (a traumás idegsérülést követően a páciensek 5 %-ában, a szklerózis multiplexben szenvedő betegek 28 %-ában, syringomielia esetén 75 %-ban, gerincvelősérülést követően 70 %-ban, stroke után 8 %-ban, és diabéteszes neuropátiától szenvedő betegek 20-30 %-ában alakul ki neuropátiás fájdalom). A szokványos analgetikumokra ezen fájdalomforma alig reagál. Ez a tény a már meglévő farmakonok (antidepresszánsok, antiepileptikumok) új indikációs területen való alkalmazásához vezetett. A Neurológiai Társaságok Európai Szövetségének ajánlása alapján a neuropátiás fájdalomban az antiepileptikumok, antidepresszánsok és opiátok alkalmazása megkísérelhető a tényeken alapuló orvoslás szempontjait figyelembe véve (Cruccu et al., 2004).
Az Amerikai Neurológiai Akadémia (American Academy of Neurology) beosztása a bizonyítékok három szintjét határozta meg, melyekre javaslatokat fogalmazott meg.
Bizonyítékok
I. osztályú bizonyíték: egy vagy több jól tervezett, randomizált kontrollált klinikai vizsgálat, illetve az ilyen tanulmányok szisztematikus áttekintésén (metaanalízis) alapuló bizonyíték.
II. osztályú bizonyíték: jól tervezett, megfigyelésen alapuló tanulmányok, melyekben egyidejűleg kontrollcsoport is szerepel (esetkontroll, kohort vizsgálatok).
III. osztályú bizonyíték: szakértői véleményeken, esetsorozatokon, esetismertetéseken, és nem egyidejű, hanem korábbi kontrollcsoporthoz hasonló vizsgálatokon alapuló bizonyíték.
Javaslatok
1. Kötelező: a betegellátás olyan alapvetően elfogadott eleme, mely mögött nagyfokú klinikai bizonyosság áll (I. osztályú vagy II. osztályú bizonyíték áll rendelkezésre olyan esetekben, ahol randomizált vizsgálat nem végezhető).
2. Ajánlott: a betegek kezelésére vonatkozó olyan javaslat, mely közepesen erős klinikai bizonyosságot feltételez (II. osztályú vagy III. osztályú bizonyítékon alapuló erős konszenzus).
3. Végezhető: olyan terápiás stratégia, melynek klinikai hasznossága bizonytalan, nem következetes vagy egymásnak ellentmondó bizonyítékok vannak. (Doody et al., 2001)
A fenti szempontrendszereket figyelembe véve, valamint áttekintve az elektronikus adatbázisokat (Medline, Web of Science, Cochrane Library) az alább felsorolandó kezelési lehetőségekre van mód (Beniczky et al., 2005; Finnerup et al., 2005). Összehasonlítási értéknek azt a számot tekintjük, amely megadja, hogy hány beteget kell kezelni ahhoz, hogy az elsőben 50 %-os fájdalomcsökkenést érjünk el (number needed to treat – NNT) (Altman, 1995; Cook – Sackett, 1995).
Antidepresszánsok
1. Triciklikus antidepresszánsok (TCAs)
A TCA vegyületek gátolják a biogén-aminok visszavételét, és erőteljesen befolyásolják a nátrium ioncsatornák működését. Ennek megfelelően erősítik a gerincvelői hátsó szarvi gátló folyamatokat, és csökkentik a perifériás szenzitizációt. A TCA hatóanyagú gyógyszerek kontrollált tanulmányok alapján hatékonyak voltak PHN-ben, PDN-ben, poszt-masztektómiás és poszt-stroke (centrális) fájdalmakban. Negatív eredményt adtak gerincvelősérülést követő, humán imundeficiencia vírus (HIV) okozta és a végtagok amputációja után kialakuló fantom fájdalom esetében. Fájdalommal járó polineuropátiákban a szerotonin és a noradrenalin újrafelvételét egyformán gátló TCA farmakonok jobb eredményt adtak (NNT: 2,1), mint a főként csak noradrenerg komponensűek (NNT: 2,5). PZN-ben hasonló folyamat volt megfigyelhető (egyformán gátló TCA, NNT: 2,5; noradrenerg TCA, NNT: 3,1) (Beniczky et al., 2005; Finnerup et al., 2005).
2. Szelektív szerotoninújrafelvétel-gátlók (SSRIs)
Az SSRIs és a kevert szerotonin- és noradrenalin-visszavételt blokkolók (SNRIs) nem váltották be a hozzájuk fűzött reményt (SSRIs, NNT: 7,0; SNRIs, NNT: 4,0) (Finnerup et al., 2005).
Antiepileptikumok
1. Gabapentin
A gabapentin a centrális szenzitizáció mérséklése útján csökkenti a neuropátiás fájdalmat. A feszültségfüggő kálcium ioncsatorna (VGCCs) a2d alegységéhez kapcsolódik a gerincvelői Rexed-féle I-es és II-es laminában, a nociceptorok centrális végződéseiben (Beydoun – Backonja, 2003). PDN-ben, két nagy tanulmány alapján hatékonynak tűnik (Beniczky et al., 2005). A különböző perifériás neuropátiás típusokat összegezve nagy dózis esetén az NNT: 3,8 (Finnerup et al., 2005).
Egy kisebb cross-over vizsgálat során PDN-ben a gabapentint a TCA-hoz tartozó amitriptylinnel hasonlították össze. Nem találtak statisztikailag szignifikáns különbséget a fájdalom intenzitásának csökkenését alapul véve a két gyógyszer között (Morello et al., 1999).
2. Pregabalin
A pregabalin a központi idegrendszerben a hyperexcitabilis neuronok VGCCs a2d alegységéhez kapcsolódik, és így gátolja a kálciumbeáramlást. Ennek következtében csökken a neurotranszmitterek – a glutamát, a noradrenalin és a P-anyag – felszabadulása. Így a kóros idegrendszeri aktivitásfokozódás normalizálásán keresztül csökkenti a perifériás neuropátiás fájdalmat. PHN-ben két nagy vizsgálat szerint, valamint PDN-ben hatásosnak bizonyult (NNT: 4,2) Mellékhatásprofilja kedvező, az esetenként kialakuló álmosság, szédülés, gyengeség csak kisfokú és átmeneti jellegű. Könnyen és biztonsággal adagolható farmakon (Sabido-David et al., 2004).
3. Carbamazepin
A carbamazepinek a depolarizációt követően, a feszültségfüggő nátrium ioncsatornák inaktiválásával csökkentik a neuronok magas frekvenciájú repetitív tüzelését. Mérséklik továbbá az excitátoros neurotranszmitterek felszabadulását, és növelik a szerotonin kiáramlását. TN-ben hatékony (NNT: 1,8) és az újonnan diagnosztizált páciensek 70-90 %-ában gyors kedvező választ eredményez, de egyéves utánkövetést tekintve a páciensek 40 %-a a mellékhatások miatt felfüggeszti az alkalmazását. A kedvezőbb mellékhatás profilú oxcarbamazepinnel jelenleg is folynak a nemzetközi vizsgálatok (Beniczky et al.. 2005; Finnerup et al,, 2005).
Opiátok
Az opiátok a leszálló – elsősorban a periakveduktális szürkeállományból (PAG) a gerincvelő hátsó szarvához haladó – gátló pályák működését befolyásolják. Egyre több az adat a szájon át adott opioidok kedvező hatásáról neuropátiás fájdalomban.
1. Morfin szulfát
A morfin szulfátot hatékonynak véleményezték PHN-ben, PDN-ben és fantomfájdalomban (NNT: 2,5) (Finnerup et al., 2005).
2. Oxycodon
Az oxycodon tisztán m receptor agonista, PHN-ben, PDN-ben kiváló eredményt mutatott, hatása vetekszik a morfinéval (NNT: 2,6) (Finnerup et al., 2005).
3. Tramadol
A tramadol centrálisan fellépő analgetikum, mely közvetlenül az opiát és közvetetten a monoaminerg rendszerre hat. Vizsgálatok szerint PHN-ben és PDN-ben kedvező tulajdonságú vegyület (NNT: 3,9) (Boureau et al., 2003).
Lidokain
A lidokain fájdalomcsillapító hatása a periférián a nátrium ioncsatornák gátlásán nyugszik.
Felszíni kezelési formában (tapasz) a lidokain szükségszerűen alkalmazható terápiás forma PHN-ben (Galer et al., 2002).
Perifériás neuropátiás fájdalomban szenvedő betegek kezelési stratégiájának meghatározásakor a következő szempontokat kell figyelembe vennünk:
1. Kiemelkedő minőségű randomizált kontrollált vizsgálatok metaanalízisének eredményeiből kell hogy kiinduljunk.
2. Sokkal erőteljesebb legyen az új farmakon fájdalomcsillapító hatása, mint a korábban alkalmazott gyógyszeré volt.
3. A fájdalomcsillapító hatás folyamatos legyen.
4. Kevés és enyhe legyen a mellékhatás.
5. A terápia javítsa a beteg életminőségét.
6. Az alkalmazott gyógyszer ára alacsony legyen.
A perifériás neuropátiás fájdalom kezelési algoritmusát az 1. ábra mutatja be.
Perifériás neuropátiában a fájdalomcsökkentés hatékonyságát és az életminőség megőrzését alapul véve a farmakonok jelenlegi alkalmazási sorrendje a következő: pregabalin/gabapentin>tramadol>opiátok> triciklikus antidepresszánsok (Finnerup et al., 2005).
Kulcsszavak: nociceptio, neuropátia, opiátok, antiepileptikumok, antidepresszánsok
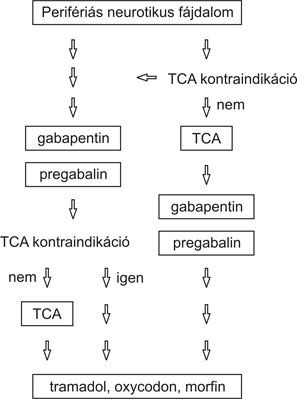
1.ábra • A perifériás neuropátiás fájdalom kezelési algoritmusa – Perifériás neuropátiás fájdalom kezelésekor az elsődlegesen alkalmazható szer a gabapentin/pregabalin vagy a triciklikus antidepresszánsok (TCA). Esetleges TCA kontraindikáció vagy hatástalanság esetén gabapentin/pregabalin választható. TCA kontraindikáció vagy TCA és gabapentin/pregabalin hatástalanság esetén tramadol, oxycodon, morfin a terápia sorrendje. Lidokain tapasz kiegészítő kezelési módként alkalmazható poszt-herpeszes neuropátiában (Finnerup et al., 2005).

Irodalom
Altman, Douglas G. (1995): Practical Statistics for Medical Research. Chapman and Hall, London.
Beniczky Sándor – Tajti J. – Varga E. T. – Vécsei L. (2005): Evidence-Based Pharmacological Treatment of Neuropathic Pain Syndromes. Journal of Neural Transmission. 112, 735–749.
Beydoun, Ahmad – Backonja, Miroslav M. (2003): Mechanistic Stratification of Antineuralgic Agents. Journal of Pain and Symptom Management. 25, S18–S30.
Boureau, François – Legallicier, P. – Kabir-Ahmadi, M. (2003): Tramadol in Post-Herpetic Neuralgia: A Randomized, Double-Blind, Placebo-Controlled Trial. Pain. 104, 323–331.
Bowsher, David (1991): Neurogenic Pain Syndromes and Their Management. British Medical Bulletin. 47, 644–666.
Carter, Gregory T. – Galer, Brad S. (2001): Advences in the Management of Neuropathic Pain. Physical Medicine and Rehabilitation Clinics of North America. 12, 447–459.
Cook, Richard J. – Sackett, David L. (1995): The Number Needed to Treat: A Clinically Useful Measure of Treatment Effect. British Medical Journal. 310, 452–454.
Cruccu,
Giorgio – Anand, P. – Attal, N. –
Garcia-Larrea, L. – Haanpää, M. – Jřrum, E. – Serra,
J. – Tensen, T. S. (2004): EFNS Guidelines on Neuropathic Pain
Assessment. European Journal of Neurology. 11, 153–162.
http://www.efns.org/files/guideline_20.pdf#search=%22Cruccu%2C%20Giorgio
%20%E2%80%93%20Anand%22
Doody, Rachelle. S. – Stevens, J. C. – Beck, C. – Dubinsky, R. M. – Kaye, J. A. – Gwyther, L. – Mohs, R. C. – Thal, L. J. – Whitehouse, P. J. – Dekosky, S. T. – Cummings, J. L. (2001): Practice Parameter: Management of Dementia (An Evidence-Based Review). Report of the Quality Standards Subcommittee of The American Academy of Neurology. Neurology. 56, 1154–1166.
Finnerup, Nanna B. – Otto M. – McQuay, H.J. – Jensen T. S. – Sindrup S. H. (2005): Algorithm for Neuropathic Pain Treatment: An Evidence Based Proposal. Pain. 118, 289–305.
Galer, Brad S. – Jensen, M. P. – Ma, T. – Davies, P. S. – Rowbotham, M. C. (2002): The Lidocaine Patch 5% Effectively Treats Efficacy Study with Use of the Neuropathic Pain Scale. The Clinical Journal of Pain. 18, 297–301.
Meyer-Rosberg, Karin – Burckhardt, C. S. – Huizar, K. – Kvarnström, A. – Nordfors, L.-O. – Kristofferson, A. (2001): A Comparison of the SF-36 and Nottingham Health Profile in Patients with Chronic Neuropathic Pain. European Journal of Pain. 5, 391–403.
Morello, Candis M. – Leckband, D. G. – Stoner, C. P. – Moorhouse, D. F. – Sahagian, G. A. (1999): Randomized Double-Blind Study Comparing the Efficacy of Gabapentin with Amitriptyline on Diabetic Peripheral Neuropathy. Archives of Internal Medicine. 159, 1931–1937.
Sabido-David, Cibele – Faravelli, L. – Salvati, P. (2004): The Therapeutic Potential of Na+ and Ca2+ Channel Blockers in Pain Management. Expert Opinion on Investigational Drugs. 13,1249–1261.
Woolf, Clifford J. (1997): Messenger Molecules Involved in Central Sensitization. In: Olesen, Jes – Edvinsson, Lars (eds.): Headache. Pathogenesis, Monoamines, Neuropeptides, Purines, and Nitric Oxide. Lippincott–Raven Publishers, Philadelphia, 89–98.
<-- Vissza a 2006/10 szám tartalomjegyzékére
<-- Vissza a Magyar Tudomány honlapra
[Információk] [Tartalom] [Akaprint Kft.]