|
1. Hélixek esetében a peptidkötések két oldalán
csak azonos előjelű ψ és φ torziók fordulhatnak elő: +][+ vagy -][-,
ahol a ’][’ szimbólum a CONH peptidkötést jelenti. A szál-típusú
szerkezeteknél eltérő előjelű szögek vannak: +][- vagy -][+.
2. Hélixeknél a torziós szögek előjelei
meghatározzák a peptidkötés orientációját a gerinc standard
irányítottságához (N-vég → C-vég) képest. Az irány függ attól is, hogy
a hélix jobb- (P) vagy balmenetes (M).
3. Mivel a peptidláncok önrendeződésének feltétele
az amidcsoportok közötti (intra)molekuláris felismerés, a
kölcsönhatásban lévő szakaszoknál a peptidkötések orientációjának
illeszkedőnek kell lennie. Ez megköveteli a gerinctorziók megfelelő
mintázatát, amit azonban csak megfelelő sztereokémiai mintázat hozhat
létre. Összegezve kimondhatjuk, hogy a hélixek és redőzött rétegek
kialakulásához valóban nem szükséges a homokiralitás. A szükséges
feltétel az ismétlődő térkémiai mintázat jelenléte.
4. A proteinek és α-peptidek körében jól ismert a
Rachandran-féle összefüggés. Ennek folyománya, hogy a balkezes
szénatom kizárólag negatív előjelű (-]) φ torziót tesz lehetővé a
stabilis másodlagos szerkezeteknél. A ψ szögre a sztereokémia kisebb
strukturáló hatással van, mivel az felvehet pozitív ([+) és negatív
([-) szögeket is. Ez utóbbi valójában az
α-aminosavak fent említett speciális voltából fakad. β-peptidek
esetében mindkét királis szénatom erősen strukturál, és hatásuk
elkülönítetten jelentkezik: balkezes konfiguráció esetén csak negatív
előjelű torziós szögeket tesznek lehetővé mind a ψ, mind a φ
torzióknál. A jobbkezes konfiguráció pozitív torziókat eredményez.
Hogy megvizsgáljuk ezeknek a szabályoknak az
érvényességét és prediktív erejét, két különböző típusú de novo
szekvenciát terveztünk (1–3), melyek úgy teljesítik a fenti
szabályokat, hogy a várt szerkezetük helikális (5.
ábra). A tervezésnél alkalmaztuk a hélixet indukáló azonos
előjelű torziók és a periodikus sztereokémiai mintázat elvét, és az
általánosság kedvéért az α- és β-aminosavakat kombináltunk.
Létrehoztunk olyan negatív kontroll-láncokat is, ahol a
konfigurációkat felcseréltük (4–6).
A tervezett és kontrollpeptideket szilárd hordozón,
Fmoc kémiával szintetizáltuk meg, és HPLC-vel tisztítottuk. Az
anyagokat deuterált dimetil-szulfoxidban, metanolban és vízben
jellemeztük. A minták jelfeloldottsága jó volt, a NMR-jelek
hozzárendelését a 2D homonukleáris korrelációs spektrumok segítségével
végeztük el. A peptidkötések árnyékolására jellemző kémiai
eltolódás-hőmérsékleti koefficiensek jól jelezték a stabilizáló
hidrogénkötéseket. A nagyfelbontású szerkezetmeghatározást a távolható
keresztrelaxációs kölcsönhatások (ROESY – ROtating frame nuclear
Overhauser Effect SpectroscopY) segítségével végeztük el, ahol a
térközelben lévő hidrogénatomok mutathatók ki. A tervezett
szekvenciáknál egyértelműen láthatók a helikális szerkezetekre
jellemző kölcsönhatások. A kontrollszekvenciáknál efféle periodikus
szerkezetekre jellemző jeleket nem találtunk. A modellezést
molekuláris mechanikai szinten kényszerfeltétel nélküli
mintavételezéssel kezdtük meg. Itt a legalacsonyabb energiájú
konformációs családok egyértelműen mutatták a várt helikális
rendeződéseket. Az egyik szekvenciánál komplex, 9–10–11–12-tagú,
egymásba fűzött H-kötéses gyűrűk stabilizálják a hélixet, és a
peptidkötések alternáló orientációt mutattak. A másik modellünknél egy
H14/16 típusú hélixet kaptunk, ahol a peptidorientáció
(parallel–antiparallel–antiparallel)n mintázatot adott. Ilyen
hélixeket eleddig nem találtak. A kontrollszekvenciák nem mutattak
helikális rendeződést. A helikális konformáció detektálására
elektronikus cirkuláris dichroizmus (ECD-) spektroszkópiát
alkalmaztunk. Mindkét hélix esetében Cotton-effektust figyelhettünk
meg. A H14/16 kontrollszekvenciája nem mutatott ECD-aktivitást, míg a
H9-12 kontrollminta a helikálistól teljesen eltérő ECD-mintázatot
mutatott. A tervezett helikális mintáknál az ECD-jelek csökkent
intenzitással vízben is megtartották a jellegüket, ugyanakkor a
kontrollpeptidek elvesztették szerkezetüket ebben az oldószerben. Ezek
a megfigyelések alátámasztják, hogy a tervezett struktúrák a szerkezet
kellően stabilisak, a későbbiekben a vizes közegű biológiai
alkalmazások szóba kerülhetnek.
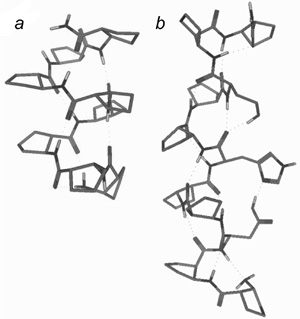
6. ábra • Az 1 (a) és 3 (b) peptidláncok
helikális szerkezetei. A geometriák igazolását oldatfázisban NMR- és
cirkuláris dichroizmus spektroszkópiák, valamint molekulamodel-lezés
segítségével végeztük el.
A természetes α-aminosavakból felépülő
proteinek/peptidek és a mesterséges β-peptidek másodlagos
szerkezeteinek átfogó vizsgálatával felismertük, hogy a gerinc
szénatomok térkémiája és a hozzájuk kapcsolódó torziós szögek között
általánosítható összefüggés áll fenn. Továbbá felfigyeltünk a torziós
szögek előjelének mintázata és a másodlagos szerkezet közötti
kapcsolatra is. Az összefüggések jól használható eszközt adnak a
térkémia másodlagos szerkezetre gyakorolt hatásának megértéséhez. A
szabályok prediktíveknek bizonyultak, mivel a segítségükkel új
hélixeket tudtunk tervezni, amelyek stabilisnak mutatkoztak
oldatfázisban (Mándity et al., 2009). Az eredményeink alátámasztják,
hogy a polipeptid láncok önrendeződéséhez nem szükséges a
homokiralitás; elegendő az említett szabályok szerinti periodikus
térkémia jelenléte. A mintázati megközelítés rámutatott arra is, hogy
a torziók előjele, illetve az ezt befolyásoló abszolút konfigurációk
egyfajta bináris kódot alkotnak, amelyek a másodlagos szerkezet
alaptípusát és több tulajdonságát képesek meghatározni. Ebben az
összefüggésben ezt egy szoftvernek foghatjuk fel, ami a peptidláncon
mint hardveren „végrehajtódva” a másodlagos szerkezetet adja
kimenetként. Úgy véljük, hogy a bemutatott módszer utat nyithat újabb
hélixtípusok létrehozásához, amelyek a jövőben a gyógyszerkutatás
területén nyerhetnek alkalmazást (Kritzer et al., 2005).
Köszönettel tartozom az OTKA (NF69316) anyagi támogatásáért. Köszönöm
a külső partnereknek (prof. dr. Tóth Gábor, dr. Fülöp Lívia, dr.
Hetényi Anasztázia [SZTE Orvosi Vegytani Intézet]; Prof. dr. Hollósi
Miklós, dr. Vass Elemér [ELTE Kémiai Intézet]), és munkatársaimnak
(Mándity István, Wéber Edit és Szolnoki Éva) az együttműködést és a
segítséget. Köszönet illeti mentoromat, prof. dr. Fülöp Ferenc
akadémikust.
Kulcsszavak: peptidomimetikum, sztereokémia, aminosavak,
β-aminosavak, β-peptidek, konformáció, NMR-spektroszkópia, cirkuláris
dichroizmus
IRODALOM
Carroll, James D. (2009): A New Definition
of Life. Chirality. 21, 3, 354–358.
http://www3.interscience.wiley.com/cgi-bin/fulltext/120082041/PDFSTART
Goodman, Catherine M. – Choi, S. -
Shandler, S. - DeGrado, W. F. (2007): Foldamers as Versatile
Frameworks for the Design and Evolution of Function. Nature Chemical
Biology. 3, 252–262.
Kritzer, Joshua A. – Luedtke, N. W. –
Harker, E. A. – Schepartz, A. (2005): A Rapid Library Screen for
Tailoring Beta-Peptide Structure and Function. Journal of the American
Chemical Society. 127, 14584–14585 (például).
Martinek Tamás A. – Fülöp Ferenc (2003):
Side-chain Control of Beta-peptide Secondary Structures. European
Journal of Biochemistry. 270, 3657–3666.
Martinek Tamás A. – Mándity I. M. – Fülöp
L. – Tóth G. K. – Vass E. – Hollósi M. – Forró E. – Fülöp F. (2006):
Effects of the Alternating Backbone Configuration on the Secondary
Structure and Self-Assembly of beta-Peptides. Journal of the American
Chemical Society. 128, 13539–13544.
Martinek Tamás A. – Hetényi, A. – Fülöp,
L. – Mándity, I. M. – Tóth, G. K. – Dékány, I. – Fülöp, F. (2006):
Secondary Structure Dependent Self-Assembly of b-Peptides into
Nanosized Fibrils and Membranes. Angewandte Chemie International
Edition. 45, 2396–2400.
Mándity István M. – Wéber E. – Martinek T.
A. – Olajos G. – Tóth G.K. – Vass E. – Fülöp F. (2009): Design of
Peptidic Foldamer Helices: A Stereochemical Patterning Approach.
Angewandte Chemie International Edition. 48, 2171–2175.
Meierhenrich, Uwe (2008): Amino Acids and
the Asymmetry of Life, Caught in the Act of Formation. Springer
Pályi Gyula – Zucchi C. – Caglioti L.
(eds.) (1999): Advances in BioChirality. Elsevier Science, Amsterdam
Rana, Soumendra – Kundub, B. – Durani, S.
(2005): A Small Peptide Stereochemically Customized as a Globular Fold
with a Molecular Cleft. Chemical Communications. 207–209.
WEBCÍM >
|