|
|
Összefoglalás
A rendezetlen fehérjék natív, funkcionális állapotukban sem
rendelkeznek jól definiált térszerkezettel, leginkább a globuláris
fehérjék denaturált állapotaira emlékeztetnek. Funkcióikat gyakran
partnerek felismerése, és azok jelenlétében történő feltekeredés révén
látják el. Leggyakrabban jelátviteli folyamatokban, a transzkripció és
sejtciklus szabályozásában vesznek részt, mutációik ezért gyakran
okoznak betegséget. Jelentőségükre utal, hogy az eukarióta genomok
mintegy 5–15%-a teljes hosszúságában rendezetlen fehérjéket kódol. A
rendezetlen fehérjék léte és funkciója szükségessé teszi a hagyományos
fehérjeszerkezet-funkció összefüggés újragondolását. Szerkezetük és
funkcióik részleteivel kapcsolatban ugyanakkor nagyon sok
megválaszolatlan kérdés maradt, így a rendezetlen fehérjék vizsgálata
napjaink fehérjetudományának egyik leggyorsabban fejlődő ága.
Bevezetés
A hagyományos nézet szerint a fehérje funkciójának elengedhetetlen
feltétele egy jól definiált háromdimenziós térszerkezet, amelyben az
atomok határozott térbeli pozíciója biztosítja a molekuláris
felismeréshez és katalízishez kulcsfontosságú kölcsönhatásokat. Ez a
hagyományos szerkezet–funkció paradigma jól magyarázza enzimek,
receptorok és szerkezeti fehérjék funkcióit, sikerét; általános
érvényességét jól mutatja a szerkezeti adatbázisban (Protein Data Bank
– PDB) található több mint 50 ezer szerkezet. Számos fehérje, illetve
fehérjedomén viselkedése azonban nem felel meg ennek a képnek, mivel
natív, funkcionális állapotukban sem rendelkeznek jól definiált
térszerkezettel, vagyis rendezetlenek (Dunker et al., 2001; Dyson –
Wright, 2005; Tompa, 2002).
Szerkezeti szempontból
ezek a fehérjék a globuláris fehérjék denaturált állapotaira
emlékeztetnek, vagyis nagyszámú, egymásba gyorsan átalakuló szerkezet
jellemzi őket. Mivel a rendezetlenség nem környezeti hatások
következménye, hanem ezen fehérjék funkcionális szempontból fontos,
saját tulajdonsága, a szakirodalom „intrinsically unstructured
protein” (IUP) vagy „intrinsically disordered protein” (IDP) néven
tartja őket számon. Számos esszenciális fehérje, mint a p53, BRCA1,
CREB, RNS polimeráz II és a prion fehérje esetében írtak le szerkezeti
rendezetlenséget (1.
táblázat). Bioinformatikai vizsgálatok azt mutatják,
hogy a rendezetlen fehérjék igen gyakoriak a különböző proteomokban,
és gyakoriságuk az organizmus komplexitásával növekszik (Dunker et
al., 2000; Tompa et al,. 2006; Ward et al., 2004).
A rendezetlenség funkcionális jelentőségét mutatja,
hogy igen gyakori a jelátvitelben, sejtciklus szabályozásában és
transzkripcióban szerepet játszó fehérjékben, valamint
dajkafehérjékben (1. táblázat) (Dunker et al., 2000; Tompa et
al., 2006; Ward et al., 2004). A rendezetlenség számos funkcionális
előnyt biztosít a fehérje számára, mint például a kölcsönhatás
megnövekedett sebessége, a nagyobb specificitás a kötéserősség
növekedése nélkül, illetve hogy ezek a fehérjék egyszerre több,
egymástól független funkció ellátására is képesek lehetnek (Tompa et
al., 2005). A rendezetlenség a speciális, a fehérje-feltekeredéssel
össze nem egyeztethető aminosavösszetétel következménye, amennyiben
ezekben a fehérjékben igen gyakoriak a rendezetlenséget elősegítő
aminosavak, mint például az Ala, Arg, Gly, Gln, Ser, Pro, Glu és Lys,
míg csaknem teljesen hiányoznak belőlük a rendezettséget elősegítő
aminosavak: a Trp, Tyr, Cys, Phe, Ile, Val, Leu és Asn (Dunker et al.,
2001). A rendezetlenség elsődleges fizikai oka így a nagy nettó töltés
és alacsony hidrofóbicitás, amelyek együttesen megakadályozzák, hogy a
fehérje kompakt, jól definiált térszerkezetet vegyen fel (Uversky et
al., 2000).
A rendezetlenség kísérletes bizonyítékai
A rendezetlen fehérjék natív körülmények között, funkcionális
állapotukban sem rendelkeznek jól definiált harmadlagos szerkezettel.
Alapvetően két vonatkozásban térnek el a globuláris fehérjéktől: 1.) a
harmadlagos kölcsönhatások hiányának köszönhetően nem rendelkeznek
stabil térszerkezettel, vagyis globularitással, illetve 2.) sokkal
kevesebb másodlagos szerkezeti elemmel rendelkeznek, vagyis átlagosan
jóval nagyobb bennük a coil konformáció előfordulása. Ezek a
különbségek gyakorlatilag minden fizikokémiai technika alkalmazásával
kimutathatók (Dunker et al., 2001; Tompa, 2002). A globularitás hiánya
feltűnő például hidrodinamikai technikák, úgy mint kisszögű
röntgenszórás (SAXS), ultracentrifugálás és gélfiltrációs
kromatográfia alkalmazásakor. Ezek a technikák rámutatnak a
rendezetlen fehérjék nagy látszólagos hidrodinamikai sugarára, illetve
térfogatára (például az azonos molekulatömegű globuláris fehérjénél
kétszer nagyobb girációs sugár, RG, illetve hidrodinamikai sugár, RH).
A differenciál pásztázó kalorimetria (DSC) szintén rávilágíthat arra,
hogy a rendezetlen fehérjék nem rendelkeznek kompakt, feltekeredett
szerkezettel, ami a kooperatív olvadási átmenet hiányában nyilvánul
meg. A kémiai, illetve hőindukált denaturációval szembeni ellenállás
is a kompakt szerkezeti állapot hiányának eredménye. A rendeződés
hiányára gyakran hiányzó röntgenkrisztallográfiás koordinátákból
következtethetünk. Bár a rendezetlen fehérjék nem kristályosíthatók,
így önmagukban teljesen hiányoznak a PDB-ből, a nagyobbrészt rendezett
fehérjék rendezetlen szakaszai gyakran megfigyelhetők ezzel a
technikával. NMR-spektroszkópia esetében a rendezetlenséget elsősorban
a kémiai eltolódások igen kicsi diszperziója mutatja. A másodlagos
szerkezeti elemek hiányára a távoli UV cirkuláris dikroizmus (CD)
spektroszkópia eredményeiből következtethetünk, míg a Raman-optikai
aktivitás (ROA) és a Fourier-transzformált infravörös (FTIR)
spektroszkópia az ismétlődő, másodlagos szerkezeti elemek relatíve kis
mennyiségét mutatja ki. Közvetett megközelítések szintén segíthetnek a
rendezetlen fehérjék nem hagyományos szerkezeti állapotának
felderítésében. A polipeptidlánc nagymértékű flexibilitása és
hozzáférhetősége extrém proteolitikus érzékenységet eredményez. A
rendezetlen fehérjék alacsony átlagos hidrofóbicitásuk miatt gyakran
hőstabilak, mivel magas hőmérsékleten sem hajlamosak aggregációra,
illetve kevés SDS-t kötnek, így anomáliásan futnak SDS poliakrilamid
gélen, ami általában nagy látszólagos Mw értékben jelentkezik.
A fenti technikák alkalmazása nemcsak a fehérje rendezetlenségére
szolgáltathat információt, hanem részletes szerkezeti karakterizálását
is lehetővé teszi. Az ilyen vizsgálatok gyakran a rendezetlen
fehérjékben megfigyelhető, funkcióval összefüggő szerkezeti elemekre,
lokális stabilitást mutató α-hélix vagy β-turn elem, vagy a nyújtott
és teljesen hidratált másodlagos szerkezeti motívum, a PPII-hélix
jelenlétére utalhatnak. Számtalan ilyen vizsgálat mutat arra, hogy a
rendezetlen fehérjék gyakran nem teljesen rendezetlenek, hanem
jelentős mennyiségű szerkezeti elemet tartalmazhatnak, ún. premolten
globula (PMG) vagy molten globula (MG) konformációt vehetnek fel. A
lokális szerkezeti preferenciák jelentős korrelációt mutatnak azzal a
szerkezettel, amit a fehérje a kötött állapotban vesz fel, ami arra
utal, hogy ezek a fehérjék is rendelkeznek tranziens szerkezeti
elemekkel. Ezeket az elemeket előre kialakult kötőhelyeknek (preformed
structural element – PCS [Fuxreiter et al., 2004]), vagy molekuláris
felismerő elemeknek (molecular recognition element – MoRE [Oldfield et
al., 2005]) hívják.
A fehérje-rendezetlenség gyakorisága
A rendezetlenséget kísérletes úton mintegy ötszáz fehérje esetében
igazolták (lásd DisProt, a fehérje-rendezetlenség adatbázisa
[Sickmeier et al., 2007]), és ezeknél a fehérjéknél a legtöbb esetben
arra is rámutattak, hogy rendezetlenségük a funkció ellátása
szempontjából kulcsfontosságú. Ismert például, hogy a p53
tumorszupresszor fehérje transzaktivátor doménje, amely
kulcsfontosságú kölcsönhatásokat alakít ki a sejtosztódás-szabályozás,
illetve az apoptózis során, teljesen rendezetlen. Hasonlóan, a mellrák
kialakulásában szerepet játszó BRCA1 hosszú középső szegmense, ami
számos igen fontos kölcsönhatást alakít ki nemcsak a DNS-sel, de a
p53, c-myc, Rad50 és más fehérjékkel, nagymértékben rendezetlen. Az
RNS-polimeráz II (RNAP II) legnagyobb alegysége C-terminális
doménjének (CTD) koordinátái hiányoznak a komplex
röntgenszerkezetéből, vagyis ez a domén teljesen rendezetlen.
Funkcionális vizsgálatokból ugyanakkor tudjuk, hogy ez a régió a
mRNS-érés sokrétű folyamatainak összehangolásáért felelős,
eltávolítása az élettel összeegyeztethetetlen (letális mutáció). A
prion fehérje rézion kötésért felelős N-terminális fele ugyancsak nem
rendelkezik jól definiált térszerkezettel, ugyanakkor szerepe van a
prionállapotba való átalakulásért. Ismert, hogy a
Parkinson-betegségben megfigyelhető amiloid rostok (Lewy-testek)
kialakulásáért felelős α-szinuklein teljes hosszúságában rendezetlen.
Az is a rendezetlenség biológiai jelentőségére
utal, hogy bioinformatikai becslések szerint ezek a fehérjék igen
gyakoriak a különböző proteomokban (Dunker et al., 2000; Tompa et
al., 2006; Ward et al., 2004). A predikciós algoritmusok, mint a
PONDR, FoldIndex és IUPred a rendezetlen fehérjék speciális
szekvenciális összetételén alapulnak, és a másodlagos szerkezeti
elemeket jósló algoritmusok megbízhatósági szintjén működnek. Egész
proteomokra vonatkozó becslések azt mutatják, hogy a prokariótákban a
fehérjék 10–20 %-a rendelkezik legalább egy hosszú (≥30 aminosav)
rendezetlen régióval, míg az eukarióták esetében ez a szám 30–60% is
lehet. Eukariótákban a fehérjék 5–15%-a teljesen rendezetlen, vagyis
nincs bennük egyetlen felismerhető szerkezeti domén sem, és
gyakorlatilag teljesen hiányoznak belőlük a harmadlagos
kölcsönhatások. Az eukariótákban megfigyelhető nagy gyakoriság
valószínűleg azzal magyarázható, hogy a rendezetlenség jól korrelál
jelátviteli, sejtciklus szabályozási és génexpresszióval kapcsolatos
funkciókkal, amelyek nagy jelentőséggel bírnak magasabbrendű
organizmusokban.
|
|
|
A rendezetlen fehérjék
működési módjai és funkciói
A rendezetlen fehérjék funkciója származhat abból, hogy több
szerkezeti állapot között folyamatosan fluktuálnak, vagy abból, hogy
adaptív módon különböző szerkezettel képesek egy vagy több
partnermolekulához kötődni. Ezek a tulajdonságok igen sokféle
molekuláris folyamatban történő részvételt tesznek lehetővé, ezek
alapvetően hat különböző kategóriába sorolhatók (1.
táblázat [Tompa 2002]).
A rendezetlen fehérjék első funkcionális osztálya
az entrópikus láncok, amelyek nem kötődnek partnerhez, funkciójuk
közvetlenül a rendezetlen szerkezeti állapotból következik. Az
entropikus láncok vagy a szerkezeti változásokkal szemben fejtenek ki
ellenállást (elasztikus funkciók), vagy a hozzájuk kapcsolódó domének
orientációját/lokalizációját befolyásolják (flexibilis
linkerek/spacerek). A további öt funkcionális osztály esetén a
rendezetlen fehérjék molekuláris felismerésben vesznek részt, vagyis
átmenetileg vagy tartósan más makromolekulákat, illetve kisebb
ligandumokat kötnek meg (1. ábra). A partnerüket tranziensen
kötő fehérjék olyan poszttranszlációs módosítási helyeket
hordozhatnak, mint például a foszforiláció vagy ubikvitináció helye,
amely gyakran lokálisan rendezetlen szakaszba esik (bemutatóhely
funkció). Egy másik funkcionális alkategória, a dajkafehérjék
(chaperonok) szintén tranziensen kötődnek partnerükhöz. Statisztikai
elemzések azt mutatják, hogy az RNS-chaperonokban a rendezetlenség
mértéke magasabb, mint bármely más funkcionális osztályban, több mint
80%-uk tartalmaz hosszú rendezetlen régiót (Tompa – Csermely, 2004).
Ezekben a fehérjékben a rendezetlen régiók a rosszul feltekeredett
partnermolekulák felismerésére, illetve a hibás szerkezet
fellazítására szolgálnak.
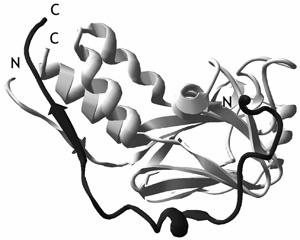
1. ábra • Partneréhez kötött rendezetlen
fehérje szerkezete. Néhány rendezetlen fehérjénél
röntgenkrisztallográfia vagy NMR spektroszkópiai vizsgálatokból ismert
a komplexben lévő szerkezetük. Az ábrán a TGF-beta jelátvitelben
szerepet játszó rendezetlen „Smad-anchor for receptor activator”
(SARA, sötét) látható a Smad2 MH2 doménjéhez (világos) kötve. A
rendezetlen fehérje nyújtott állapotban, gyakorlatilag egész lánca
mentén kötődik, ami nagy kötőfelszínt és specifitást biztosít.
Azok a rendezetlen fehérjék, amelyek tartósan kötik
partnerüket, három alosztályba sorolhatók, funkcióikat effektorként,
összeszerelőként, vagy raktározóként láthatják el. Működésük
sajátsága, hogy a kötödés során indukált feltekeredésen mennek
keresztül, és így gyakran a komplexben kialakuló szerkezetük ismert
(1. ábra). Az effektorok a partner aktivitását módosítják,
leggyakrabban gátolják, ritkábban aktiválhatják is. Az összeszerelők
nagy, több fehérjéből álló komplexek szervezésében vesznek részt,
esetleg a kapcsolt domének aktivitását irányítják. Tipikus
összeszerelő funkció a transzkripciós faktorok rendezetlen
transzaktivátor doménjének működése. A raktározók kisebb ligandumokat
raktároznak, és/vagy neutralizálnak, aminek klasszikus példája a
kazein, ami megakadályozza a kalcium-foszfát kiválását a tejben, mivel
képes kisméretű szemcsék gyors és nagy kapacitású megkötésére. Egyes
raktározókat fémszivacsnak is neveznek, mivel nagyszámú fémion gyenge
kötésére képesek.
A rendezetlenség funkcionális előnyei
A rendezetlen fehérjék funkcionális sokfélesége, illetve a
rendezetlenség eukarióta proteomokban megfigyelhető gyakorisága azt
sugallja, hogy a globuláris szerkezet hiánya a fehérje funkciója
szempontjából gyakran jelentős előnyökkel járhat (Dunker et al., 2001;
Dyson – Wright, 2005; Tompa, 2002). Az előny leginkább az entrópikus
láncok esetében nyilvánvaló, amelyeknél a funkció közvetlenül a
rendezetlen állapotból következik.
A molekuláris felismerés során egy jelentős további
előny származhat a partner kötödése által a rendezetlen fehérjében
indukált feltekeredés tényéből. Mivel ilyenkor a fehérje konformációs
entrópiája jelentősen csökken, a kötődés specifitása és erőssége
elválik egymástól, vagyis a nagy specificitás alacsony affinitással
párosul, ami a kölcsönhatás reverzibilitásában és szabályozásában
jelentkezik. További előnyt jelent, hogy nagymértékben megnövekedhet a
kölcsönhatás sebessége, ami szintén a szabályozó funkciók esetében
játszhat komoly szerepet. A hatás annak köszönhető, hogy a rendezetlen
fehérjék nagy távolságból, és kezdetben aspecifikusan köthetik
partnerüket, ami megnöveli a kezdeti komplex életidejét.
A rendezetlen fehérjék nagy, nyitott kölcsönható
felszíne lehetővé teszi, hogy a fehérje sok ponton kötődjön a
partneréhez, és/vagy egyszerre nagyszámú partnert kössön. Ennek
megfelelően a rendezetlen fehérjék nagy kölcsönható kapacitással
rendelkeznek, illetve kölcsönhatásaik igen specifikusak lehetnek,
mivel partnerüket több, távoli régióban is kötni képesek. Ez előnyös
lehet nagy komplexek összeszerelésekor és különböző partnerek térben
történő koordinálásakor is. A rendezetlenség magában hordozza annak a
lehetőségét is, hogy a fehérje különböző partnerekhez adaptálódjon,
és többféle funkciót is el tudjon látni. Ismert például, hogy a Cdk
inhibitor p21Cip1 képes több különböző ciklin-Cdk komplexet is gátolni
(Kriwacki et al., 1996). A szerkezeti plaszticitás egy extrém
funkcionális kifejeződése, amikor a rendezetlen fehérje több ellenkező
funkciót is ellát, különböző partnerek esetében (Tompa et al., 2005).
Ez e lehetőség nagymértékben megnövelheti a fehérje-kölcsönhatások
komplexitását a gének számának növekedése nélkül.
A rendezetlen fehérjék extrém proteolitikus
érzékenysége lehetővé teszi sejten belüli koncentrációjuk hatékony
szabályozását is. A degradációs szignálként funkcionáló PEST- (Pro-
Glu-, Ser- és Thr-gazdag) régiók és a rendezetlenség között fennálló
erős korreláció szintén ezt támasztja alá.
További kutatási irányok a rendezetlenség terén
Bioinformatikai vizsgálatok azt mutatják, hogy a rendezetlenség a
magasabb rendű eukariótákban, például a humán proteomban nagyon magas
szintet érhet el. Kísérletes úton ugyanakkor még csak néhány száz
fehérje szerkezeti rendezetlenségét jellemezték, vagyis még nagyon
hosszú út vezet ezen fehérjeosztály részletes megértéséig, és a
szerkezet–funkció paradigma kiterjesztéséig. A rendezetlen fehérjék
nagy számban történő proteomikai azonosítására gyakorlatilag alig
történt kísérlet, ezért ezen a területen jelentős aktivitás várható. A
rendezetlen fehérjék részletes nagyfelbontású szerkezeti vizsgálata is
sok esetben hiányos még, ami szintén kitüntetett kutatási irányt
jelent, mivel a különböző kötődési funkciók részletes megértése csak
ilyen vizsgálatokon keresztül lehetséges. A rendezetlen fehérjék
funkcionális vizsgálata is sok fontos eredménnyel kecsegtet, mivel a
rendezetlenség funkcionális jelentőségének és mechanizmusának
megértése az egyik legfontosabb jövőbeni kihívás. Az ezeken a
területeken történő lényeges előrelépés lehetővé teszi majd ennek a
szerkezetileg érdekes és funkcionálisan fontos fehérjecsoport
részletes megértését, és tágabb értelemben a fehérjék
szerkezet–funkció összefüggéseire vonatkozó modellünk kiterjesztését.
Kulcsszavak: szerkezet nélküli fehérje, fehérje-fehérje interakció,
indukált feltekeredés, bioinformatika, funkcionális promiszkuitás
IRODALOM
Dunker, A. Keith – Lawson, J. D. – Brown,
C. J. et al. (2001): Intrinsically Disordered Protein. Journal of
Molecular Graphics and Modelling. 19, 26–59.
Dunker, A. Keith – Obradovic, Z. – Romero,
P. – Garner E. C. – Brown C. J. (2000): Intrinsic Protein Disorder in
Complete Genomes. Genome Informamatics. Workshop on Genome
Informatics. 11, 161–171.
WEBCÍM
>
Dyson, H. Jane – Wright, Peter E. (2005):
Intrinsically Unstructured Proteins and Their Functions. Nature
Reviews Molecular Cell Biology. 6, 197–208.
Fuxreiter Mónika – Simon I. – Friedrich P.
– Tompa P. (2004): Preformed Structural Elements Feature in Partner
Recognition by Intrinsically Unstructured Proteins. Journal of
Molecular Biology. 338, 1015–1026.
Kriwacki, R. W. – Hengst, L. – Tennant, L.
– Reed, S. I. – Wright, P. E. 1996): Structural Studies of
p21Waf1/Cip1/Sdi1 in the Free and Cdk2-Bound State: Conformational
Disorder Mediates Binding Diversity. Proceedings of the National
Academy of Sciences of the USA. 93, 11504–11509.
Oldfield, Christopher J. – Cheng, Y. –
Cortese, M. S. – Romero, P. – Uversky, V. N. – Dunker, A. K. (2005):
Coupled Folding and Binding with Alpha-Helix-Forming Molecular
Recognition Elements. Biochemistry. 44, 12454–12470.
Sickmeier, Megan – Hamilton, J. A. –
LeGall, T. et al. (2007): Disprot: The Database of Disordered
Proteins. Nucleic Acids Research. 35, D786–D793.
Tompa Péter (2002): Intrinsically
Unstructured Proteins. Trends in Biochemical Sciences. 27, 527–533.
Tompa Péter – Csermely Péter (2004): The
Role of Structural Disorder in the Function of RNA and Protein
Chaperones. FASEB Journal. 18, 1169–1175.
Tompa Péter – Dosztányi Z. – Simon I.
(2006): Prevalent Structural Disorder in E. coli and S. cerevisiae
Proteomes. Journal of Proteome Research. 5, 1996–2000.
Tompa Péter – Szász C. – Buday L. (2005):
Structural Disorder Throws New Light on Moonlighting. Trends in
Biochemical Sciences. 30, 484–489.
Uversky, Vladimir N. – Gillespie, J. R. –
Fink, A. L. (2000): Why Are „Natively Unfolded” Proteins Unstructured
Under Physiologic Conditions? Proteins. 41, 415–427.
Ward, J. J. – Sodhi, J. S. – Mcguffin, L.
J. – Buxton B. F. – Jones D. T. (2004): Prediction and Functional
Analysis of Native Disorder in Proteins from the Three Kingdoms of
Life. Journal of Molecular Biology. 337, 635–645.
|
|