|
|
Speciális tulajdonságokkal bíró kémiai
rendszerekben – bizonyos feltételek teljesülése esetén – a molekulák
makroszkopikus önszerveződése következik be, amely folyamán a
kezdetben homogén rendszerek időben vagy térben szabályos (periodikus)
struktúrákká rendeződnek. Időben periodikus struktúraként tekintjük az
oszcilláló kémiai reakciókat (itt a koncentráció periodikusan változik
az időskálán). A térkoordináták mentén kialakuló periodikus
koncentrációeloszlás 1-, 2- vagy 3-D formájú mintázatképződés
kialakulásához vezet. Az időben és térben jelentkező
koncentrációoszcilláció és rokon jelenségeik (multistabilitás, káosz,
gerjeszthetőség…) számos kémiai rendszerben megvalósul vagy
megvalósítható, kialakulásuk törvényszerűségei tanulmányozhatók és
megismerhetők. Az így szerzett ismeretek felhasználhatók az élő és
élettelen természetben (biológiai, technológiai, társadalmi
folyamatokban) gyakran és sokkal bonyolultabb szinten megnyilvánuló
periodikus jelenségek jobb megértésében és befolyásolásában.
Periodikus kémiai jelenségek
A legtöbb kémiai reakcióban a kiindulási anyagok koncentrációja
monoton csökken, a termékek koncentrációja monoton nő, a köztitermékek
koncentrációja legfeljebb egy szélsőértéket mutatva változik, amint a
reakció a végállapot felé halad. Speciális tulajdonságokkal bíró
kémiai rendszerekben azonban, bizonyos kinetikai és termodinamikai
feltételek teljesülése esetén a bruttó reakcióban részt vevő molekulák
önszerveződése következik be, és a kezdetben homogén rendszerekben
szabályos struktúrák jelennek meg. A struktúrákban egyes molekulák
koncentrációja periodikusan változik, azaz oszcillál. Az oszcilláció,
függően a kísérleti körülményektől, bekövetkezhet az időskálán vagy a
térkoordináták mentén. Ha a periodikus koncentrációeloszlás az
időskálán valósul meg, időben periodikus struktúráról, ún. oszcilláló
kémiai reakcióról beszélünk. Ha a koncentrációoszcilláció a
térkoordináták mentén alakul ki, 1-, 2- vagy 3-dimenziójú mintázatok
képződnek.
A „normális” (monoton lefolyású) és az időben
periodikus kémiai reakcióban bekövetkező koncentrációváltozásokat az
1. ábra mutatja. Ha az oszcilláló kémiai rendszer
anyagtranszport szempontjából zárt, a kiindulási anyagok és a
végtermékek koncentrációja lépcsőzetesen csökken, illetve nő, a
köztitermékek koncentrációja oszcillál. Az oszcillációk amplitúdója
zárt rendszerben csillapított, mert a reakció előrehaladtával a
reaktánsok elhasználódnak. Nyitott rendszerben azonban (itt folyamatos
reagens betáplálás és termékelvezetés történik), az összes komponens
koncentrációjának csillapítatlan oszcillációja valósítható meg. Az
oszcillációk kísérletileg követhetők minden olyan paraméter vagy
tulajdonság (például szín, redoxpotenciál, ionszelektív elektród jele,
ESR-jel…) mérésével, amelynek kialakításában az oszcilláló speciesz
részt vesz. A nyitott rendszerben mért oszcillációs jelek alakja és
amplitúdója legtöbbször azonos (egyszerű oszcillációk). Felléphetnek
azonban különböző alakú és nagyságú jelekből álló, egymást szabályos
szakaszokban követő összetett oszcillációk is, de néha teljesen
szabálytalan, aperiodikus oszcillációkkal is találkozunk. Ez utóbbi
jelenség neve „kémiai káosz”.
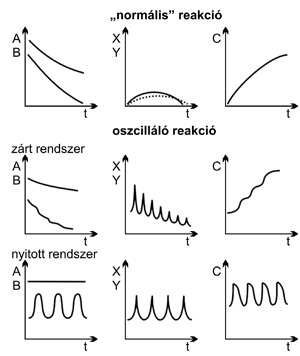
1. ábra • Koncentráció vs idő diagram az A +
B → (X, Y) → C reakcióban. A és B: kiindulási anyagok, X és Y:
köztitermék, C: végtermék, t: idő
Térben periodikus koncentrációeloszlás (szabályos
mintázat) egy, összetételénél fogva időbeni oszcillációkra képes
rendszerben alakulhat ki, akkor, ha mechanikus keverést nem
alkalmazunk, és a konvekció lehetőségét is kizárjuk (például a
reaktánsokat néhány mm átmérőjű csőbe töltve egydimenziós, vékony
rétegben – Petri-csészében, gélben, membránban, porózus üvegben –
reagáltatva kétdimenziós, oldattömbben háromdimenziós struktúrák
képződnek). A mintázatok két változatban, dinamikus vagy mozgó kémiai
hullámok (pulzáló koncentrikus körök, ezek megzavarásával forgó
spirálok), vagy stacionárius állóhullámok (pontokból,
labirintusszerű csíkokból, sávokból képződött struktúrák), (2.
ábra) formájában képződnek. Hasonlóan az időbeni
koncentráció-oszcillációhoz, térbeni mintázatok is megjelenhetnek az
1. és 2. ábrán bemutatottakhoz képest összetettebb változatban, sőt
kaotikus szerkezetek is kialakulhatnak. Periodikus viselkedés homogén
(gáz- vagy folyadékfázisban) és heterogén rendszerekben (szilárd fázis
és fluid fázis határfelületén) egyaránt megvalósulhat.

2. ábra • Mozgó kémiai hullámok és
stacionárius struktúrák kémiai rendszerekben
A periodikus kémiai struktúrák
kialakulásának mechanizmusa
A periodikus kémiai jelenségek kialakulásához termodinamikai és
kinetikai feltételek egyidejű teljesülése szükséges. Egy kémiai
rendszerben periodikus koncentrációváltozás csak az egyensúlytól
távoli állapotban lehetséges (termodinamikai feltétel). Zárt
rendszerben a kémiai reakció korai szakasza tekinthető az egyensúlytól
távoli állapotnak. Nyitott rendszerben a folyamatos anyagtranszport
következtében a nemegyensúlyi állapot mindig fennáll.
Oldatfázisban koncentráció-oszcilláció
létrejöttének legalapvetőbb kinetikai feltétele az, hogy a kémiai
reakció mechanizmusában (az elemi lépések összességében) pozitív és
negatív visszacsatolások érvényesüljenek. Kémiai visszacsatolásról
akkor beszélünk, ha a bruttó reakció mechanizmusát alkotó elemi
lépések egyikében keletkezik olyan köztitermék, amely egy korábbi
lépést felgyorsít (a köztitermék neve: „aktivátor”, a jelenség: (+)-
visszacsatolás) vagy lelassít (a köztitermék neve: „inhibitor”, a
jelenség:(–)-visszacsatolás).
Az időben és térben periodikus jelenségek
oldatfázisban történő kialakulásának kvalitatív értelmezése az
„aktivátor-inhibitor modell” alapján (is) lehetséges. Az oszcillációs
ciklusban szerepet játszó elemi lépéseket (mechanizmust) és a ciklus
kialakulását az 3. ábra szemlélteti. Az A → (X, Y) → C
folyamattal leírható oszcilláló kémiai reakcióban (ahol A a
reaktánsokat, C a termékeket, az X és Y köztitermékek közül X az
aktivátort, Y az inhibitort képviseli), az iniciáló lépésben (forrás-
vagy start-reakcióban) kis mennyiségű X képződik ( A → X ), majd lévén
X autokatalikus ( önmaga keletkezését elősegítő) speciesz, termelődése
exponenciálisan felgyorsul [( A + X → 2X ) ; (+) visszacsatolás]. A
később megjelenő Y elfogyasztja X-et [( X + Y → ), (–)
visszacsatolás], ezáltal leállítja az ( A + X → 2X ) reakciót, majd
(valamilyen köztiterméken át) végtermékké alakulva ( → C ) eltűnik a
rendszerből. Ezzel zárul az A → C ciklus. Újra akkor indul, ha a
rendszerben maradtak még reagensek (zárt rendszer), vagy az
elhasználódott reagenseket betáplálással pótoljuk (nyitott rendszer).
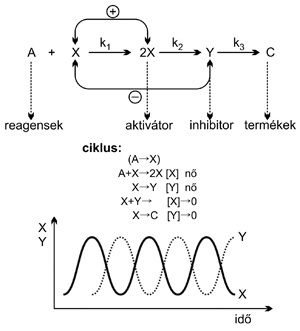
3. ábra • Az oszcillációs ciklus értelmezése
az aktivátor-inhibitor modell alapján
|
|
|
Az aktivátor-inhibitor mechanizmus érvényesülése a
periodikus kémiai jelenségek kialakulásának szükséges, de nem
elégséges feltétele. Oszcillációk kialakulásához parametrikus
feltételek teljesülése is kell. A termodinamikai és kinetikai
feltételeket kielégítő rendszer csak bizonyos kiindulási
koncentrációknál (ez beállítható) és csak a sebességi együtthatók (ami
a reagáló molekulák természetétől függ) szűk intervallumában mutat
oszcillációkat. Más paraméterkészlet mellett a tárgyalt mechanizmus
vagy monoton reakciót ír le, vagy alapja és forrása lehet egyéb, az
oszcillációval rokon dinamikai jelenségek kialakulásának, ilyen
például a multistabilitás (többféle stacionárius állapot
megvalósíthatósága azonos kísérleti feltételek mellett),
gerjeszthetőség (perturbációk felerősödése), káosz (aperiodikus
oszcilláció), fázisszinkronizáció (oszcillációs jelerősítés vagy
-kioltás kapcsolt rendszerekben) stb.
Ha egy kémiai rendszerben az oszcilláció
kialakulásának valamennyi feltétele (termodinamikai, kinetikai,
parametrikus) teljesül, a periodikus koncentrációeloszlás megjelenési
formája az alkalmazott kísérleti körülményektől (a reakció
kivitelezési módjától) függ. Intenzív mechanikai keverést alkalmazva a
rendszer a reakciótér minden pontján azonos időpontban jut azonos
állapotba, ezért a köztitermékek (nyitott rendszerben a kiindulási és
végtermékek is) koncentrációja, valamint a velük kapcsolatos
paraméterek időben történő oszcillációját tapasztaljuk. Mechanikusan
nem kevert, konvekciómentes rendszerben a reagáló molekulák csak
diffúzió útján (a koncentrációgradiens hatására) mozognak és az
oszcillációs kinetika a diffúzióval kölcsönhatásban „reakció-diffúzió”
eredetű térbeni struktúrákat, dinamikus mintázatot vagy pedig
stacionárius szerkezetet hozhat létre.
4. ábra • Dinamikus struktúrák (koncentrikus
körök, spirálok) kialakulása
5. ábra • Stacionárius struktúrák (pontok,
csíkok, sávok) kialakulása
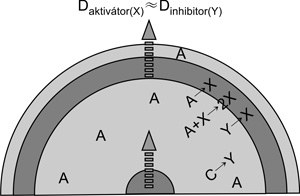
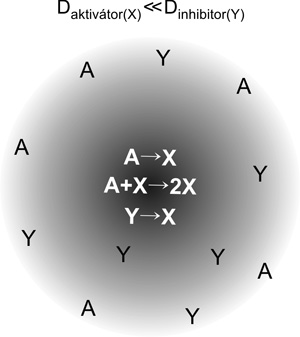
A kétdimenziós dinamikus és stacionárius
„reakció-diffúzió” struktúrák kifejlődése a 4. és 5. ábrán követhető.
Az összetétele alapján időbeni oszcillációra képes rendszer vékony
oldatrétegében a reagensek (A) koncentrációeloszlása kezdetben
homogén. Egy bevezető (indukciós) idő után valamilyen heterogenitás
(porrészecske, karcolás a reakcióedény falán…) vagy fluktuáció
hatására a reakciótér egy (vagy több) pontján a reakció elindul, itt
az aktivátor (X) nagymértékben feldúsul, és diffúzió útján terjed az
A-ban gazdag környezetben. Fáziskéséssel Y, az autokatalitikus reakció
inhibitora is megjelenik. A rendszer további önszerveződése az X és Y
diffúzió sebességétől [a diffuzióállandók (D) viszonyától] függ. Ha
ezek közel azonosak, akkor az X-ben gazdag front kifelé terjed, de a
front mögött az ( X + Y → ) reakció miatt X eltűnik, a maradék Y
végtermékké alakul és a frontot követő zóna regenerálódik. Mivel ebben
az eredeti reagensek még részben jelen vannak, a hullámok újra és újra
elindulhatnak, ami a 2. ábrán bemutatott körkörös mintázatot
eredményezi. A hullámfrontok
találkozáskor egymást kioltják, végül a legerősebb centrumból kiinduló
hullámok uralják a teljes reakcióteret. Ha az Y inhibitor jóval –
legalább egy nagyságrenddel – gyorsabban diffundál, mint az X
aktivátor, stacionárius struktúra fejlődik ki. A startreakció centruma
körül kialakuló autokatalitikus zónában fáziskéséssel keletkező Y
gyorsan átterjed a zóna határán túli területre, és létrehoz egy Y-ban
gazdag környezetet, ami megakadályozza, hogy X diffúzióval bejusson
erre a területre. A reakciótér több helyén is beinduló reakció
következtében további foltok, ezek összeolvadása esetén csíkok vagy
sávok jönnek létre (2. ábra). Az eredő mintázat tehát az Y
inhibitor-tengerben kialakuló, az X aktivátorban gazdag szigetekből
áll.1
Periodikus kémiai rendszerek laboratóriumban előállított példái
A periodikus struktúrák kialakulásának összes feltétele egyidejűleg
kevés kémiai rendszerben teljesül, illetve teljesíthető, ezért az
oszcilláló kémiai reakciók száma is viszonylag kevés. A ma ismert
oldatfázisú oszcilláló kémiai rendszereket – az oszcillációs ciklus
kémiájának hasonlósága alapján – nyolc csoportba soroljuk, ezekbe
mintegy százötven variáns tartozik. Mindegyikben jelen van egy
oxidálószer és egy vagy több redukálószer (működésük a redox kémián
alapul), de esetenként fémion-katalizátort, savat, bázist vagy puffert
is tartalmaznak. Megkülönböztetünk bromát, klorit, oxigén,
hidrogénperoxid, mangán, bromit és Cu(II)-katalizált oszcilláló
rendszereket, továbbá pH-oszcillátorokat. Újabban – egy redox
oszcillátor és olyan komplexképzési vagy csapadékos egyensúly
összekapcsolásával, amelyben a célelem részt vesz – megvalósítottuk
nem-redox tulajdonságú ionok (Ca2+, Zn2+, Cd2+, Al3+, F-…)
koncentrációjának indukált oszcillációját is.2 Dinamikus mintázatokat
eddig csak néhány bromát és klorit oszcillátorban, stacionárius
(Turing-) struktúrát pedig csupán három rendszerben (BZ-, CIMA-,
FIS-reakciókban)3 sikerült kísérletileg előállítani.
A molekuláris szintű (kémiai) idő- és térbeni önszerveződés
kutatásának jelentősége
Az időben és térben periodikus viselkedési formákkal és a kapcsolt
jelenségekkel nemcsak a kémiában, hanem a biológiai rendszerekben, a
geológiában, a technológiai folyamatokban, de még a társadalmi és
gazdasági szférában is találkozhatunk.
Nyilvánvaló a formális hasonlóság például a kémiai oszcilláció és
a biológiai ritmusok, vagy a gazdasági válságok, a kémiai káosz és a
szívinfarktus, a gerjeszthetőség és az ingerületvezetés, a
fázisszinkronizáció és a növények viselkedése a sötét–világos napi
ciklusban, a mozgó kémiai hullámok és a nyálkagomba-kolónia
aggregációja, vagy a békapetesejt felületén időszakosan megjelenő Ca2+
spirálok (6. ábra), a stacionárius
kémiai szerkezetek és a trópusi halakon látható mintázatok között. A
hasonló jelenségeknek persze nem feltétlenül hasonló az oka és
magyarázata. Valószínűsíthető azonban, hogy a felsorolt jelenségek
kialakulása kvalitatíve hasonló módon, egy univerzális mechanizmus
szerint történik. Ennek feltárására leginkább a kémia alkalmas, mert a
legegyszerűbb szinten, molekuláris szinten képes a periodikus és rokon
viselkedési formákat előállítani, tanulmányozni, szabályokat és
törvényszerűségeket levonni, modellezni, megérteni, és végső célként
hozzájárulni a kémiai rendszereknél bonyolultabb formában
megnyilvánuló periodicitások mechanizmusának tisztázásához.
Kulcszavak: periodicitás (kémiai rendszerekben), oszcilláló reakciók,
kémiai mintázatok, önszerveződés
1 A dinamikus és
stacionárius „reakció-diffuzió” szerkezetek kialakulása és a
mintázatok alakzata formálisan szemléltethető egy (például
villámcsapás által okozott) erdőtűz különböző hatásfokú elfojtásával,
illetve az eloltás után látható képpel. Tekintsük a fák és az
aljnövényzet hamuvá válását reakcióként, a tűz az aktivátor, a tűzoltó
az inhibitor, aki a tűz terjedését helikopterről permetezett
oltóanyaggal próbálja megakadályozni. Ha a tűzoltó a tűz kitörése után
(fáziskéséssel) csak a lángok terjedési sebességével vagy lassabban
oltja a tüzet, akkor az erdő köralakban leég (majd idővel
regenerálódik, így a folyamat a jövőben megismétlődhet). Ha viszont a
tűzoltó gyorsabban dolgozik, mint a tűz terjedése, akkor a
lepermetezett erdőben csak kiégett sötét folt, több tűzgóc esetén
foltok láthatók a zöld zónában.
<
2 Az oszcillátorcsaládok
és variánsok kb. felét kutatócso-portunk (ELTE Kémiai Intézet
Nemlineáris Kémiai Dinamika Laboratórium, OTKA K 67701 és K 62029)
állította elő.
<
3 BZ:
bromát-malonsav-ferroin; CIMA: klorit-jodid-malonsav; FIS:
ferrocianid-jodát-szulfit
<
|
|