|
felvéve további energiát ad a „PS II”
elektron/protonnak, hogy a CO2-molekula beépülési
folyamata végbemenjen. Így a fotoszintézisben összesen nyolc „vörös
foton” szükséges egy oxigénmolekula felszabadításához, illetve a CO2-molekula
beépüléséhez. Jellegzetes termék a glükóz (C6H12O6).
Egy molekula glükóz keletkezéséhez negyvennyolc „vörös foton”/680nm)
szükséges. A rövidebb hullámhosszakon (például kék fény)
energia-értékcsökkenés lép fel. A növények légzése és különböző
belső folyamatok miatt a fotoszintézis várható hatékonysága, mint
láttuk, 4–6%. Ténylegesen az 1%-ot sem igen éri el.
A teljes sugárzásból csak a két részspektrum részaránya hasznosul,
ami a teljes energiának kis része. A hasznosulás összhatásfoka
alacsony, amire közelítő számítással tájékoztató értéket kaphatunk.
Diszkrét energiaátadás esetén E adagokban történik az energiaátadás.
A példánál egy 6000 K hőmérsékletű sugárforrás spektrumát vesszük
figyelembe (Nyitrai et al., 2012).
E = ν×h, ahol ν a frekvencia; h a Planck-állandó
értéke: 6,625×10-34 Js.
Elektrolízis
A napenergia energetikai hasznosításakor a tárolási lehetőségeket is
figyelembe véve a vízbontási technológiák fejlesztése a
legígéretesebb. A napenergiának a fogyasztási igény változása
szerinti rendelkezésre állásra a közvetlen villamosenergia-nyerés
mellett a vízbontással való hidrogénfejlesztésre nyújt lehetőséget.
Erre az egyik megoldás lehet, hogy napelemmel villamosenergiát
fejlesztünk, és egy részét vagy az egészet vízbontásra használjuk. A
fényelem átlagos hatásfoka 10–15%, az elektrolízis rendszer
hatásfoka 65%, tehát a rendszer összhatásfoka kb. 6–7%. Az
elektrolízishez platina elektródák a legkedvezőbbek, az eljárás
nagyon költséges (Barber et al., 2013).
Jelentős feladat az anyagtudomány számára szívós,
nem mérgező, gyakori előfordulású, kémiai körülmények között
(például a PS II-ben a Water Oxidizing Centre – WOC, más jelölés
szerint – OEC) tartósan üzemeltethető elektródához, illetve
katalizátorhoz alkalmas anyagot találni (Chandler, 2010).
Mesterséges fotoszintézis
A természetes fotoszintézis első lépése magában foglalja a napfény
abszorpcióját és a vízbontással létrejött különálló töltéspárok
létrejöttét. A „vezeték nélküli” áram, a fotorendszer II (PS II)
oxigénfejlesztő komplexe (OEC) által a vizet oxidálva oxigén
keletkezik. Az OEC melléktermékeként keletkező elektronok és
protonok a fotorendszer I ferrodoxinjai által befogódnak. A redukáló
ferrodoxin-NADP segítségével a NADPH keretében hidrogén fejlődik. A
„mesterséges levél” napenergia-átalakítás feladatát szintetikus
anyag végzi. A fényelnyelő anyag a napfotont elnyeli, és
katalizátorereje „vezeték nélküli” áramot hoz létre. Kedvező
feltételek esetén (1 sun, 100 mW/cm2 megvilágítás alatt)
ez a négy elektron/lyuk, a vízbontás általi tüzelőanyag-fejlesztés
reakciójának hajtóereje (Reece et al., 2011; Chandler, 2011; Van
Noorden 2012).
Az MIT professzora, Daniel Nocera figyelemre méltó
fejlesztéseinek eredményeit „mesterséges levélnek” nevezte el. A
valóságos levélhez hasonlóan a napenergiát felhasználva kémiai
eljárással vízet bont, amivel tárolható energiaforráshoz (például
hidrogén) jut. A „kapcsolat nélküli” vízbontáshoz szilikonalapú
félvezetőt és gyakori előforudlású anyagból készített katalizátort
használ. A „mesterséges levél” – szilikon napelem, amely külső
vezeték nélkül kapcsolódik különböző katalizáló anyagokkal.
Egyszerűen vízbe helyezve napsütés hatására buborékolás indul meg:
egyik oldalon oxigén, a másik oldalon hidrogén szabadul fel. A
víztartálynál a két oldalt el kell választani, hogy az oxigén és a
hidrogén külön tárolása megoldható legyen. A nyert anyagok
felhasználásához igény szerint kellenek további berendezések,
például villamosáram-fejlesztő energiacella, hőfejlesztéshez
tüzelőberendezés, motorhajtáshoz töltőállomás stb.
Daniel Nocera, az MIT professzora több
publikációban ismerteti az általa elért eredményt. Csoportjával
olcsón és könnyen elérhető anyagokkal megvalósítható olyan módszert
talált, amelynél a villamossággal, hatékony katalízis útján tudja
elvégezni a vízmolekulák bontását. Célja például az épületeknél
saját, független energiaforrás biztosítása. Itt valójában
nemcsak a nap-, hanem a szélenergia is szóba jöhet
természeti energiaforrásként. Az időjárástól függő természeti
energiaforrása oxigént fejleszt, és ezt egy tárolóban összegyűjtve
szükség szerint lehet felhasználni (Nocera, 2012).
A mesterséges levél a fotoszintézis három elemét
kell tartalmazza. Befogás (foton) – konverzió (vezető nélküli áram)
– tárolás (H2 és O2). (4.
ábra)
A vízben, semleges, illetve közel semleges
körülmények között az oxigénfejlesztés reakciójának végbemeteléhez a
mesterséges levél számos feltételnek kell, hogy megfeleljen. A
NiMoZn-ötvözetet Pt-lemezen kell elhelyezni, hogy hidrogén
fejlődjék. A szilikon felületét a vízben való stabilizálásához
vezető fémoxiddal kell bevonni, amire a Co-OEC megfelelő. A hármas
csomópont létrejön a vízben elhelyezett Co-OEC- és a
NiMoZn-bevonatos Si-„ostya” révén, ami napfény hatására a
napenergiát közvetlenül vízbontásra használja fel. A konstrukció
egyszerű.
A kutatások iránya tehát az elektrokatalizálás
összekötése a fénnyel való töltésszétválasztás rendszerével. Az
anyagtudomány nagy kihívása a sugárzás felhasználása a
multielektron-kémiában. Vízbontásra az egyik lehetőség egyszerű
fotokatalizátorként félvezetőt használni, és a folyamatban hidrogén
nyerhető. A hidrogén közvetlen használható tüzelőanyagként, de
felhasználható a CO2 redukálására vagy nagyobb
molekulasúlyú szénvegyületek előállításához.
Az első kísérletekben a vízbontásra használt TiO2-fotoanódok
óta számos félvezetőt vizsgáltak (fémoxidok: Cu2O, TiO0,
Fe2O3, WO3, BiVO4),
(fémszulfidok: CdS, CdZnS) és például az ásványok közül a kalkopirit
(CuFeS) felhasználásával (CuInS, CuGaS).
A széles sávú (nagyobb, mint 3eV) félvezetők, TiO2
és g-C3N4 általánosan alkalmasak vízbontásra.
A keskeny sávú anyagoknak a látható fény abszorpciója nagyon kedvező
Fe2O3 (2,2 eV) és Cu2O (2,0–2,2 eV)
(Walter, 2010).
A vízbontás katalizátorainál a figyelem elsősorban
a könnyen elérhető elemek felé fordult, mint például az Mn, Co, Fe.
A kobaltoxid-foszfát (CoPi) semleges pH-közegben 400 mV felett
megoldás. Nagyon fontos tulajdonsága a megújuló képesség.
Például Co3O4-nanoszemcséket
pórusos g-C3N4-anyaggal összekötve nagyon
hatékony Co3O4/g-C3N4-fotokatalizátort
állítottak elő. A szemcsék kötödése azonban nem mutatkozott elég
erősnek. A kobaltoxid-alapú katalizátorokkal elért sikerek ellenére
problémás, hogy a félvezető felülettel való kapcsolódás nem elég
tartós. Előfordulhat, hogy a katalizátor is leválik a folyamat
során.
A működés közben megújuló rendszer az ideális,
Nocera CoPi OEC- (oxygen evolving complex) katalizátora ilyen
(Nocera, 2008).
A rendszerfejlesztés kiterjed a mesterséges levél
minden elemére. Első tagja napelem, amely a
terheléstől függően villamosenergiát szolgáltat, és a felesleget
vezeti el a katalizátorral való vízbontáshoz. A hidrogén igény
szerint felhasználható. Az elektrolízishez két különböző elektróda
szükséges. Az egyiken oxigénatom, a másikon hidrogénatom szabadul
fel (5. ábra) (Reece et al., 2011).
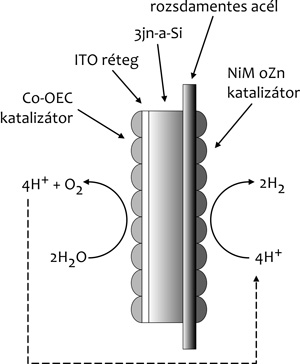
5. ábra • A mesterséges levél elvi megoldása
Ennél a rendszernél az oxigén kezelése a
bonyolultabb feladat. Nocera 2008-ban ismertette az
oxigénfejlesztéshez megfelelő, olcsó elektróda anyagot, amelynek
alapösszetevője az elemi kobalt.
A mesterséges fotoszintézissel előállított „nap tüzelőanyag” előnyei
és hátrányai:
Előnyök:
• megoldja a napenergia-tárolást. A napenergiát
tárolható kémiai energiává alakítja;
• a keletkezett melléktermék környezetbarát.
Hátrányok:
• a mesterséges fotoszintézishez használt anyagok a
vízben korrodálódnak, nem eléggé stabilak. A legtöbb
hidrogénkatalizátor nagyon érzékeny az oxigénnel szemben. A
mesterséges fotoszintetikus cella hátrányai között fontos
megemlíteni, hogy a töltésszétválást biztosító anyagnak a kialakuló
oxidáló-redukáló körülmények között elegendően stabilnak kell
maradnia. Miért is nem használunk klorofillt a mesterséges
cellákban? Végtelen mennyiségben a rendelkezésünkre állna, azonban
mind a gerjesztése során kialakuló triplett állapota, mind az erősen
oxidáló kation gyökforma károsíthatja a környező molekulákat vagy
akár magát a klorofill molekulát. Ettől a klorofillt a természetben
a fotoszintézis folyamatok biológiai szabályozottsága védi meg,
ennek lemásolása, illetve hasonló folyamatokban a
pigmenthelyettesítő anyag megvédése a fotodinámiás károsodástól
azonban jelentős kihívás a mérnökök számára.
• a jelenleg használt tüzelőanyagokkal
összehasonlítva a költségek lényegesen magasabbak
Kulcsszavak: energetika, fotoszintézis, mesterséges levél
IRODALOM
Barber, James – Tran, Phong D. (2013):
From Natural to Artificial Photosynthesis. Journal of the
Royal Society Interface. 10, 20120984
Chandler, David L. (2011): Artificial
Leaf” Makes Fuel from Sunlight MIT News Office, 29. 11. 2011
Chandler, David L. (2010): New
Water-splitting Catalyst Found. MIT News Office, 13. 05. 2010
Lutterman, D. A. – Surendranath, Y. –
Nocera, D.G. (2009): ASelf-healing Oxygen-evolving Catalyst. Journal
of the American Chemical Society. 131, 3838–3839. • DOI:
10.1021/ja900023k
Nocera, Daniel G. (2012): The Artificial
Leaf. Accounts of Chemical Research. 45, 5, 767–776.
Nocera, Daniel G. (2008): Artificial
Photosynthesis for the Large Scale Deployment of Personalized Solar
Energy. •
WEBCÍM
Nyitrai Miklós (tantárgyfelelős) (2012):
Biofizika 1. A kvantumelmélet kísérletes háttere. Pécsi
Tudományegyetem ÁOK Biofizikai Intézet, Pécs biofizika.aok.•
pte.hu/tantargyak/files/.../biofizika1_2012-2013_19.pdf
Ördög Vince – Molnár Zoltán (2011):
Növényélettan. 3. fej. Növényi biokémia, szerves anyagtermelés a
növényben TÁMOP-4.1.2-08/1/A-2009-0010 projekt. Debreceni
Egyetem–Nyugat-Magyarországi Egyetem–Pannon Egyetem
Pethő Menyhért (1998): A növényélettan
alapjai. Akadémiai, Budapest •
WEBCÍM
Reece, Steven Y. – Hamel, J. A. – Sung,
K. – Jarvi, T. D. – Esswein, A. J. – Pijpers, J. J. H. – Nocera, D.
G. (2011): Wireless Solar Water Splitting Using Silicon-based
Semiconductors and Earth-abundant Catalysts. Science. 4 November,
645–648
Science Daily (2012): Secrets of the First
Practical Artificial Leaf. •
WEBCÍM
Sun, Licheng – Hammarström, L. – Åkermark,
B. – Styring, S. (2001): Towards Artificial Photosynthesis:
Ruthenium-Manganese Chemistry for Energy Production.
Chemical Society Reviews. 30, 36-49.
Van Noorden, Richard (2012): Artificial
Leaf’ Faces Economic Hurdle. Nature (News). 23 May 2012. Corrected:
31 May 2012 •
WEBCÍM
Walter, Michael G. – Warren, E. L. –
McKone, J. R. – Boettcher, S. W. – Qixi, M. – Santori, E. A. –
Lewis, N. S. (2010): Solar Water Splitting Cells. Chemical Reviews.
110, 6446–6473. authors.library.caltech.edu/.../Walter2010p12136Ch
URL1: Solar-H nemzetközi konzorcium: •
WEBCÍM
|