|
játszik szerepet. Kísérletes körülmények között az
irisin nannomoláris (10-19 mol) szintjei
fehérzsírszövet-tenyészetben megnövelik a hőtermelést, és fokozzák a
sejtlégzést. Élettani feltételek mellett az irisin növeli az
energiafelhasználást egérben, míg a mozgás és a táplálékfelvétel nem
változik. Ez a folyamat csökkenti az elhízást, és javítja a
glukóz-homeosztázist.
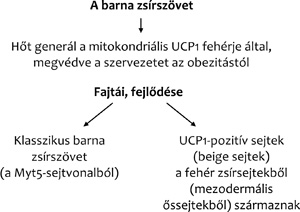
A barna zsírszövet
A barna zsírszövet (brown adipose tissue – BAT) funkciója a
táplálékból származó kémiai energia hővé alakítása a mitokondriális
(mitokondrium: „sejtszervecske” a sejt plazmájában) UCP-1
(uncoupling protein – szétkapcsoló fehérje) által hideghatás vagy
excesszív táplálékfelvétel esetén, és ez által szabályozza az
energiaegyensúlyt. Ez a folyamat az adaptív termogenezis, mely a
tárolás és a hőtermelés „szétkapcsolásával” megvédi a szervezetet a
hipotermiától és elhízástól.
Klasszikus ismereteink szerint a barna zsírszövet
főként újszülöttekben és csecsemőkben fordul elő, felnőttben csak
kis mennyiségben van jelen. A barna zsírszövetet felnőtt emberben
onkológusok fedezték fel „újra” néhány évvel ezelőtt, amikor PET-
(pozitron emissziós tomográfia – egy újabb képalkotó diagnosztikus
eljárás) vizsgálattal metasztázisokat (daganatos áttétek) kerestek.
Felfigyeltek arra, hogy a metasztázisok kimutatására használt
radioaktív glukóz gyakran alkotott gyűrű alakú „forró helyeket” (hot
spots), melyek glukózfelvételre utaltak. Ezek a foltok
szimmetrikusan a kulcscsont feletti árkokban helyezkedtek el, és nem
metasztázisok, hanem BAT-depozitumok voltak. A BAT beidegzése egy
önszabályozó hurok (feed back) útján valósul meg, mely kapcsolatot
teremt a BAT és a hipotalamusz paraventrikuláris magvai között, a
szimpatikus idegrendszer közvetítésével. Ez a visszacsatolási pálya
a BAT termogén aktivitásának alapja.
Kristin I. Stanford azt vizsgálta, vajon a BAT-nak
meghatározó szerepe van-e a glukóz-homeosztázis szabályozásában.
BAT-ot transzplantáltak hím donoregerekből azonos korú és nemű,
HFD-vel táplált egerek hasüregébe. A kontrollcsoportokkal
összehasonlítva, az átültetést követő nyolc-tizenkét hét után a
recipiensek glukóztoleranciája javult, inzulinérzékenységük megnőtt,
testsúlyuk és zsírtömegük csökkent, a magas zsírtartalmú étrend
okozta inzulinrezisztencia megszűnt. Ha a BAT-ot IL-6 gén knock-out
( „kiütés”, eltávolítás) egerekből transzplantálták, a kedvező
hatások nem mutatkoztak, azaz a BAT-ból származó IL-6-nak alapvető
szerepe van a transzplantációnak a glukózanyagcserére és
inzulinérzékenységre gyakorolt kedvező hatásaiban.
3. ábra
Ezek az eredmények azt bizonyítják, hogy a BAT
szerepét a glukózanyagcserében eddig alulértékeltük (Stanford et
al., 2013).
A barna és a fehér zsírsejtek fejlődési vonalai
A barna adipociták ugyanabból a prekurzorból (őssejt) származnak,
mint az izomsejtek. Ezeket dermomiotomoknak nevezik melyek Myf-5
(myogenic factor 5)-öt expresszálnak. A dermomiotomok részben
izomsejtekké (miociták), részben zsírsejtekké (adipociták)
differenciálódnak. Egy transkripciós faktor, a PRDM16 (PR domain
conaining factor-16) szerepe a BAT differenciálódásában egyértelműen
bizonyított. Ezzel szemben a fehér zsírsejtek egy másik prekurzorból
származnak, ami feltehetően egy mezodermális (kötőszöveti) őssejt,
és amelyből hiányzik a Myf-5.
A „bézs” zsírszövet, a „barnásítás” folyamata
Újabb adatok szerint a BAT-nak két elkülönülő típusa van: a
klasszikus BAT, mely a Myf-5 celluláris vonalból származik, és azok
az UCP1 pozitív sejtek, melyek a fehér zsírszövetben termelődnek egy
non-Myf5 sejtvonalból. Marta Giralt és Francesc Villarroya
beszámolnak az egér fehér zsírszövetéből származó izolált „beige”
sejtcsoportról. Ez a legújabban leírt új adipocita típus
expresszálja a UCP-1-et, és sokkal inkább metabolizálja, semmint
raktározza a zsírokat (Giralt – Villarroya, 2013). Tekintettel arra,
hogy ez a sejt morfológiailag és funkcionálisan is a barna
zsírsejthez hasonló, de prekurzora (előállapota) a fehér
zsírsejtekével azonos, „brite”-nak (brown in white), alternatív
néven bézsnek is nevezik. A névnél fontosabb, hogy ez a sejttípus
fontos szerepet játszik az energiaegyensúlyban, a zsír- és
cukoranyagcserében. A beige sejtek génexpressziós sajátosságaikat
tekintve különböznek mind a fehér, mind a klasszikus barna
zsírsejtektől, és kifejezetten érzékenyen reagálnak az irisin hormon
hatására. Felnőtt emberben a korábban barna zsírszövetként
azonosított zsír „beige” adipocitákból áll.
Bruce M. Spiegelman vizsgálatai szerint minden
ember rendelkezik barna zsírszövettel, mely sokkal inkább hasonlít
(vagy azonos) a rágcsálók bézs zsírszövetére, mint a klasszikus
barna zsírszövetre. Ezért, ha az emberi zsírszövet
hormonérzékenységét és bioenergetikáját szeretnénk tanulmányozni,
célszerű a rágcsálók bézs zsírszövetét modellként használni
(Spiegelman, 2013).
Feltételezhető, hogy főként az exercise
eredményezte irisin-termelés a felelős a fehér zsírszövet
„barnásításáért”, valamint a kedvező anyagcsere-változásokért. Az
irisin lehetséges terápiás opció emberi metabolikus betegségekben és
egyéb elváltozásokban, melyek exercise hatására javulnak.
Következtetések
1. Napjainkban bizonyos, monofunkciósnak hitt szerveink egyre
komplexebb működését ismerjük meg. Így a hasi zsírszövetet kizárólag
raktárként tartottuk számon, de kiderült, hogy benne számos olyan
hormontermészetű anyag termelődik, melyek többsége részt vesz az
alacsony fokozatú gyulladásos folyamatban, befolyásolva az
organizmus számos életfontos funkcióját.
Az erek belfelületét „kibélelő” endotél hártyának
sokáig csak az ereket védő, „bélés” szerepet tulajdonítottak, mára
kiderült, hogy az endotélben olyan anyagok termelődnek, melyek az
erek tágasságát, a véralvadást és számos egyéb biológiai hatást is
közvetítenek.
Változott a felfogás az eddig statikusnak,
„állandónak” tartott csontrendszerről, felépítése, lebontása
bonyolult hormonhatások következménye (pajzsmirigy,
mellékpajzsmirigy, ösztrogén stb.).
A bélrendszerben jelenlevő baktériumok egy részéről
kiderült, hogy hatásukra rövid szénláncú zsírsavak képződnek, melyek
csökkentik az inzulinrezisztenciát, előnyösen befolyásolják a
szénhidrát-anyagcserét.
2. A szervezet legnagyobb kiterjedésű. energiát
felhasználó szerve a vázizomzat. A testedzésnek, az izommunkának
jótékony hatása az energiaegyensúlyra, az anyagcserére, az elhízás
megelőzésére régóta ismert, de pontosabb mechanizmusa csak az utóbbi
időben kezdett tisztázódni. Kiderült, hogy az izomzat
nagykiterjedésű endokrin szerv, mely összehúzódásai során
hormonhatású peptideket termel, juttat a keringésbe, és ez által
kapcsolatot teremt más, anyagcserével és energiaforgalommal
kapcsolatos szisztémákkal (zsírszövet, máj, agy, ß-sejtek),
előnyösen befolyásolja a glukóz-homeosztázist és az
inzulinérzékenységet.
3. Az ismertetett, többnyire kísérleti stádiumban
lévő kutatások főként három területen látszanak ígéretesnek. Ezek a
területek:
a.) A barna zsírszövet terápiás alkalmazása
obezitásban, metabolikus szindrómában és T2DM-ben, ami a felesleges
kalóriák hőtermelés útján való eliminálásán alapszik. Az elhízás
kezelésében eddig alkalmazott terápiás stratégiák nem bizonyultak
hatásosnak, mivel az emberi szervezet veleszületetten rezisztens a
testsúlyvesztéssel szemben. A korábbi terápiás próbálkozások, melyek
a szimpatikus idegrendszer stimulálásán alapultak, ártalmas
mellékhatásokkal jártak, mert nem voltak szervspecifikusak. Az
emberi BAT aktivációja megnöveli az energiafelhasználást, és
elősegíti a testsúlyvesztést, javul a lipid- és glukózhomeosztázis.
Bár a BAT által végbemenő termogenezis szoros centrális szimpatikus
idegi kontroll alatt áll, jobb kezelési eredményhez vezet, mert
specifikusan serkenti a BAT-ot, ami elhízottakban súlyvesztést
eredményez.
b.) Az egyik újonnan felfedezett miokin, az irisin
a fehér zsírszövetben jelenlévő bézs precursor zsírsejtekben
„barnásítást” indít meg, és az így létrejött bézs zsírszövet a
továbbiakban a BAT előnyös anyagcsere-hatásaival rendelkezik, így az
irisin perspektivikusan terápiás opció lehet az ún.
inaktivitás-betegségekben.
c.) A miosztatin szerepe ellentmondásos, nem
világos, hogy az izomzat miért expresszál magára az izomzatra és az
anyagcserére is káros anyagot, ugyanakkor a miosztatin gátlása
terápiásan felhasználható lehet.
4. Mindezek a kutatási eredmények további
tisztázásra várnak, kérdés, hogy mi derül ki a további sok száz
miokin (IL-6, IL-8, IL-15, follisztatin stb.) szerepéről, és hogy a
kísérleti eredmények miként vonatkoztathatóak emberre. Az azonban
biztos, hogy az exercise szerepéről máris sokkal többet tudunk, és
hogy az inaktivitási betegségek kezelésében az izomtevékenységnek
tudományosan megalapozottan is fontos szerepe van. Még nem
tudhatjuk, hogy a jövőben a fentiek értelmében miből lesz gyógyszer
és miből nem, de az biztos, hogy a testmozgás lehetősége prevenció
és gyógyulás céljából mindenkinek rendelkezésére áll. Az új
összefüggések üzenete egy mondatba sűrítve: a rendszeres testmozgás
növeli az élettartamot és jobbítja az életminőséget, csökkenti az
elhízás, metabolikus betegségek, kardiovaszkuláris szövődmények
előfordulási gyakoriságát, ezért mozogni kell! (Halmos – Suba, 2014)
Kulcsszavak: inaktivitási betegségek, izomösszehúzódás,
inzulinrezisztencia, miokinek, irisin, miosztatin, bézs zsírszövet,
barnásítás
IRODALOM
Boström, Pontus – Wu J. – Jedrychowski M.
P. et al. (2012): A PGC1α-dependent Myokine That Drives
Brown-fat-like Development of White Fat Aand Thermogenesis. Nature.
481, 7382, 463–468. DOI: 10.1038/nature10777 •
WEBCÍM
Breitbart, Astrid – Messier, M. A. –
Molkentin, D. J. et al. (2011): Myostatin from the Heart: Local and
Systemic Actions in Cardiac Failure and Muscle Wasting. American
Journal of Physiology. Heart and Circulatory Physiology. 300,
H1937–1982. DOI: 10.1152/ajpheart.00200.2011 •
WEBCÍM
Giralt, Marta – Villarroya, Francesc
(2013): White, Brown, Beige/Brite: Different Adipose Cells for
Different Functions? Endocrinology. 154, 9, 2992–3000.
DOI: 10.1210/en.2013-1403 •
WEBCÍM
Guo, Tingqing – Jou, W. – Chanturiya, T.
et al. (2009): Myostatin Inhibition in Muscle, but Not Adipose
Tissue, Decreases Fat Mass and Improves Insulin Sensitivity. PLOS
One. 4, 3, e4937. DOI: 10.1371/journal.pone.0004937 •
WEBCÍM
Halmos Tamás – Suba Ilona (2014): A
vázizomzat szekretoros működésének szerepe az anyagcserében és az
energiaforgalomban. Orvosi Hetilap. 155, 37, 1469–1477. DOI:
10.1556/OH.2014.29959
Handschin, Christoph – Spiegelman, Bruce
M. (2008): The Role of Exercise and PGC1[alpha] in Inflammation and
Chronic Disease. Nature. 454, 463–469. DOI: 10.1038/nature07206 •
WEBCÍM
Huh, Joo Young – Panagiotou, G. – Mougios,
V. et al. (2012): FNDC5 and Irisin in Humans: I. Predictors of
Circulating Concentrations in Serum and Plasma and II. mRNA
Expression and Circulating Concentrations in Response to Weight Loss
and Exercise. Metabolism. 61, 12, 1725–1738. DOI: 10.1016/j.meta
bol.2012.09.002 •
WEBCÍM
Keller, Charlotte – Steensberg, A. –
Hansen, A. K. et al. (2005): The Effect of Exercise, Training,
Glycogen Availability on IL-6 Receptor Expression in Human Skeletal
Muscle. Journal of Applied Physiology. 99, 2075–2079.
DOI: 10.1152/japplphysiol.00590.2005 •
WEBCÍM
Pedersen, Bente Klarlund (2011): Muscles
and Their Myokines. Journal of Experimental Biology. 214, 337–346.
DOI: 10.1242/jeb.048074 •
WEBCÍM
Pedersen, Bente K. – Febbraio, Mark A.
(2012): Muscles, Exercise and Obesity: Skeletal Muscle as a
Secretory Organ. Nature Reviews Endocrinology. 3; 8, 8, 457–465.
DOI:10.1038/nrendo.2012.49
Pischon, Tobias – Boeing, H. – Hoffmann,
K. et al. (2008): General and Abdominal Adiposity and Risk of Death
in Europe. The New England Journal of Medicine. 359, 2105–2120. DOI:
10.1056/NEJMoa 0801891 •
WEBCÍM
Spiegelman, Bruce M. (2013): Banting
Lecture 2012: Regulation of Adipogenesis: Toward New Therapeutics
for Metabolic Disease. Diabetes. 62, 6, 1774–1782.
DOI: 10.2337/db12-1665 •
WEBCÍM
Stanford, Kristin I. – Middelbeek, R. J. –
Townsend, K. L. et al. (2013): Brown Adipose Tissue Regulates
Glucose Homeostasis and Insulin Sensitivity. The Journal
of Clinical Investigation. 123, 1, 215–223. DOI:10.1172/JCI62308 •
WEBCÍM
You, Tongjian – Arsenis, N. C. – Disanzo,
B. L. et al. (2013): Effects of Exercise Training on Chronic
Inflammation in Obesity: Current Evidence and Potential Mechanisms.
Sports Medicine. 43, 4, 243–256. DOI: 10.1007/s40279-013-0023-3
|