|
|
A sugárvédelmi szabályozás alapfeltevése,
és a kis dózisok kockázatának jelentősége mindennapi életünkben
A sugárvédelmi szabályozás egyik alapvető kérdése, hogy a különböző
mértékű sugárterhelések milyen egészségkárosodást okoznak. A
szabályozás szempontjából az egészségkárosodások közül is elsősorban
azoknak az úgynevezett sztochasztikus hatásoknak a dózisfüggése
érdekes, amelyek nem szükségszerű következményei a besugárzásnak. E
hatások közül legfontosabbak a különböző daganatos megbetegedések.
Ezek kialakulásának dózisfüggéséről elsősorban azok
a felmérések nyújtanak információt, amelyek egy sugárterhelésnek
kitett nagyobb embercsoportban határozták meg e betegségek, illetve
az ezekből fakadó halálozások gyakoriságát, amelyet azután össze
lehetett hasonlítani a sugárzásnak ki nem tett populációra vonatkozó
gyakoriságokkal. E felmérések közül a legjelentősebb a Nagaszakira
és Hirosimára ledobott atombombák túlélőinek vizsgálata, amely
alapján azt állapították meg, hogy a sugárterhelés függvényében a
rákkockázat lineárisan nő.
Lényeges azonban, hogy ez a lineáris összefüggés
viszonylag nagy dózisoknál tekinthető csak pontosnak. A dózis
csökkenésével ugyanis az egyéb környezeti tényezők hatása egyre
jelentősebbé válik. Ráadásul a vizsgált populáció mérete elvi
minimumot határoz meg a kimutatható kockázat mértékére vonatkozóan,
amelynél kisebb kockázat az adott egyedszám mellett akkor sem lenne
mérhető, ha az egyéb környezeti tényezők hatását teljes mértékben ki
tudnánk szűrni. Így, miközben örömmel vennénk, ha valaki egy adott
felmérés révén bebizonyítaná, hogy vannak olyan kicsiny
sugárterhelések, amelyeknek nincsen kockázatuk, ez elvi
megfontolások alapján is lehetetlen. Nincsen tehát olyan felmérés,
amely meggyőző lenne abban a tekintetben, hogy a kockázat kis
dózisoknál is arányos a sugárterheléssel. Emiatt a sugárvédelem
alapjául szolgáló LNT-hipotézis, (LNT – linear non-threshold;
lineáris, küszöb nélküli) amely szerint a kockázat a dózis
függvényében lineárisan nő, és az origón halad át, azaz nincsen
olyan kicsiny dózis, amely ne növelné a rákkockázatot, valóban
feltételezés, nincsen rá bizonyíték.
Azt azonban szem előtt kell tartani, hogy miután a
dózis-hatás összefüggésre sugárvédelmi szabályozás épül, ezért
valamilyen kapcsolatot szükséges feltételezni a sugárterhelés és a
kockázat között. Másképp fogalmazva, az nem lehetőség, hogy anélkül
vessük el az LNT-modellt, hogy egy másik dózis-hatás összefüggést
állítanánk a helyére. Ugyanakkor annak, hogy milyen dózis-hatás
összefüggést feltételezünk, komoly gyakorlati következményei vannak.
Közismert tény, hogy a dohányzás tüdőrákot okoz,
amely annál valószínűbben gyógyítható, minél korábban észlelik a
daganatot. Az észlelés valószínűségét növeli a
mellkasröntgen-vizsgálat, amely viszonylag csekély sugárterheléssel
jár, ám valamilyen mértékben növelheti a tüdőrák kialakulásának
kockázatát. Ha a kockázat nulla lenne, akkor a rendszeresen
dohányzók számára célszerű lenne minél gyakrabban
mellkasröntgen-vizsgálatokon részt venni. Ha azonban a
röntgenvizsgálat nagy kockázatot jelentene, esetleg nagyobbat, mint
amennyivel a korai észlelés növeli a gyógyulás valószínűségét, akkor
a dohányzóknak nem lenne célszerű részt venniük egyetlen
röntgenvizsgálaton sem. A vizsgálat kockázata alighanem valahol e
két véglet között van. Ha a nagyságát pontosan ismernénk, meg
tudnánk becsülni, hogy milyen gyakran kellene röntgenvizsgálatra
járni.
Kis dózisok kísérleti vizsgálata
és az ebből való kockázatbecslés
alapvető nehézségei
A fenti példa is szemlélteti, hogy a dózis-hatás összefüggés
megismerésének fontos következményei lehetnek. Korábban láttuk azt
is, hogy a besugárzott emberi populációkból való következtetés több
ok miatt is korlátokba ütközik. E korlátok miatt más eszközökhöz,
pontosabban más kísérleti alanyokhoz, más élő rendszerekhez vagyunk
kénytelenek fordulni, ha szeretnénk a kis dózisok hatását megérteni
és egészségi kockázatukat megbecsülni. Az egyik lehetőséget az
állatkísérletek jelentik, amelyek azt a problémát vetik fel, hogy az
ott megfigyelt jelenségek és még inkább az ott mért dózis-hatás
összefüggések hogyan alkalmazhatóak emberekre. Még ha a jelenségek
egy megfelelően választott állatfajnál hasonlóak is, a
szervezetszintű dózis-hatás összefüggések alighanem különbözőek a
különböző fajoknál.
Egy másik kísérleti rendszert jelentenek az
emberből elkülönített sejtek, esetleg szövetek, amelyek azt a
kihívást állítják elénk, hogy a különböző szerveződési szinteken
megfigyelhető jelenségek között találjunk kapcsolatot. Miután a
különböző szerveződési szintek egymásra épülnek, legalább elviekben
remélhetjük, hogy ezek az összefüggések léteznek, még ha nem is
nyilvánvalóak.
Az említett módszerekkel számos olyan jelenséget
sikerült megfigyelni, amelyek azt mutatják, hogy az adott kísérleti
rendszerben a dózis-hatás összefüggések nem lineárisak a kis dózis
tartományban. Ezek az eredmények azt sugallják, hogy a kockázat
dózisfüggése sem lineáris. Azt azonban nem szabad elfelejteni, hogy
miután a kísérleti rendszer nem azonos azzal a rendszerrel, amelyre
vonatkozóan meg szeretnénk határozni a kockázati görbét, a
sugallásnál erősebb kifejezést nem használhatunk. A kérdés tehát az,
hogy ezek a jelenségek hogyan mutatkozhatnak meg a szervezet
szintjén. Mielőtt megnéznénk erre egy példát, ismerjünk meg néhány
jelenséget, amelyek a kis dózisokra jellemzőek!
Kísérleti jelenségek, amelyek a kockázat nemlineáris
dózisfüggését sugallják
Az ionizáló sugárzás kölcsönhatásba léphet a sejtek
örökítőanyagával, esetünkben a DNS-sel. Ennek következtében a
DNS-ben szerkezeti változások következnek be, sérülések keletkeznek.
Nem kevés fehérje felel azért, hogy a DNS szerkezetét helyreállítsa,
azonban ez esetenként azzal jár, hogy a DNS információtartalma
megváltozik, azaz mutáció keletkezik. Miután a keletkező
DNS-sérülések száma arányos a sugárterheléssel, továbbá
feltételezhető, hogy a mutációk száma arányos a sérülések számával,
a rákkockázat pedig a mutációk számával, belátható, hogy ha a
DNS-sérülésekkel hozzuk kapcsolatba a kockázat növekedését, akkor
könnyen eljutunk az LNT-modellhez. A fent említett
kisdózis-jelenségeket azonban éppen az jellemzi, hogy kiváltásukhoz
nincs szükség arra, hogy az ionizáló sugárzás a sejtmaggal
kölcsönhatásba lépjen, és DNS-sérüléseket okozzon.
Vannak olyan jelenségek is, amelyek azt sejtetik,
hogy a kis dózisok kockázatosabbak, mint amit a sugárvédelmi
szabályozás feltételez. Az egyik ilyen jelenség lényege az, hogy
sugárválaszt figyelhetünk meg olyan sejtekben, amelyek nem léptek
kölcsönhatásba ionizáló sugárzással, csak olyan sejtekkel, amelyek
kölcsönhatásba léptek ionizáló sugárzással. Ezt a jelenséget
szomszédhatásnak nevezzük, hiszen a besugárzott sejtek szomszédaiban
figyelhető meg. A szomszédsejtek sugárválasza persze hasonlóan
összetett, mint az eltalált sejteké, így a bekövetkező változás e
komplex válasz több elemében is mérhető, például a DNS-sérülések
megjelenésében is. Ezek száma azonban jelentősen elmarad attól, ami
a közvetlenül eltalált sejteket jellemzi. Részben emiatt a
szomszédhatás jelentősége a dózis növekedésével csökken. Ha a
sugárterhelés növekedése miatt már minden sejt kölcsönhatásba lép az
ionizáló sugárzással, a szomszédhatás jelentősége elhanyagolhatóvá
válik. Ebből adódik, hogy a szomszédhatás kísérleti megfigyelése azt
sugallja, hogy kis dózisoknál a kockázat meredekebben növekszik
annál, amit az atombombák túlélőinek felmérése nagy dózisoknál mutat
(1. ábra 1. szaggatott vonal).
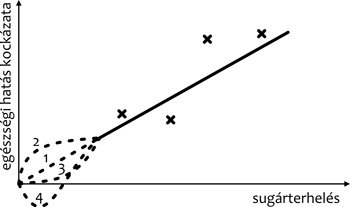
1. ábra • Az LNT-modell és esetleges
alternatívái. A keresztek besugárzott populációkban megfigyelt
gyakoriságokat szimbolizálnak, amelyek azt mutatják, hogy a kockázat
dózisfüggése lineáris (folytonos vonal). A sugárvédelmi szabályozás
ennek a kiterjesztését alkalmazza kis dózisoknál is (1. szaggatott
vonal). Egyes jelenségek (például szomszédhatás, genomikai
instabilitás) ennél nagyobb kockázatot sugallnak (2. szaggatott
vonal), míg más jelenségek (például adaptív válaszok) ennél kisebbet
(3. szaggatott vonal), akár olyat, amely a negatív tartományban is
megfordul
(4. szaggatott vonal). Utóbbi már a kis dózisok
kockázatcsökkentő hatását jelentené.
A szomszédhatás a sugárválasz besugárzástól térben
távol megjelenő formájának tekinthető. Ugyanakkor a besugárzás és a
hatás megjelenése nemcsak térben, hanem időben is elkülönülhet.
Ennek példája a sugárzás által indukált genomikai instabilitás is,
amely azt jelenti, hogy a besugárzott sejt utódaiban a mutációk
keletkezési gyakorisága, azaz az egységnyi idő alatt újonnan
keletkező mutációk száma jelentősen nagyobb a be nem sugárzott sejt
utódaihoz képest. Ez is egy olyan jelenség, amely azt sugallja, hogy
a kis dózisok kockázata nagyobb lehet annál, mint amit a nagy
dózisoknál megfigyelt rákgyakoriságok alapján várnánk (1. ábra
2. szaggatott vonal).
Ugyanakkor vannak olyan jelenségek is, amelyek
inkább azt sejtetik, hogy a kis dózisok kevésbé kockázatosak, mint
amit a sugárvédelmi szabályozás feltételez. Ezek közé tartoznak az
|
|
|
adaptív válaszok is. Sokféle kísérleti rendszerben
megfigyelhető, hogy ha egy nagyobb sugárterhelést megelőz egy
kisebb, akkor a káros hatás kisebb, mintha csak a nagy sugárterhelés
következett volna be. Ez azt jelenti, hogy a kis dózisok nyomán
csökken a későbbi besugárzások kockázata. Ez már önmagában azt
sugallja, hogy a kockázat a dózis függvényében lassabban nő, mint
amit a nagy dózisoknál megfigyelt rákgyakoriságok alapján várnánk (1.
ábra 3. szaggatott vonal). Ha azonban ehhez hozzávesszük azokat
az állatkísérleteket, amelyek azt mutatják, hogy a kis dózisú
besugárzások hatása akkor is pozitív, ha nincs később nagy dózisú
besugárzás, akkor az már azt is jelentheti, hogy a kis dózisok nem
csupán kevésbé növelik a kockázatot, mint várnánk, hanem egyenesen
csökkentik azt (1. ábra 4. szaggatott vonal).
Hiperszenzitivitás kis dózisoknál
és a kialakuló mutációk számának
minimalizálása
Egy másik, kis dózisoknál gyakran megfigyelt jelenség a
hiperszenzitivitás, melynek egyik megnyilvánulási formája, hogy az
osztódásra képes sejtek száma a sugárterhelés függvényében nem
monoton csökken, hanem van egy lokális minimum (~0,3 Gy-nél), amit
követően a dózis növekedésével nő az utódokat létrehozó sejtek
száma. Előfordul az is, hogy minimum nincsen, de a kis dózisoknál
(~0 és 0,3 Gy között) a túlélési görbe meredeksége jóval nagyobb,
mint a valamivel nagyobb dózisoknál (~0,3 és 1 Gy között). A
jelenség azért is érdekes, mert a túlélési görbe a hiperszenzitív
tartományon kívül (~1 Gy felett) jól leírható egy exponenciális
függvénnyel, melynek jellege a különféle sejteknél azonos, és a
különböző sugárfajtáktól való függése is jól ismert, továbbá
elméletileg is jól megalapozott. Emiatt az ettől való eltérés,
anomália még szembetűnőbb.
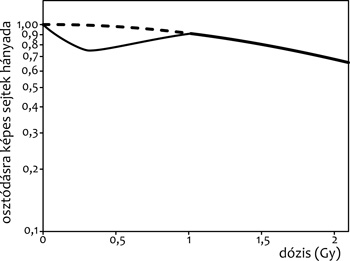
2. ábra • Hiperszenzitivitás kis dózisoknál.
Az osztódásra képes sejtek hányada a sugárterhelés
függvényében nem monoton csökken, hanem egy lokális minimum után a
dózis növekedésével nő az utódokat létrehozó sejtek száma. Nagy
dózisoknál (~1 Gy felett) a túlélési görbe jól leírható egy
exponenciális függvénnyel.
Ha a jelenséget önmagában nézzük, akkor az lehet az
érzésünk, hogy a kis dózisok kockázata nagyobb, mint amit a nagy
dózisoknál megfigyelt rákgyakoriság alapján várnánk, hiszen
egységnyi dózis hatása sokkal nagyobb a kis dózisoknál, mint a
valamivel nagyobbaknál. A kis dózisok nagy hatása azonban alapvetően
az adott kísérleti rendszerre igaz, a jelenség szerepe az egyéni
szintű rákkockázatban a korábbiakhoz hasonlóan egyáltalán nem
nyilvánvaló. Meg kellene vizsgálnunk, hogy a szerveződés felsőbb
szintjein milyen következményei vannak ennek a sejtszintű
jelenségnek. Miután azonban a szervezetszintű válasz nagyon távol
áll a sejtszintűtől, erre egyelőre nem vállalkozhatunk. Helyette
csak egy szerveződési szintet lépünk, és azt vizsgáljuk meg, hogy a
szövet vonatkozásában milyen következményei lehetnek a
hiperszenzitív sugárválasznak.
Az első gondolat, amit meg kell fontolnunk az, hogy
miközben a sejtpusztulás egy egysejtű élőlény esetén mindenképpen
káros hatásnak tekintendő, addig ez korántsem egyértelmű egy
többsejtű élőlényben. Sőt, a szervezetben gyakran éppen az okozza a
bajt, hogy egyes sejtek megpróbálják elkerülni a szabályozott
sejtpusztulást, és ehelyett a környező szövetre való tekintet nélkül
és korlátok nélkül folytatják az osztódást, aminek nyomán daganat
jelenik meg a szervezetben. Ebből a szemszögből nézve a megfelelő
sejtek pusztulása kimondottan előnyös lehet a többsejtű élőlény
számára.
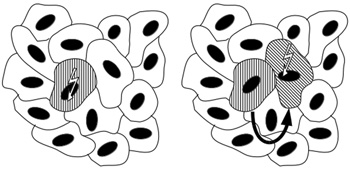
3. ábra • Hogyan okozhat az ionizáló
sugárzás mutációkat? A bal oldali ábrán a függőleges csíkozású sejt
kölcsönhatásba lép az ionizáló sugárzással, aminek nyomán
DNS-sérülések, majd mutációk keletkeznek benne. A jobb oldali ábrán
a ferdén csíkozott sejtet éri sugárzás, az elpusztul, de a mellette
álló függőleges csíkozású sejt emiatt osztódik, ami mutációkhoz
vezet (a nyíl jelzi a pótlást, aminek nyomán két függőleges
csíkozású sejt jelennék meg, de ezt nem ábrázoltuk).
Ugyanakkor fontos azt is látni, hogy ha
feltételezzük a sejtszám állandóságát a szövetben, akkor egy-egy
sejt pusztulása egy-egy többletosztódást is maga után von. Miután a
spontán mutációk többsége a sejtosztódás kapcsán keletkezik, így
közvetve a sejtek pusztulása is mutációkat eredményez. Bár az
ionizáló sugárzás mutagén voltát többnyire azzal magyarázzák, hogy a
sugárzás növeli a DNS-sérülések és ezen keresztül a mutációk számát
is, ha a sugárzás hatékonyan pusztít el sejteket, akkor a
sejtpusztulás miatti többletosztódásokon keresztül is hozzájárulhat
a mutációk számának növekedéséhez. Előttünk áll tehát két folyamat,
amelyeken keresztül a sugárzás növeli a mutációk számát, és ezen
keresztül növelheti a rákkockázatot is.
A kis dózis hiperszenzitivitás kapcsán
megfigyelhető, hogy a különböző dózistartományokban különböző
folyamatok aktiválódnak az élő sejtben. Az osztódási képesség
kezdeti meredek csökkenése a programozott sejthalálhoz kapcsolódik,
míg abban a tartományban, ahol az osztódási képesség nő a dózis
függvényében, a DNS-sérülések javítása válik intenzívvé. Előttünk
áll tehát két folyamat, amely ugyan különböző dózistartományokban
különböző intenzitású, de közös abban, hogy sejtek vagy
DNS-sérülések eltüntetésével hozzájárulnak a mutációk számának
csökkentéséhez.
A szakirodalomban olvashatunk arról, hogy az élő
szervezet egyes tulajdonságai magyarázhatóak azzal, hogy
hozzájárulnak a rákkockázat csökkentéséhez. Emiatt is felvetődik
annak a lehetősége, hogy a sejtszinten megfigyelt hiperszenzitív
válasz valójában egy magasabb szintű optimalizáció következménye: az
élő igyekszik minimalizálni a mutációk számát, és ezen keresztül
csökkenteni a rákkockázatot. A sugárterhelés hatására a sejtekben
kialakulnak sérülések, amelyek mutációkhoz vezethetnek. A különböző
sejtekben azonban nem azonos mennyiségű sérülés keletkezik, emiatt
pedig érdemes lehet egyes sejteket hagyni elpusztulni, ami ugyan azt
vonja maga után, hogy más sejteknek osztódással kell pótolni őket,
de ez járhat kevesebb mutációval, mint amennyit megtakarít a szövet
a sérült sejt kiiktatásával. Ugyanakkor a sejtek fogyásával egyre
kevesebb sejtnek kell egyre többet pótolnia, ami egyre
„költségesebb”: az újabb és újabb sejtek likvidálása egyre több
mutációt eredményez. A mutációk minimális szinten tartása az
optimális számú sejt elpusztításával vezethet egy hiperszenzitív
válaszhoz, ahol az osztódásra képes sejtek száma nem monoton módon
változik a dózis függvényében.
Ha viszont a mutációk minimalizálása magyarázza a
hiperszenzitivitást, akkor nem csupán arról van szó, hogy a
hiperszenzitivitás miatt a kockázat nagyobb, mint amit az atombombák
túlélőinek felmérése alapján várunk. Ehelyett arra a következtetésre
juthatunk, hogy a kis dózisok kockázata ennél kisebb. Van ugyanis
egy dózistartomány, ahol az élő képes csökkenteni a besugárzás
következményeit, miközben az exponenciális csökkenésű túlélési
hányadot jellemző dózistartományban erre sokkal kevésbé van
lehetősége.
Lehetséges tehát, hogy miközben az élő rendszer
szabályozása sejtszinten hiperszenzitivitásként mutatkozik meg,
szövetszinten már az érzékenység csökkenéséről, sőt csökkentéséről
van szó. Mindebből jól látszik, hogy egy magasabb szerveződési
szinten értelmet nyerhet egy alacsonyabb szerveződési szinten
meglepő és nehezen megfogható jelenség. A megértésben pedig
kulcsszerepet játszhat a biológiai folyamatok matematikai
modellezése, amely összekapcsolja a különböző szerveződési szinteken
megfigyelhető jelenségeket.
Madas Balázs Gergely publikációt megalapozó kutatása a TÁMOP
4.2.4.A/1-11-1-2012- 0001 azonosító számú Nemzeti Kiválóság Program
– Hazai hallgatói, illetve kutatói személyi támogatást biztosító
rendszer kidolgozása és működtetése országos program című kiemelt
projekt keretében zajlott (A2-EPFK-13-0160). A projekt az Európai
Unió támogatásával, az Európai Szociális Alap társfinanszírozásával
valósult meg. A kutatást a Nemzeti Kutatási, Fejlesztési és
Innovációs Hivatal is támogatta (VKSZ 14-1-2015-0021).
Kulcsszavak: ionizáló sugárzás, kis dózis hiperszenzitivitás,
LNT-modell, mutáció, sugárvédelem
|
|